- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Потенциометрические сенсоры для определения антибиотиков презентация
Содержание
- 1. Потенциометрические сенсоры для определения антибиотиков
- 2. Антибиотики как лекарственные средства являются одними из
- 3. В зависимости от источника и способа получения
- 4. Определение антибиотиков, как одной из групп лекарственных
- 5. Антибиотики - вещества, синтезируемые микроорганизмами и продукты
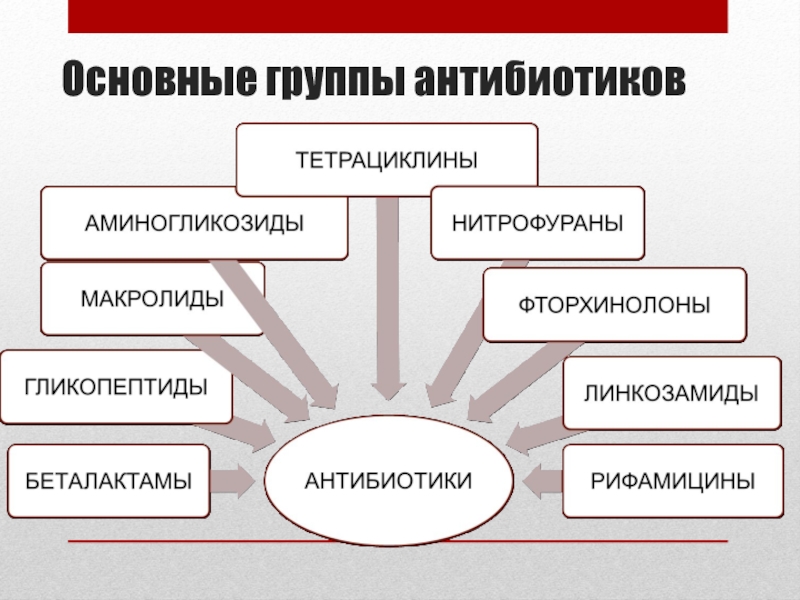
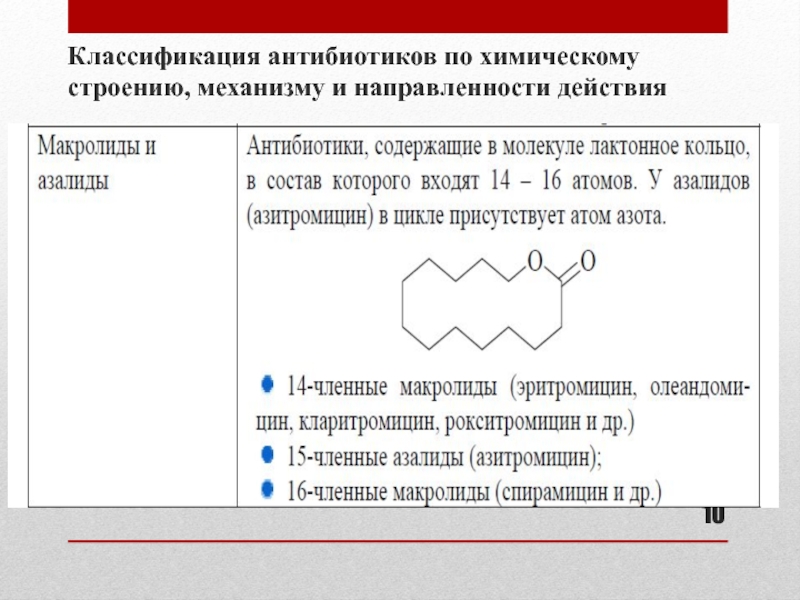
- 6. Основные группы антибиотиков
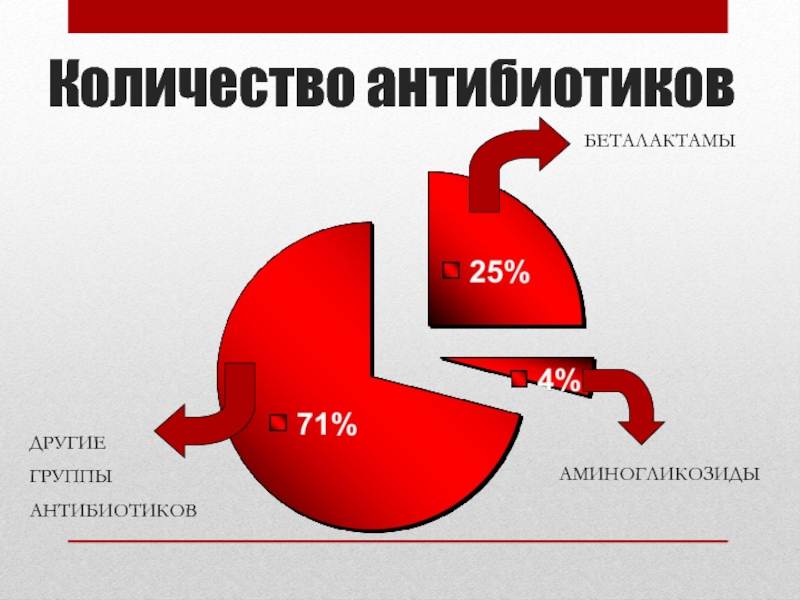
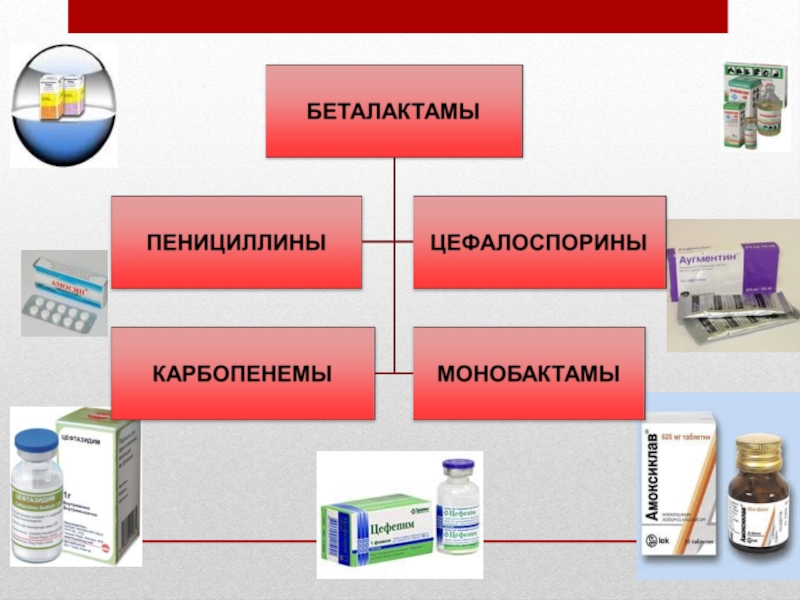
- 7. Количество антибиотиков БЕТАЛАКТАМЫ АМИНОГЛИКОЗИДЫ ДРУГИЕ ГРУППЫ АНТИБИОТИКОВ
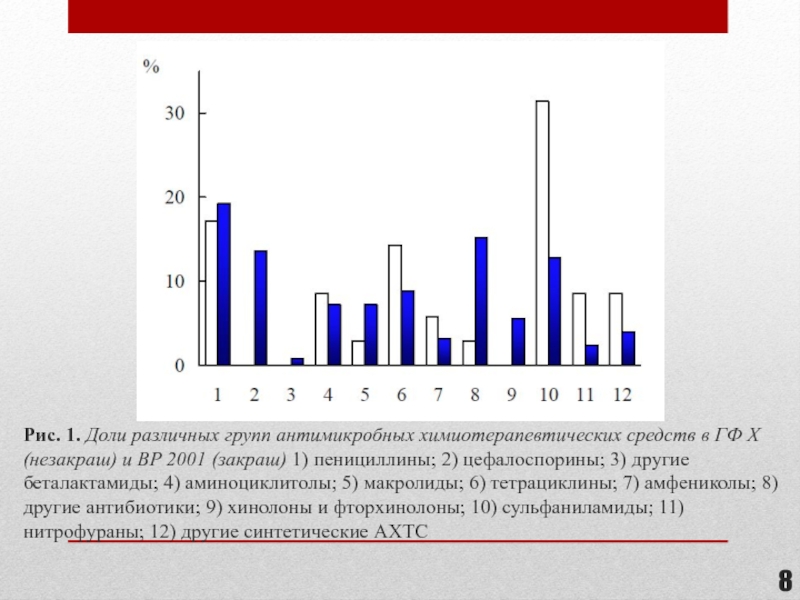
- 8. Рис. 1. Доли различных групп антимикробных химиотерапевтических
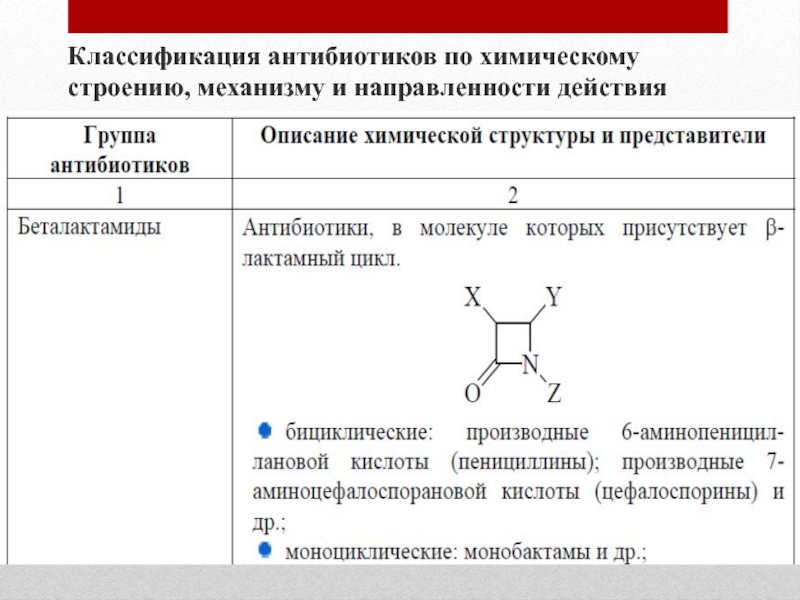
- 9. Классификация антибиотиков по химическому строению, механизму и направленности действия
- 10. Классификация антибиотиков по химическому строению, механизму и направленности действия
- 11. Классификация антибиотиков по химическому строению, механизму и направленности действия
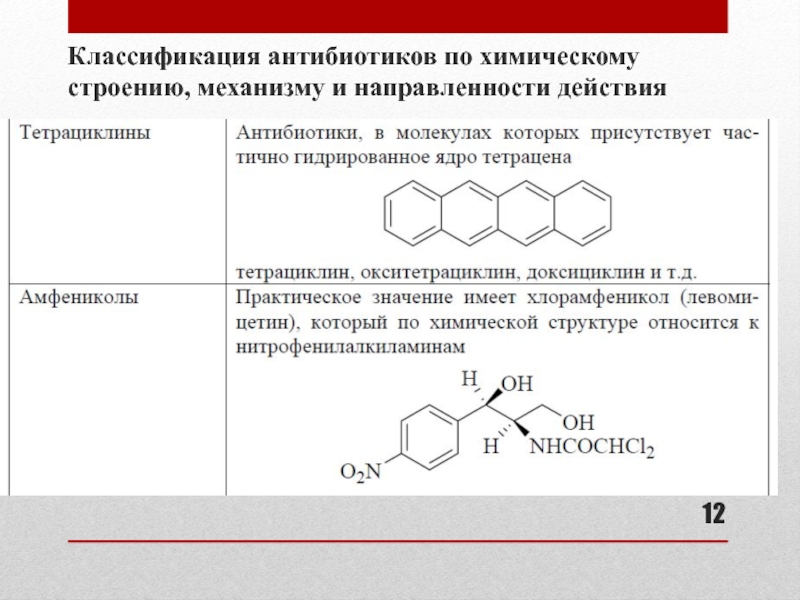
- 12. Классификация антибиотиков по химическому строению, механизму и направленности действия
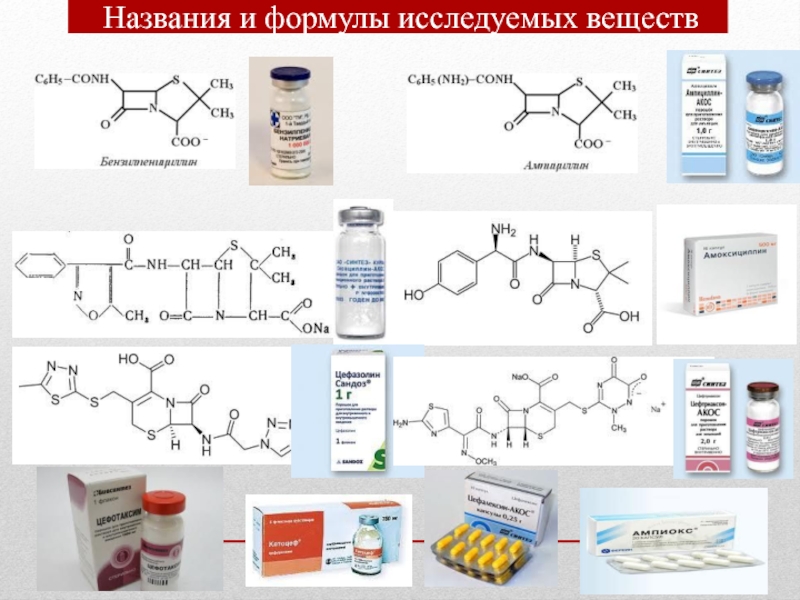
- 14. Названия и формулы исследуемых веществ
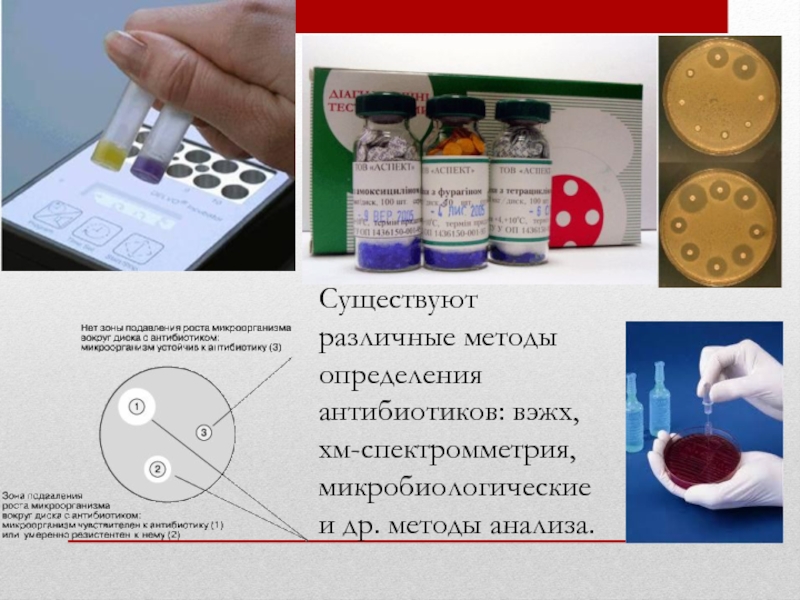
- 15. Существуют различные методы определения антибиотиков: вэжх, хм-спектромметрия, микробиологические и др. методы анализа.
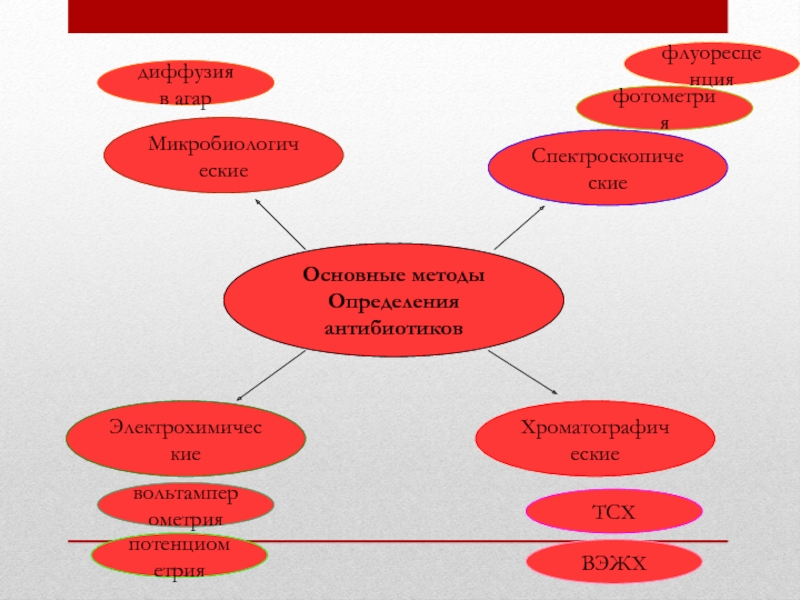
- 16. Основные методы Определения антибиотиков Спектроскопические Хроматографические Микробиологические
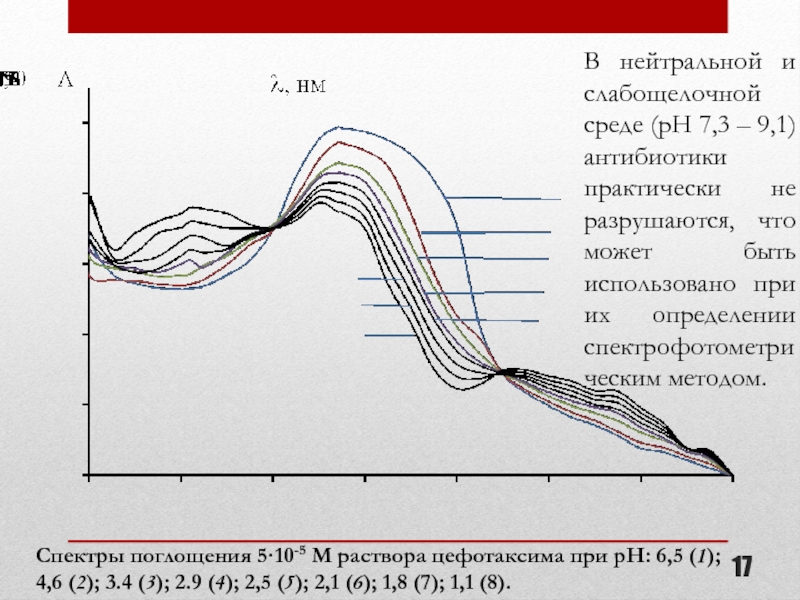
- 17. Спектры поглощения 5·10-5 М раствора цефотаксима
- 18. Потенциометрия с ионоселективными электродами является перспективным, экспрессным,
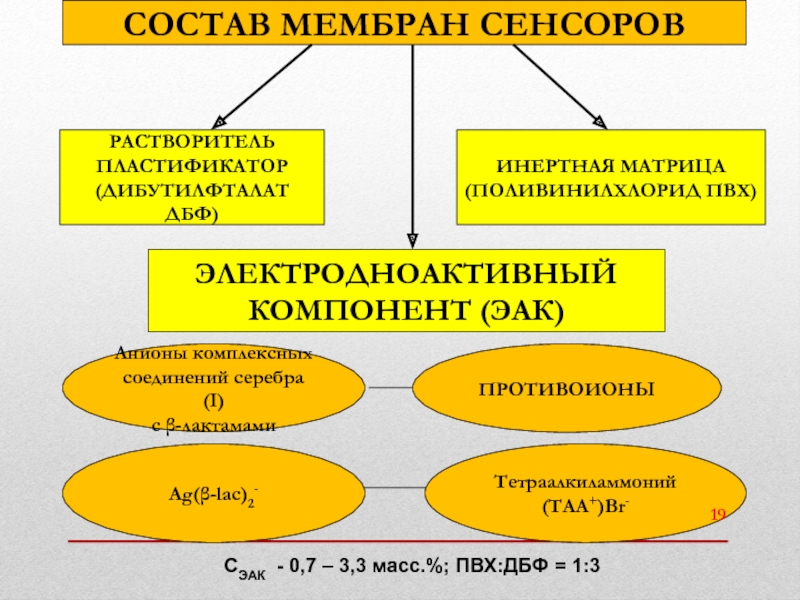
- 19. СОСТАВ МЕМБРАН СЕНСОРОВ РАСТВОРИТЕЛЬ ПЛАСТИФИКАТОР (ДИБУТИЛФТАЛАТ ДБФ)
- 20. Электродные функции сенсоров на основе Ag(β-lac)2TDA в
- 21. ΔE = 2-4 мВ/сут; Время отклика
- 22. Экспрессное и точное количественное определение β-лактамных антибиотиков
- 23. Нами разработаны методики потенциометрического определения β-лактамных антибиотиков
- 25. Результаты ионометрического определения β-лактамных антибиотиков в лекарственных формах (n=3, р=0,95).
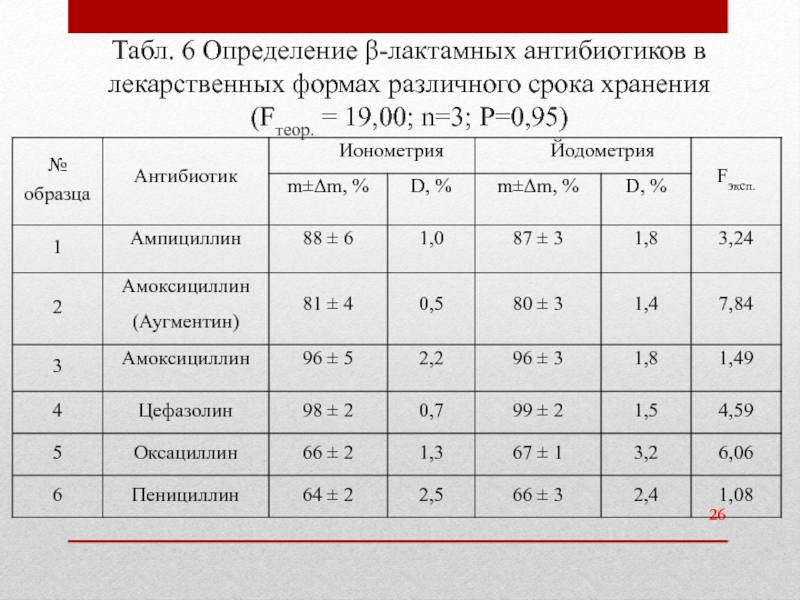
- 26. Табл. 6 Определение β-лактамных антибиотиков в лекарственных
- 27. Компонентами жидкости ротовой полости являются хлориды, карбонаты,
- 28. Методика пробоподготовки ЖРП. Сбор ЖРП производится
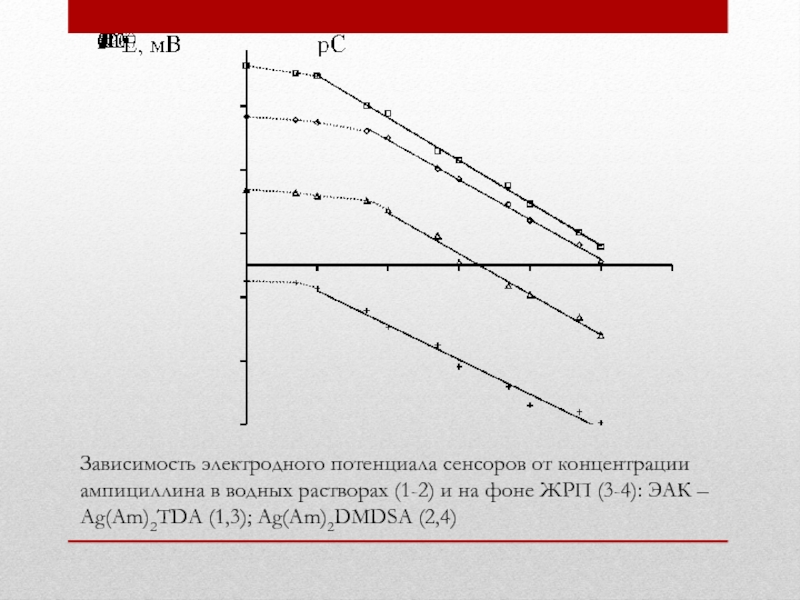
- 29. Зависимость электродного потенциала сенсоров от концентрации ампициллина
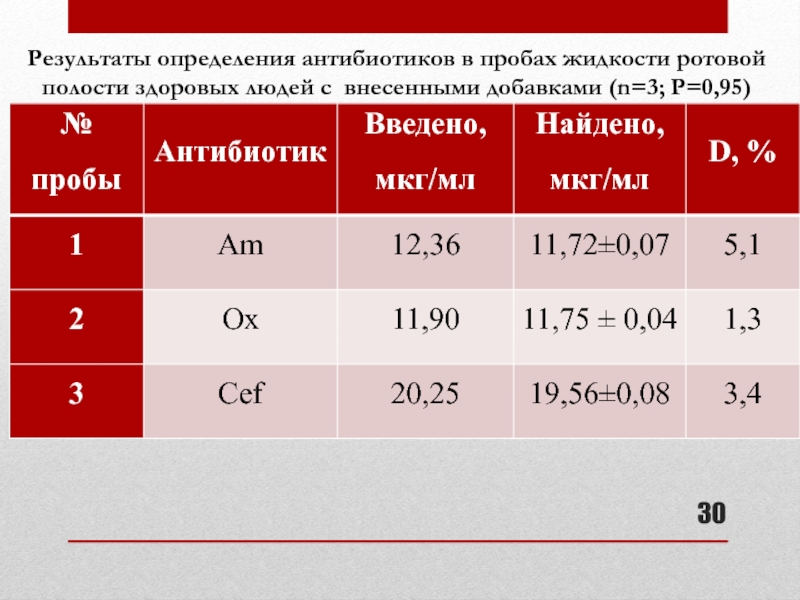
- 30. Результаты определения антибиотиков в пробах жидкости ротовой полости здоровых людей с внесенными добавками (n=3; P=0,95)
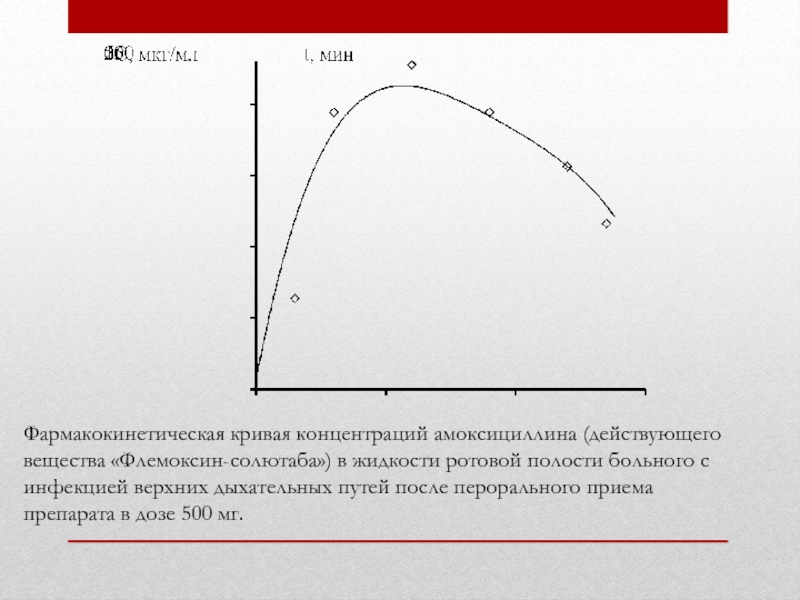
- 31. Фармакокинетическая кривая концентраций амоксициллина (действующего вещества «Флемоксин-солютаба»)
- 32. ПРИНЦИПИАЛЬНАЯ СХЕМА УСТАНОВКИ ДЛЯ
- 35. Для обработки аналитических сигналов от массива сенсоров
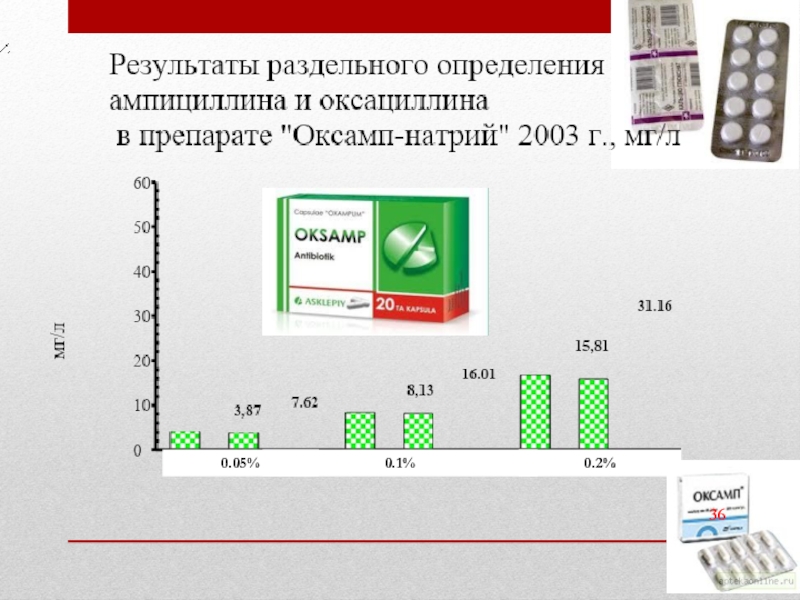
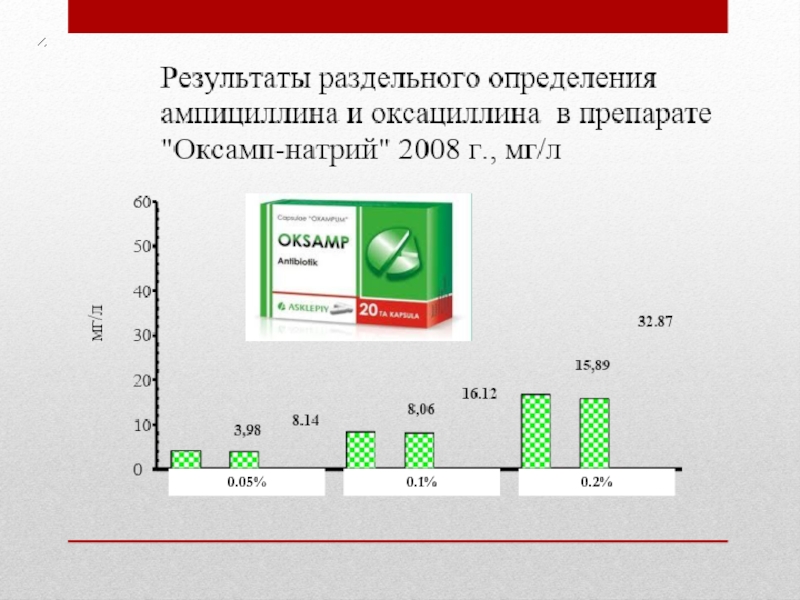
- 36. 0.05% 0.1% 0.2%
- 37. 0.05% 0.1% 0.2%
- 38. Антибиотики применяются в медицине, ветеринарии, пищевой промышленности
- 39. Для количественного определения антибиотиков применяются микробиологические, различные
Слайд 1Потенциометрические сенсоры для определения антибиотиков
Снесарев Сергей Владимирович
аспирант 2-го года обучения
кафедра
и химической экологии
Научный руководитель:
профессор, доктор химических наук
Кулапина Елена Григорьевна
Слайд 2Антибиотики как лекарственные средства являются одними из представителей химиотерапевтических лекарственных средств.
Химиотерапия
Химиотерапевтические средства действуют не на макроорганизм, а на микроорганизм – возбудитель соответствующего заболевания (либо на клетки злокачественных опухолей).
Слайд 3В зависимости от источника и способа получения химиотерапевтические лекарственные средства можно
антибиотики – вещества природного происхождения либо вещества полученные путём модификации природных вещества;
синтетические химиотерапевтические средства (сульфаниламиды, нитрофураны, хинолоны, нитроимидазолы и т.д.)
Слайд 4Определение антибиотиков, как одной из групп лекарственных соединений, получивших широкое распространение,
Слайд 5Антибиотики - вещества, синтезируемые микроорганизмами и продукты модификации этих веществ, избирательно
Антибиотики растительного происхождения называют фитонцидами.
Слайд 8Рис. 1. Доли различных групп антимикробных химиотерапевтических средств в ГФ X
Слайд 15Существуют различные методы определения антибиотиков: вэжх, хм-спектромметрия, микробиологические и др. методы
Слайд 16Основные методы
Определения антибиотиков
Спектроскопические
Хроматографические
Микробиологические
Электрохимические
диффузия
в агар
фотометрия
флуоресценция
вольтамперометрия
потенциометрия
ТСХ
ВЭЖХ
Слайд 17
Спектры поглощения 5·10-5 М раствора цефотаксима при рН: 6,5 (1); 4,6
.
В нейтральной и слабощелочной среде (pH 7,3 – 9,1) антибиотики практически не разрушаются, что может быть использовано при их определении спектрофотометрическим методом.
Слайд 18Потенциометрия с ионоселективными электродами является перспективным, экспрессным, простым, доступным и дешевым
Слайд 19СОСТАВ МЕМБРАН СЕНСОРОВ
РАСТВОРИТЕЛЬ
ПЛАСТИФИКАТОР
(ДИБУТИЛФТАЛАТ ДБФ)
ИНЕРТНАЯ МАТРИЦА
(ПОЛИВИНИЛХЛОРИД ПВХ)
ЭЛЕКТРОДНОАКТИВНЫЙ
КОМПОНЕНТ (ЭАК)
Анионы комплексных
соединений серебра(I)
с β-лактамами
ПРОТИВОИОНЫ
Ag(β-lac)2-
Тетраалкиламмоний
(ТАА+)Br-
СЭАК - 0,7 – 3,3 масс.%; ПВХ:ДБФ = 1:3
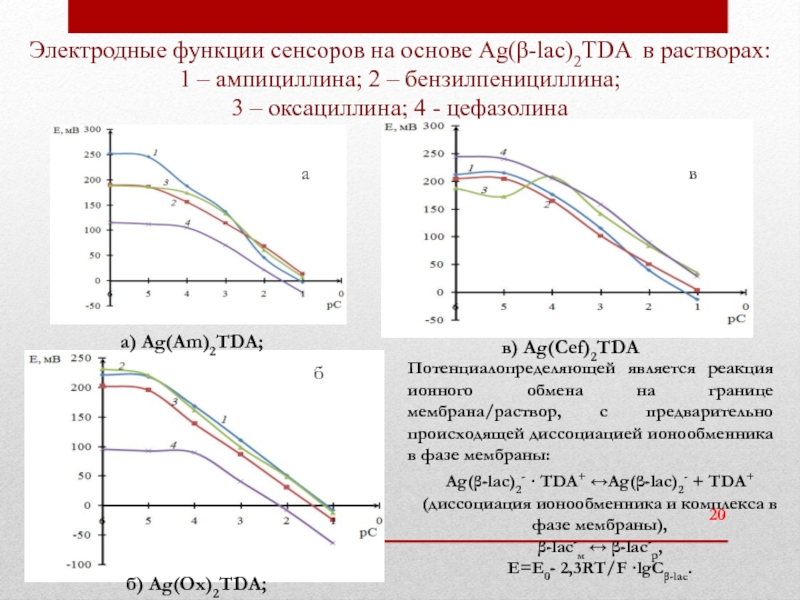
Слайд 20Электродные функции сенсоров на основе Ag(β-lac)2TDA в растворах: 1 – ампициллина;
б) Ag(Ox)2TDA;
Потенциалопределяющей является реакция ионного обмена на границе мембрана/раствор, с предварительно происходящей диссоциацией ионообменника в фазе мембраны:
Ag(β-lac)2- · TDA+ ↔Ag(β-lac)2- + TDA+
(диссоциация ионообменника и комплекса в фазе мембраны),
β-lac-м ↔ β-lac-р,
Е=Е0- 2,3RT/F ·lgCβ-lac.
а
б
в
а) Ag(Am)2TDA;
в) Ag(Cef)2TDA
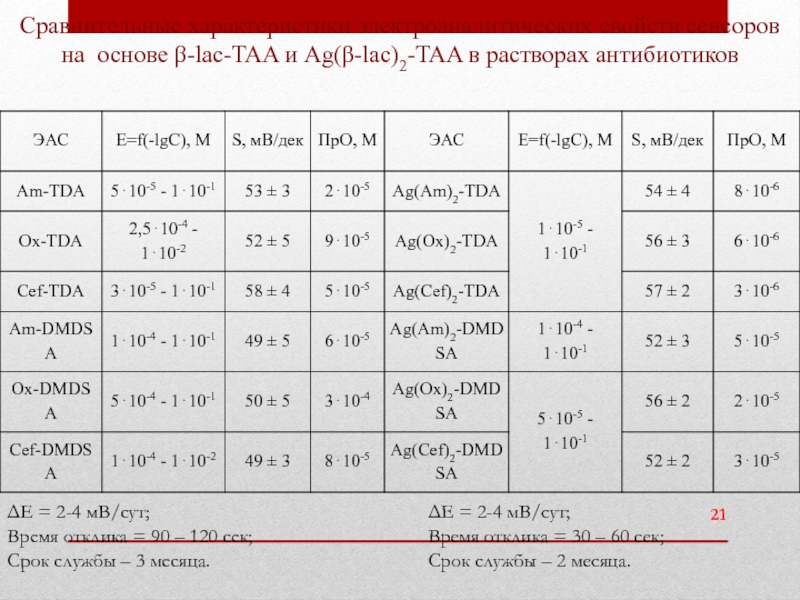
Слайд 21ΔE = 2-4 мВ/сут;
Время отклика = 30 – 60 сек;
Срок
Сравнительные характеристики электроаналитических свойств сенсоров на основе β-lac-TAA и Ag(β-lac)2-TAA в растворах антибиотиков
ΔE = 2-4 мВ/сут;
Время отклика = 90 – 120 сек;
Срок службы – 3 месяца.
Слайд 22Экспрессное и точное количественное определение β-лактамных антибиотиков в биологических жидкостях организма
Слайд 23Нами разработаны методики потенциометрического определения β-лактамных антибиотиков в лекарственных и биологических
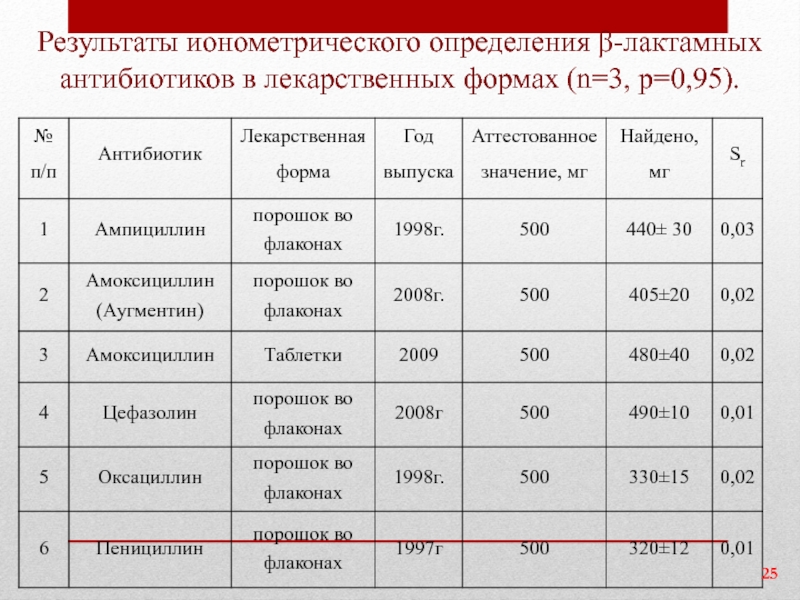
Слайд 25Результаты ионометрического определения β-лактамных антибиотиков в лекарственных формах (n=3, р=0,95).
Слайд 26Табл. 6 Определение β-лактамных антибиотиков в лекарственных формах различного срока хранения
Слайд 27Компонентами жидкости ротовой полости являются хлориды, карбонаты, фосфаты и другие соли
В составе жидкости ротовой полости выделяются различные белки, свободные аминокислоты, некоторые углеводы, мочевина, аммиак и другие вещества.
ЖРП достаточно богата ферментами, она обладает способностью активно расщеплять углеводы
Слайд 28Методика пробоподготовки ЖРП.
Сбор ЖРП производится не ранее, чем через 15
Слайд 29Зависимость электродного потенциала сенсоров от концентрации ампициллина в водных растворах (1-2)
Слайд 30Результаты определения антибиотиков в пробах жидкости ротовой полости здоровых людей с
Слайд 31Фармакокинетическая кривая концентраций амоксициллина (действующего вещества «Флемоксин-солютаба») в жидкости ротовой полости
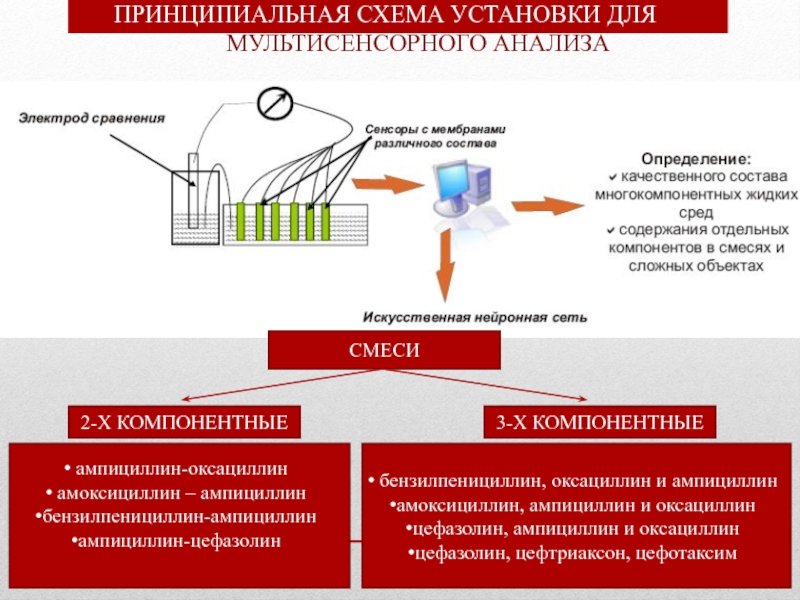
Слайд 32 ПРИНЦИПИАЛЬНАЯ СХЕМА УСТАНОВКИ ДЛЯ
CМЕСИ
2-Х КОМПОНЕНТНЫЕ
3-Х КОМПОНЕНТНЫЕ
ампициллин-оксациллин
амоксициллин – ампициллин
бензилпенициллин-ампициллин
ампициллин-цефазолин
бензилпенициллин, оксациллин и ампициллин
амоксициллин, ампициллин и оксациллин
цефазолин, ампициллин и оксациллин
цефазолин, цефтриаксон, цефотаксим
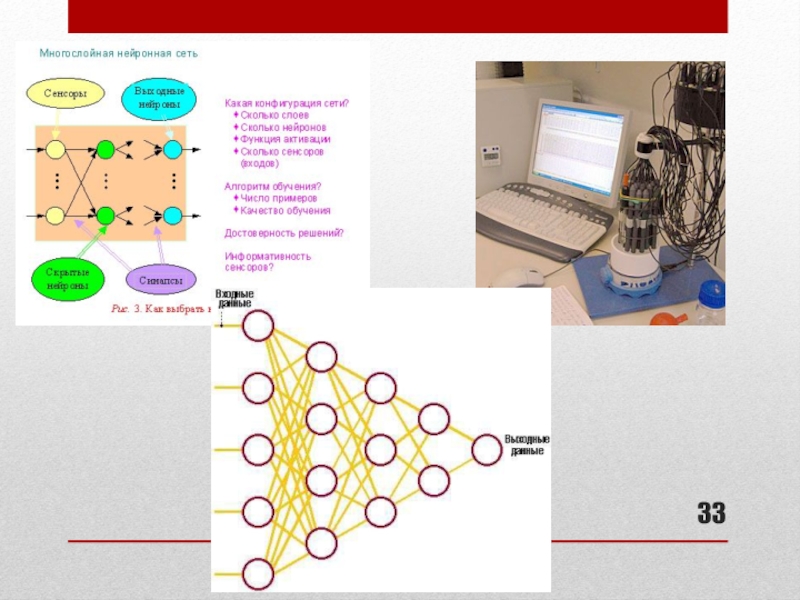
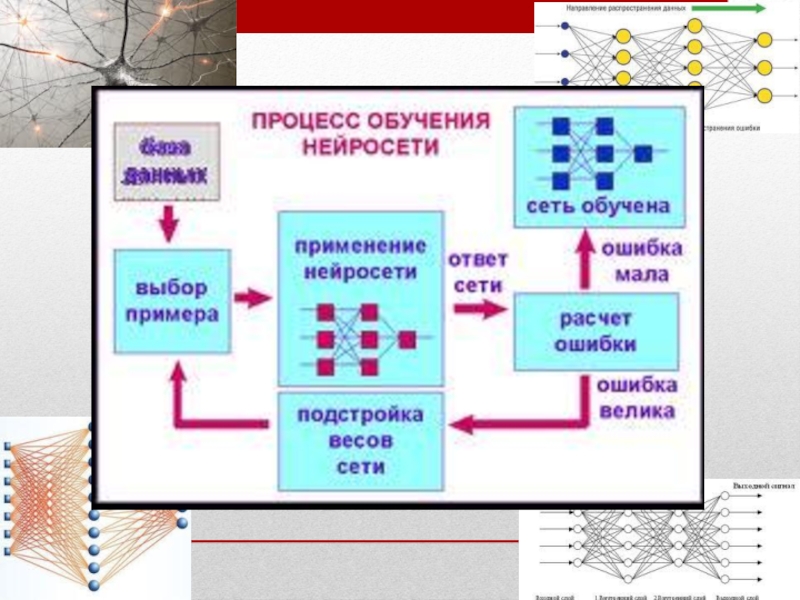
Слайд 35Для обработки аналитических сигналов от массива сенсоров использовали метод искусственных нейронных
Применялась ИНС с обратным распространением ошибок, состоящая из:
10 нейронов в первом слое;
6 нейронов во втором слое;
3 нейронов в третьем слое.
активационная функция – сигмоида, скорость обучения 0,1; момент 0,9; число эпох 20000.
Число калибровочных растворов, используемых для обучения нейронной сети, составляло 15-40.
Слайд 38Антибиотики применяются в медицине, ветеринарии, пищевой промышленности при консервировании, для обработки
В связи с этим требуется контроль за содержанием антибиотиков в лекарственных веществах, биологических жидкостях организма человека и животных, продуктах питания, сточных водах фармацевтических предприятий и других объектах.
Слайд 39Для количественного определения антибиотиков применяются микробиологические, различные варианты хроматографических методов (ВЭЖХ,
Каждый метод имеет свои преимущества и недостатки. Выбор метода зависит от доступности оборудования, наличия персонала, знающего данное оборудование, от количества анализов и их частоты, степени точности и других обстоятельств.