- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Особенности вакцинации отдельных контингентов людей. Вакцины будущего презентация
Содержание
- 1. Особенности вакцинации отдельных контингентов людей. Вакцины будущего
- 2. Индивидуализация вакцинации
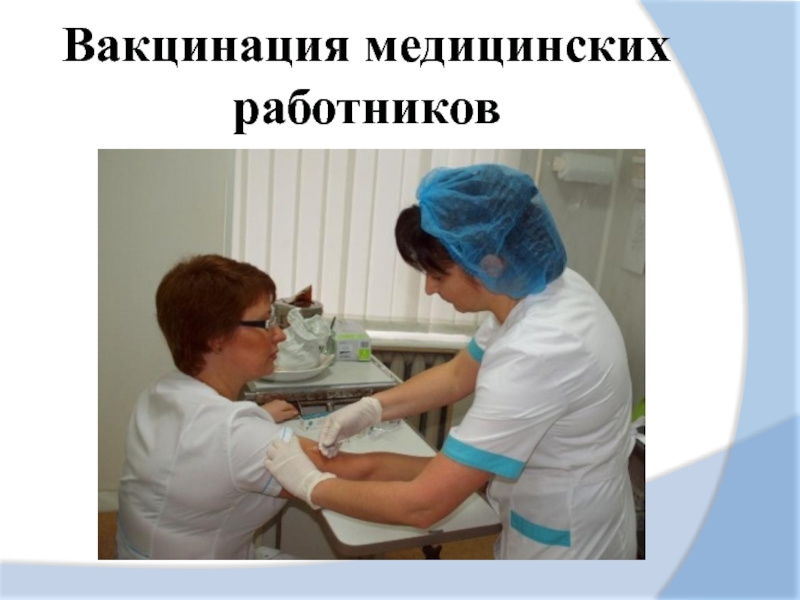
- 3. Вакцинация медицинских работников
- 4. Приказ от 21.03.2014 № 125 H об
- 5. Вакцинация призывников
- 6. - Служба в армии связана с резким
- 7. Организованные контингенты домов престарелых, домов ребенка, интернатов
- 8. Вакцинация выезжающих за рубеж
- 9. Собираясь в поездку, всегда нелишне ознакомиться с
- 10. Желтая лихорадка Эндемичными по желтой
- 11. Брюшной тиф Это заболевание широко
- 12. Бешенство Бешенство встречается более чем в
- 13. Гепатит А Прививка против этой
- 14. Дифтерия, столбняк. Прививки от этих болезней
- 15. Полиомиелит Рекомендовано: Африка: все страны,
- 16. Корь и паротит Все лица, не
- 17. Вакцинация беженцев Россия, Америка, Европа и другие государства организовывают вакцинация беженцев и мигрантов.
- 18. Основной проблемой является утрата сведений о проведенных
- 19. Вакцинация беременных Столбнячный и дифтерийный анатоксин
- 20. Вакцины, применение которых противопоказано беременным Вводятся не
- 21. Вакцинация детей, рожденных ВИЧ-инфицированными матерями Масштабные
- 22. Ежегодно регистрируется увеличение количества беременных,зараженных вирусом
- 23. Тактика иммунизации и выбор вакцин зависят от
- 24. Организационный этап Все дети, родившиеся от ВИЧ-инфицированных
- 25. Организационный этап Медицинские учреждения, проводящие иммунизацию
- 26. Клинический этап Всех детей, рожденных
- 27. Вакцинация против туберкулеза Вопрос о
- 28. Вакцинация против гепатита В Применяют зарегистрированные в
- 29. Вакцинация против дифтерии, столбняка и коклюша
- 30. Вакцинация против кори,эпидемического паротита и краснухи
- 31. Вакцинация против пневмококковой инфекции Детей с перинатальным
- 32. Вакцинация против полиомиелита Детей,
- 33. Вакцинация против гемофильной типа b инфекции
- 34. Вакцинация против гриппа Вакцинацию
- 36. Вакцинация недоношенных детей Практические рекомендации
- 37. Практические рекомендации 6. Недоношенные дети
- 38. Вакцины будущего Различают несколько поколений вакцин
- 39. Многие кандидаты в вакцины не выдерживают лабораторных
- 40. Вакцины будущего Новые вакцины ближайшего
- 41. Вакцины против онкологических болезней В
- 42. Вакцины против ВИЧ-инфекции После регистрации первых
- 43. Вакцины против ВИЧ-инфекции, находящиеся на разных
- 44. Вируснейтрализующие антитела образуются преимущественно к белковым/пептидным вакцинам,
- 45. При клинических испытаниях вакцин против ВИЧ-инфекции следует:
- 46. Вакцина против малярии крайне необходима, особенно для
- 47. Респираторно синцитиальный вирус поражает нижние отделы дыхательных
- 48. Геморрагическая лихорадка Денге Расширение сферы обитания комаров
- 49. Диарея, вызываемая энтеротоксигенными штаммами E. coli является причиной
- 50. Вакцина против дизентерии В мире
- 51. Имеется необходимость в разработке и внедрении в
- 52. По частоте возникновения рак шейки матки, вызываемый вирусом
- 53. МУКОЗАЛЬНЫЕ И НАКОЖНЫЕ ВАКЦИНЫ
- 54. В практике здравоохранения применяются две вакцины: живая
- 55. МИКРОКАПСУЛИРОВАННЫЕ ВАКЦИНЫ Для получения таких вакцин
- 56. ГЕННО-ИНЖЕНЕРНЫЕ ВАКЦИНЫ Рекомбинантная технология совершила прорыв
- 57. СИНТЕТИЧЕСКИЕ ПЕПТИДНЫЕ ВАКЦИНЫ Вирусные и
- 58. ВОЗ одобрила рекомендации по разработке и контролю
- 59. Синтетические пептиды обладают слабой иммуногенностью
- 60. ДНК-ВАКЦИНЫ В настоящее время интенсивно разрабатываются
- 61. Проблемы безопасности при разработке вакцин из плазмидной
- 62. АНТИИДИОТИПИЧЕСКИЕ ВАКЦИНЫ Идиотипом называют структуру, характеризующую
- 63. РАСТИТЕЛЬНЫЕ ВАКЦИНЫ Революционным направлением в
- 64. КОМБИНИРОВАННЫЕ ВАКЦИНЫ Создание многокомпонентных вакцин способствует:
- 65. Комбинированные вакцины Содержат антигены вакцинных штаммов разных
- 66. Основные положения по конструированию и свойствам комбинированных
- 67. Трудности в разработке и применении многокомпонентных вакцин:
- 68. Перспективное направление разработка своеобразных комбинированных вакцин, содержащих
Слайд 2
Индивидуализация вакцинации
Принципы индивидуальной вакцинации распространяются на группы риска:
острые и хронические
иммунодефициты (врожденные, ВИЧ-инфекция, лучевая и лекарственная иммуносупрессия);
медицинские работники;
призывники;
организованные контингенты домов престарелых, домов ребенка, интернатов;
лица выезжающие за рубеж;
беженцы;
беременные;
дети, рожденные от ВИЧ-инфицированных матерей;
недоношенные дети;
Слайд 4Приказ от 21.03.2014 № 125 H об утверждении Национального
календаря профилактических прививок,
вакцинации по эпидемическим показаниям. Согласно
этому приказу все медработники должны сделать прививки
против инфекционных заболеваний, так как они больше всего
подвержены риску заражения.
Приказ о вакцинации медработников, изданный
15.07.1999 №825 «Об утверждении перечня работ,
выполнение которых связано с высоким риском
заболевания инфекционными болезнями и требует
обязательного проведения профилактических прививок».
Согласно Календарю прививок России, прививается все население. Для медицинских работников обязательна иммунизация от следующих инфекционных заболеваний:
от столбняка и дифтерии с ревакцинацией 1 раз в 10 лет;
от гриппа;
иммунизация от кори;
вакцинация и ревакцинация от гепатита B;
вакцинация от краснухи делается тем, кто не привит, или имеет единичный опыт этой прививки, а также не переболевшим.
Люди без информации о том, от чего они уже прививались, также должны пройти иммунизацию.
Вакцинация также проводится по эпидемическим показаниям:
от полиомиелита;
от гепатита A;
от шигеллёза.
Помимо этих прививок, проводится дополнительная вакцинация медработников, имеющих контакт с культурами бруцеллёза, чумы, бешенства, жёлтой лихорадки, клещевого энцефалита, лептоспироза, туляремии, брюшного тифа.
Слайд 6- Служба в армии связана с резким изменением обстановки
- Повышением нагрузок
-
- Призыв на военную службу становится стрессовой ситуацией, в которой наблюдается снижение иммунитета: причины – высокая скученность на призывных пунктах, недосыпание, изменение в рационе, смена климата;
- Обязательным условием для эффективности вакцин являются абсолютное здоровье человека и срок до 2-х недель до выработки иммунитета к инфекциям. При несоблюдении этих правил и возникает ситуация, когда молодой человек заболевает болезнью, от которой был привит, в первые месяцы службы;
- Чтобы этого не произошло, необходимо проводить вакцинацию заранее.
Национальный календарь прививок предписывает вакцинацию от:
от менингококковой инфекции;
от пневмококковой инфекции;
от гемофильной инфекции;
от ветряной оспы (если призывник не болел ветрянкой и не был привит);
против гриппа (осенний призыв).
Слайд 7Организованные контингенты домов престарелых, домов ребенка, интернатов
Все вакцины по Национальному календарю
Дополнительно:
против гемофильной инфекции (из 3 инъекций по 0,5мл с интервалом 1-1,5 месяца) в 3 месяца;
против полиомиелита вакцинируются трехкратно инактивированными вакцинами;
против гриппа (ежегодно)
Слайд 9Собираясь в поездку, всегда нелишне ознакомиться с информацией, какие инфекционные заболевания
Перед тем, как отправиться за путевкой, Вам следует подумать, насколько состояние Вашего здоровья позволяет выехать в ту или иную страну в зависимости от климата, условий питания, особенностей культурного отдыха, необходимости и возможности проведения профилактических прививок, приема лекарственных препаратов для профилактики инфекционных болезней. Для этого Вам рекомендуется проконсультироваться с врачом и с особым вниманием отнестись к его рекомендациям.
Слайд 10
Желтая лихорадка
Эндемичными по желтой лихорадке являются 32 страны Африки и 12
Вакцинация – единственная мера для предупреждения этого опасного заболевания (живая аттенуированная вакцина 17D). Однократная прививка проводится не позднее, чем за 10 дней до выезда. Иммунитет сохраняется в течение 10 лет, после чего проводится повторная прививка.
Противопоказания:
беременные;
дети до 9 месяцев;
лица с иммунодефицитами и болезнями тимуса;
лица с аллергией на яичный желток.
Слайд 11Брюшной тиф
Это заболевание широко распространено в северной части Африки, Индии
Вакцины:
Вакцина брюшнотифозная спиртовая сухая (Россия)
- V – п/к в подлопаточную область 0,5мл; через 25-30 суток 1,0 мл.
- R – через 2 года 1 мл
«Вианвак» - Vi-полисахаридная вакцина (Россия)
- V дети старше 3-х лет, п/к верхняя треть плеча 0,5 мл
- R каждые три года
- антитела образуются через 1-2 недели, сохраняются 2 года
3. «Тифим – Ви» - Vi-полисахаридная вакцина (Франция)
- V детям старше 5 лет, п/к или в/м однократно
- R однократно
- антитела образуются через 2-3 недели, сохраняются 3 года
«Вианвак» и «Тифим – Ви» - противопоказаны беременным!
Слайд 12Бешенство
Бешенство встречается более чем в 150 странах и территориях.
Особенно рекомендуется подумать
Вакцины:
Сухая инактивированная антирабическая вакцина ( Россия);
«Кокав» - культуральная очищенная антирабическая вакцина (Россия);
«Рабипур» – (Германия);
«Индираб» - (Индия);
«КАВ» – (Россия) – доза меньше, чем в «Кокав» и чаще применяется
- V – 0-7 суток – 30 суток п/к
- R – через год
Думать о прививке против бешенства следует не позднее, чем за 3 месяца до поездки. Такая вакцинация защищает от бешенства на 3 годагода.
Слайд 13
Гепатит А
Прививка против этой инфекции (как и против брюшного тифа) актуальна
Вакцины:
«Харвикс 1440» взрослая;
«Харвикс 720» детская;
«Аваксим» (Франция);
«Вакта» (США);
«ГЕП-А-ин-ВАК» (Россия);
- С 3-х лет вакцинация и ревакцинация (детям до 17 лет 0,5 мл взрослым – 1 мл.)
- За 2-3 недели сделать прививку. Одна прививка обеспечивает защиту от года до 5 лет.
Слайд 14Дифтерия, столбняк.
Прививки от этих болезней перед поездкой в определенные страны рекомендованы
Рекомендовано:
Африка: все страны, особенно Западная Африка
Азия: все страны, особенно Индия, Пакистан, Афганистан, Китай, Вьетнам, Лаос и Камбоджа.
Латинская Америка: Перу, Панама, Колумбия и Эквадор
Океания.
Слайд 15Полиомиелит
Рекомендовано:
Африка: все страны, особенно Нигерия, Египет;
Азия: Индия, Пакистан, Афганистан, Таджикистан.
Слайд 16Корь и паротит
Все лица, не получившие хотя бы одну дозу соответствующей
Слайд 17Вакцинация беженцев
Россия, Америка, Европа и другие государства организовывают вакцинация беженцев и
Слайд 18Основной проблемой является утрата сведений о проведенных ранее прививках. В этих
Альтернативной стратегией у лиц с теми или иными отклонениями от состояния здоровья может быть определение специфических антител к дифтерии и столбняку до проведения вакцинации, что определит дальнейшую тактику.
При проведении вакцинации беженцев целесообразно начать с вакцин, защищающих от наиболее часто встречающихся инфекций ( возможно одномоментное введение нескольких вакцин)
1-й визит: БЦЖ + АКДС-I + ОПВ-I + ВГВ-I (доза ОПВ внутрь, внутримышечно 2 инъекции в разные участки тела, которые можно провести синхронно для уменьшения болевых ощущений, и БЦЖ внутрикожно, ее следует проводить отдельно);
2-й визит (через месяц): АКДС-2 + ОПВ-2 + ВГВ-2 (2 внутримышечные инъекции);
3-й визит еще через месяц: тривакцина + АКДС-3 + ОПВ-3 (2 внутримышечные инъекции).
Слайд 19Вакцинация
беременных
Столбнячный и дифтерийный анатоксин в плановом порядке возможно как непривитым
Против гепатита В
Вакцинацию беременных против гриппа можно проводить субъединичными вакцинами «Инфлювак», Агриппол», «Гриппол», «Гриппол плюс» (содержат антигены Н и N) в II и III триместрах беременности.
Беременные, вынужденные совершать поездку в страны с высокой заболеваемостью желтой лихорадкой, должны получать прививку от этой болезни, но не ранее 4-го месяца беременности.
В случае если имеет место риску угрожающего контакта с диким вирусом и требуется срочная защита от полиомиелита, у беременных лучше использовать инактивированную полиомиелитную вакцину.
Вакцинация против коклюша на третьем триместре беременности , между 27 и 36 неделями вакциной Tdap ( США) зарегистрирован в России аналог – «Адасель»
Возможна вакцинация против бешенства.
Для экстренной профилактике кишечных инфекций – соответствующие бактериофаги
Бе
Слайд 20Вакцины, применение которых противопоказано беременным
Вводятся не ранее, чем через 2 недели
против клещевого энцефалита;
коревая;
краснушная;
паротитная;
оральная полиомиелитная вакцина;
живые вакцины против гриппа;
против ветряной оспы;
и другие вакцины!
Слайд 21Вакцинация детей, рожденных ВИЧ-инфицированными матерями
Масштабные последствия ВИЧ-инфекции в России стали очевидными.
В первом полугодии 2017 г. - 52 766 новых случаев ВИЧ-инфекции среди граждан Российской Федерации
Количество новых случаев ВИЧ-инфекции продолжает расти, но темпы роста заболеваемости снижаются: в 2011-2015 годах ежегодный прирост количества новых выявленных случаев инфицирования ВИЧ составлял в среднем 10%, в 2016 г. – 5,3%.
Пораженность ВИЧ-инфекцией на 30 июня 2017 г. составила 618,8 на 100 тыс. населения России.
К наиболее пораженным субъектам Российской Федерации относятся: Иркутская (зарегистрировано 1707,6 живущих с ВИЧ на 100 тыс. населения), Свердловская (1663,3), Кемеровская (1595,7), Самарская (1459,9), Тюменская (1364,4) области, Ханты-Мансийский автономный округ (1294,8), Оренбургская (1259,7), Челябинская (1165,1), Новосибирская (1059,4) области, Пермский край (1047,6), Республика Крым (1010,7), Ульяновская область (946,5), Алтайский край (873,8), г. Санкт-Петербург (868,8), Ленинградская область (861,2), Красноярский край (824,7), Томская (798,2), Курганская (789,4), Тверская (757,1), Омская (710,5) области.
Продолжало наблюдаться перемещение эпидемии в более старшие возрастные группы. В 2000 г. 87% больных получали диагноз ВИЧ-инфекции до 30 лет. На долю подростков и молодежи в возрасте 15-20 лет в 2000 г. приходилось 25% вновь выявленных случаев ВИЧ-инфекции, в 2017 году эта группа составила лишь 1%.
В первом полугодии 2017 г. в Российской Федерации умерло 14 631 больных ВИЧ-инфекцией (на 13,6% больше, чем за аналогичный период 2016 г. – 12 878)
Слайд 22
Ежегодно регистрируется увеличение количества беременных,зараженных вирусом иммунодефицита человека. В 1987-2015 годах
Использование полимеразной цепной реакции (ПЦР) дает возможность ранней диагностики ВИЧ-инфекции, что определяет дифференцированный подход к вакцинации детей, рожденных ВИЧ-инфицированными матерями. Основные принципы вакцинации ВИЧ-инфицированных пациентов изложены в Расширенной программе иммунизации ВОЗ. Наибольшее число научных дискуссий вызывает вопрос использования живых вакцин у ВИЧ-инфицированных пациентов.
Слайд 23Тактика иммунизации и выбор вакцин зависят от следующих факторов:
Стадия заболевания
вид вакцины (живая, инактивированная, рекомбинантная, анатоксин);
цель иммунизации – плановая, но эпидемической ситуации.
Этапы:
Организационный (учет детей, рожденных ВИЧ-инфицированными матерями, дифференцированное диспансерное наблюдение в зависимости от стадии заболевания, определение цели иммунизации – плановая, экстренная, селективная);
Клинический (оценка стадии заболевания, наличия иммунодефицита, выбор вакцинного препарата для плановой, экстренной или селективной иммунизации)
Слайд 24Организационный этап
Все дети, родившиеся от ВИЧ-инфицированных матерей, после выписки из родильного
В детской поликлинике по месту жительства эти дети должны находиться на диспансерном учете у врача, ответственного за проблему ВИЧ/СПИДа, и врача кабинета иммунопрофилактика. Эти специалисты определяют тактику дальнейшего клинического наблюдения, обследования и лечения.
ВИЧ-инфицированных детей, а также детей, имеющих перинатальный контакт, прививают на общих основаниях в медицинских учреждениях государственной и муниципальной систем здравоохранения, имеющих лицензию на медицинскую деятельность (в том числе на проведение вакцинопрофилактики), по месту жительства в прививочном кабинете поликлиники или постоянного места пребывания в закрытом детском учреждении.
Все медицинские документы ребенка (в том числе карта профилактических прививок – ф. 063/у) маркируют установленным шифром: R 75 (контакт), В 23 (ВИЧ-инфекция).
Педиатр-иммунолог поликлиники контролируют процесс иммунизации данной группы детей, представляет их иммунологической комиссии как одну из групп риска.
Индивидуальный график прививок составляется на иммунологической комиссии совместным решением заведующего педиатрическим отделением, педиатра, ответственного за прививочную работу, врача ответственного за проблему ВИЧ/СПИДа, и участкового педиатра на основании окончательного диагноза по основному заболеванию (перинатальный контакт, ВИЧ-инфицирование, заболевание СПИДом) с учетом сопутствующей патологии.
Для иммунизации ВИЧ-инфицированных детей в плановом порядке и по эпидемическим показаниям бесплатно используют отечественные и при необходимости зарубежные вакцины, разрешенные для применения в Российской Федерации в рамках Национального календаря профилактических прививок.
Для селективной иммунизации ВИЧ-инфицированных детей (против гемофильной типа b, пневмококковой, менингококковой инфекций) используют зарубежные вакцины за счет местных органов здравоохранения или ОМС.
Слайд 25Организационный этап
Медицинские учреждения, проводящие иммунизацию ВИЧ-инфицированных детей, обеспечивают безопасность всех прививающихся,
Персонал прививочного кабинета должен быть дополнительно проинструктирован относительно выполнения противоэпидемического режима при иммунизации данного контингента детей.
Персонал прививочных кабинетов при поступлении на работу и периодических медицинских осмотрах проходят обязательное освидетельствование для выявления ВИЧ-инфекции.
Наблюдение в поствакцинальном периоде осуществляет участковая медицинская сестра в установленном для всех вакцинированных порядке.
В случае развития необычных поствакцинальных реакций дети должны быть проконсультированы специалистом по вакцинопрофилактике и при необходимости госпитализированы в боксовое отделение стационара.
Все члены семьи в окружении ВИЧ-инфицированных должны быть планово привиты (вакцинированы и своевременно ревакцинированы) против всех инфекций, включенных в Национальный календарь профилактических прививок, а также против гриппа.
В программу ежегодного обучения врачей и медицинских сестер на местах, а также на факультетах повышения квалификации и профессиональной переподготовки по вопросам вакцинопрофилактики, надлежит включить раздел по иммунизации ВИЧ-инфицированных детей и детей имеющих перинатальный контакт с ВИЧ-инфекцией.
Слайд 26
Клинический этап
Всех детей, рожденных от ВИЧ-инфицированных матерей , до установления окончательного
Для решения вопроса об окончательном диагнозе проводят лабораторное обследование (ИФА, ИБ, ПЦР) в возрасте 1,4,7,12,18 месяцев.
При исключении ВИЧ-инфекции ставят диагноз «перинатальный контакт с ВИЧ-инфекцией», и детей прививают по Национальному календарю профилактических прививок.
Детям с установленным диагнозом «ВИЧ-инфицирование» до введения живых вакцин проводят иммунологическое исследование для исключения иммунодефицита.
Детям с установленным диагнозом «ВИЧ-инфекция» при отсутствии иммунодефицита вводят живые (за исключением БЦЖ) и инактивированные вакцины в соответствии с календарем прививок. При наличии иммунодефицита введение живых вакцин противопоказано. У детей с ВИЧ-инфекцией 3-й стадии по окончании полного курса прививок целесообразно определить титры специфических антител.
Детям с ВИЧ-инфекцией следует проводить дополнительную селективную иммунизацию против гемофильной типа b, пневмококковой, менингококковой инфекцией и гриппа.
Сроки иммунизации определяются Национальным календарем профилактических прививок и наставлениями к иммунобиологическим препаратам.
При иммунизации ВИЧ-инфицированных детей учитывают все сопутствующие заболевания.
Слайд 27
Вакцинация против туберкулеза
Вопрос о вакцинации БЦЖ-М решают после установления окончательного диагноза:
детей
детям с диагнозом «ВИЧ-инфицирование» вакцинацию против туберкулеза не проводят;
привитым детям реакцию Манту проводят на общих основаниях 1 раз в год, непривитым – 1 раз в 6 месяцев.
Слайд 28Вакцинация против гепатита В
Применяют зарегистрированные в Российской Федерации рекомбинантные генноинженерные вакцины
Абсолютные противопоказания к вакцинации новорожденных против гепатита В отсутствуют. Временным противопоказанием к введению вакцины является тяжелое нарушение состояния здоровья.
Слайд 29Вакцинация против дифтерии, столбняка и коклюша
Всем ВИЧ-инфицированным, больным СПИДом и детям
Вакцину против дифтерии, столбняка и коклюша вводят одновременно с вакциной против гемофильной типа b инфекции и полиомиелита, причем детям, больным СПИДом, - только инактивированную, в разные участки тела, разными шприцами.
Слайд 30
Вакцинация против кори,эпидемического паротита и краснухи
Используют моно- и ассоциированные вакцины отечественного
Слайд 31Вакцинация против пневмококковой инфекции
Детей с перинатальным контактом по ВИЧ-инфекции вакцинируют против
Слайд 32
Вакцинация
против полиомиелита
Детей, рожденных ВИЧ-инфицированными матерями, вакцинируют против полиомиелита инактивированными вакцинами.
Иммунизация
Слайд 33Вакцинация против гемофильной типа b инфекции
Вакцина против гемофильной инфекции типа
Слайд 34
Вакцинация против гриппа
Вакцинацию против гриппа проводят инактивированной, расщепленной или субъединичной
Слайд 36
Вакцинация недоношенных детей
Практические рекомендации
Недоношенные новорожденные должны быть вакцинированы в том же
Препараты применяются в обычных дозировках.
Недоношенным детям с массой тела менее 2000 г БЦЖ не вводят. Недоношенные с массой тела более 2000 г должны получать прививку в стационаре, перед выпиской.
Вакцинация против дифтерии, столбняка, коклюша и полиомиелита проводится в календарные сроки АДС вакцины и инактивированной (ИПВ) во избежание распространения вакцинного вируса,
Недоношенные дети нуждаются в проведении вакцинации против гемофильной типа b и пневмококковой инфекций в декретированные сроки, что обусловлено их меньшей сопротивляемостью инфекциям.
Слайд 37
Практические рекомендации
6. Недоношенные дети с массой тела менее 2000 г, рожденные
7. Для недоношенных детей HBs-Ag-негативных матерей оптимальное время вакцинации против гепатита В не должно быть ограничено. Может использоваться любая схема вакцинации, однако лучше отложить иммунизацию против гепатита В до того времени, когда масса ребенка достигнет 2000 г, или вакцинировать их спустя 3 месяца – одновременно с АКДС, ИПВ, ХИБ-препаратами.
8. Вакцинация против ротавирусной инфекции также проводится 3-кратно, начиная с 2-3-месячного возраста. При этом курс иммунизации должен быть завершен как можно раньше (до 6-8 месяцев).
9. Вакцинацию против кори, краснухи, эпидемического паротита и ветряной оспы проводят в сроки, установленные Национальным календарем профилактических прививок.
10. Недоношенных детей с поражениями дыхательной системы необходимо начать прививать против гриппа в самые ранние сроки, то есть по достижении 6-месячного возраста. Наряду с этим следует прививать против гриппа и все ближайшее окружение ребенка, а также медицинский персонал.
11. Недоношенным детям с разной соматической патологией подбирают индивидуальную схему подготовки к вакцинации в зависимости от тяжести заболевания.
Слайд 38Вакцины будущего
Различают несколько поколений вакцин :
I поколение – живые аттенуированные
II поколение – вакцины, состоящие из отдельных фракций возбудителей или их продуктов (химические, анатоксины)
III поколение - рекомбинантные векторные вакцины
IV поколение:
ДНК-вакцины
Пептидные
Синтетические
Антиидиотипические
Содержащие продукты генов МНС
Полученные с помощью трансгенных растений
Слайд 39Многие кандидаты в вакцины не выдерживают лабораторных и клинических испытаний.
За
Современная вакцинология основывается:
на изучении клеточных и молекулярных механизмов развития иммунитета,
использовании точных параметров структуры антигенов и кодирующих их генов,
применении компьютерного анализа при подборе потенциальных эпитопов,
расчете интенсивности иммунного ответа.
Слайд 40Вакцины будущего
Новые вакцины ближайшего будущего
Вакцины против ВИЧ-инфекции
Вакцины против малярии
Вакцины против RS вируса
Вакцины против геморрагической лихорадки Денге
Противодиарейные вакцины
Мукозальные и накожные вакцины
Микрокапсулированные вакцины
Генноинженерные вакцины
Синтетические пептидные вакцины
ДНК-вакцины
Антиидиотипические вакцины
Вакцины, содержащие продукты генов гистосовместимости
Растительные вакцины
Комбинированные вакцины
Слайд 41Вакцины против онкологических болезней
В основе противоопухолевого иммунитета лежат клеточные реакции,
В экспериментальных условиях постоянно испытываются различные варианты вакцин (вакцины, рестриктированные по антигенам гистосовместимости, ДНК-вакцины и др.).
Наиболее перспективными считаются молекулярно-генетические вакцины, содержащие гены, контролирующие синтез ассоциированного с опухолью антигена, костимулирующего фактора (В7) и цитокина (ИЛ-2). Такие вакцины проходят испытания в клинической практике, предварительные данные свидетельствуют о возможности индукции гуморального и клеточного иммунитета.
Следует подчеркивать тесную связь между инфекционными, прежде всего вирусными, заболеваниями и онкологическими болезнями, между вирусами гепатитов В и С и первичным раком печени, между вирусом герпеса (серо-типа 2) и раком шейки матки. Иммунизация против инфекций, вызванных этими вирусами, является одновременно профилактикой онкологических заболеваний.
Слайд 42Вакцины против
ВИЧ-инфекции
После регистрации первых случаев ВИЧ-инфекции прошло всего 20 лет,
ВИЧ-инфекция получила название чумы ХХ в. Сейчас в мире насчитывается 40 млн человек, инфицированных ВИЧ.
В 1989 г. в нашей стране была создана специализированная служба по профилактике ВИЧ-инфекции.
ВИЧ является одним из немногих вирусов, повреждающих иммунную систему, с избирательным поражением СD4-хелперов. Кроме Т-лимфоцитов, клетками-мишенями для ВИЧ являются некоторые субпопуляции В-клеток, макрофаги, ДК, клетки Лангерганса, М-клетки, клетки микроглии. При ВИЧ-инфекции возникает истощение иммунной системы
Насчитывается более 10 основных типов ВИЧ, циркулирующих в разных странах. В России до последних лет доминирующим был подтип В ВИЧ 1-го типа, в настоящее время преобладает подтип А ВИЧ-1.
Вирион ВИЧ-1 содержит 9 основных белков, распределяющихся в сердцевине (р24) и оболочке (gp 160/120, gp 41) вируса, более второстепенную роль в развитии иммунного ответа играют белки полимеразного комплекса (р66, р51, р55, р17).
В мире к настоящему времени создано более 30 вариантов экспериментальных вакцин против ВИЧ, которые находятся на разных стадиях экспериментального или клинического изучения.
Слайд 43 Вакцины против ВИЧ-инфекции, находящиеся на разных стадиях клинических испытаний:
белковые
ДНК-вакцины,
рекомбинантные вакцины,
вакцины с использованием вирусных и бактерийных векторов (вирус оспы канарейки, сальмонеллы и др.).
Слайд 44Вируснейтрализующие антитела образуются преимущественно к белковым/пептидным вакцинам, а клеточный иммунитет -
Вакцины против ВИЧ-инфекции должны быть направлены на профилактику, лечение заболевания и прекращение передачи вируса между людьми.
Необходима разработка новых подходов к созданию профилактических и лечебных биологических препаратов против ВИЧ-инфекции. При создании и проверке вакцин необходимо учитывать субтипы вирусов, циркулирующих в стране стандартные и высокочувствительные методы диагностики (полимеразная цепная реакция и др.).
Слайд 45При клинических испытаниях вакцин против ВИЧ-инфекции следует:
• определять у вакцинированных людей
• исследовать персистенцию вируса у пациентов, участвующих в испытаниях;
• использовать не менее двух методов определения антител, прежде всего метод обнаружения вируснейтрализующих антител;
• оценивать уровень клеточного иммунитета, например, по количеству цитотоксических СD8-Т-лимфоцитов.
Слайд 46Вакцина против малярии
крайне необходима, особенно для южных регионов Африканского континента.
В
На трех стадиях испытаний находятся несколько вариантов вакцины против малярии, включая ДНК-вакцину.
Любая из этих вакцин будет принята, если ее эффективность будет составлять хотя бы 50%.
Слайд 47Респираторно синцитиальный вирус
поражает нижние отделы дыхательных путей и часто вызывает пневмонии
Ежегодно болеют 64 млн детей, из них 160 тыс. случаев заканчиваются летальным исходом.
Вакцина, приготовленная из убитых формалином вирусов, оказалась неэффективной. Более того, при контакте с живым вирусом у вакцинированных людей развивались более тяжелые формы болезни по сравнению с заболеваниями у непривитых.
Предполагается, что профилактической эффективностью могут обладать живые аттенуированные вакцины.
Слайд 48Геморрагическая лихорадка Денге
Расширение сферы обитания комаров - переносчиков вируса геморрагической лихорадки Денге
В настоящее время эта инфекция распространена более чем в 100 странах, в мире ежегодно насчитывается около 50 млн случаев лихорадки денге, летальные исходы заболевания регистрируются редко.
Разрабатываются различные виды вакцин: аттенуированные, рекомбинантнтые, субъединичные, ДНК-вакцины. Появление вакцин на рынке ожидается через 7-10 лет.
Слайд 49Диарея, вызываемая энтеротоксигенными штаммами E. coli
является причиной гибели 2 млн людей ежегодно.
Слайд 50Вакцина против дизентерии
В мире 91 млн людей инфицированы возбудителями дизентерии, ежегодно от
Среди разрабатываемых вакцин наиболее эффективными считаются те, которые содержат много антигенных субтипов возбудителей дизентерии.
«Шигеллвак» вакцина дизентерийная против шигелл Зонне липополисахаридная жидкая (Россия)
Слайд 51Имеется необходимость в разработке и внедрении в практику вакцин против паразитов,
Лейшманиозом страдают в мире 12 млн человек, ежегодно регистрируется 41 тыс. смертельных случаев от этого заболевания.
В отношении шистосомоза эти показатели составляют соответственно 200 млн и 11 000;
несколько вариантов вакцин против этих заболеваний находятся на разных стадиях испытаний.
Слайд 52По частоте возникновения рак шейки матки, вызываемый вирусом папилломы человека (ВПЧ), стоит на
Около 630 млн людей заражены вирусом папилломатоза, ежегодно возникают около 500 тыс. новых случаев заболевания, количество летальных исходов составляет 280 тыс. в год.
Разрабатывается несколько вариантов лечебных и профилактических вакцин, большинство из которых составляют рекомбинантные вакцины.
В мире существует две вакцины для профилактики ВПЧ-инфекции - «Церварикс*» (16-й, 18-й типы) и «Гардасил*» (6, 11, 16, 18-й типы). Обе вакцины зарегистрированы на территории России.
Более чем в 40 странах мира эти вакцины включены в программы национальной иммунизации против ВПЧ-инфекции и рака шейки матки.
Слайд 53
МУКОЗАЛЬНЫЕ И НАКОЖНЫЕ ВАКЦИНЫ
Такие вакцины вводятся через естественные пути проникновения инфекционных
Кожа и слизистые оболочки отличаются богатым содержанием клеток, принимающих участие в фагоцитозе, переработке антигенного материала и представлении антигена Т-клеткам. Хорошо развитая сеть лимфатических сосудов и региональных лимфатических узлов обеспечивают быстрое формирование иммунитета.
Разработка мукозальных вакцин идет по трем направлениям: 1)использование per os обычных вакцин, применяемых парентерально , 2)конструирование специальных вакцин 3)использование адъювантов или носителей.
Один из подходов создания новых вакцин заключается в разработке средств, препятствующих колонизации возбудителей инфекционных заболеваний на поверхности слизистых оболочек.
Основу таких вакцин может составить белок-адгезин, который находится на концах пилей - специальных волосков, с помощью которых бактерии прикрепляются к поверхности слизистой оболочки. Введение такого адгезина сопровождается образованием антител, которые препятствуют колонизации бактерий и развитию инфекционного процесса. Такой же эффект наблюдается при введении готовых антител.
Слайд 54В практике здравоохранения применяются две вакцины: живая полиомиелитная вакцина, вводимая per os, и
Перспективным направлением в создании мукозальных вакцин является использование живых векторных вакцин на основе Salmonella tythimurium, которые вызывают не только гуморальный, но и клеточный иммунитет.
Накожные вакцины предназначены для транскутанной иммунизации. Ее можно осуществить с помощью накожной аппликации пластыря, содержащего антиген. Антиген проникает через кожу в течение 15 мин после аппликации и вызывает образование антител против многих возбудителей инфекционных заболеваний: холеры, столбняка, дифтерии, гриппа, бешенства и др.
При интраназальной вакцинации в секретах слизистых оболочек и сыворотке крови появляются IgA- и IgG-антитела в высоких титрах. На большие дозы антигена могут возникать побочные явления: профузное выделение секрета из носа, зуд, чиханье.
Слайд 55МИКРОКАПСУЛИРОВАННЫЕ ВАКЦИНЫ
Для получения таких вакцин используются биодеградирующие микросферы
предохраняют антиген от
распадаются и высвобождают антиген в заданное время.
Микрокапсулы состоят из нетоксичных неантигенных полимеров лактида или гликолида или их сополимеров.
Микросферы могут быть разной величины, максимальный диаметр обычно не превышает 10 мкр.
Вакцины можно вводить любым способом (парентерально, орально, интраназально и др.).
С помощью микросфер можно проводить комплексную вакцинацию против нескольких инфекций одновременно: каждая капсула может содержать несколько антигенов, а для иммунизации можно брать смесь различных микрокапсул.
сами микрокапсулы обладают выраженным адъювантным действием. Это позволяет уменьшить дозы вводимых антигенов.
Требуют дальнейшего исследования вопросы стабилизации микрокапсулированных вакцин, утилизации деградирующих полимеров
Слайд 56ГЕННО-ИНЖЕНЕРНЫЕ ВАКЦИНЫ
Рекомбинантная технология совершила прорыв в создании принципиально новых вакцин. Принцип
Экспериментальные векторные вакцины на основе вируса осповакцины получены к ветряной оспе, гриппу А, гепатитам А и В, малярии, простому герпесу. К сожалению, вакцины испытаны преимущественно на животных, которые устойчивы к большинству из этих инфекций. Иммуногенность такого продукта может быть сниженной.
Для создания бактериальных рекомбинантных вакцин. Важным этапом является клонирование генов и получение мутантных генов, кодирующих иммуногенные, но не токсические формы антигена. Клонированы гены для дифтерийного и столбнячного токсинов, токсина синегнойной палочки, сибиреязвенного, холерного, коклюшного, шигеллезного токсинов.
В качестве носителя бактериального вектора используется БЦЖ*, Vibrio cholerae, Escherichia coli, Salmonella tythimurium
Живые рекомбинантные вакцины, введенные через рот, имеют короткий период жизни, но способны за этот период вызвать стойкий иммунитет.
Возможно создание многокомпонентных вакцин для одномоментной профилактики против нескольких диарейных инфекций.
Бактериальные векторные вакцины, в отличие от вирусных, можно контролировать с помощью антибиотиков.
Прошли экспериментальную проверку оральные вакцины против гепатита В и малярии.
В перспективе предполагается использовать векторы, в которые встроены не только гены, контролирующие синтез протективных антигенов, но и гены, кодирующие различные медиаторы иммунного ответа.
Слайд 57
СИНТЕТИЧЕСКИЕ ПЕПТИДНЫЕ ВАКЦИНЫ
Вирусные и бактерийные пептиды, образующиеся из персистирующих в клетках
Экзогенные антигены, попадающие в клетку в составе лизосом, расщепляются до пептидов, которые в комплексе с антигенами гистосовместимости класса II активируют CD4-Т-хелперы.
В 1974 г. М. Села впервые описал искусственно полученный пептид, вызывающий образование антител к яичному лизоциму.
При определенных условиях синтетические пептиды могут обладать такими же иммуногенными свойствами, как и естественные антигены, выделенные из возбудителей инфекционных заболеваний.
Экспериментальные синтетические вакцины получены против дифтерии, холеры, стрептококковой инфекции, гепатита В, гриппа, ящура, клещевого энцефалита, пневмококковой и сальмонеллезной инфекций. Ни один препарат такого типа не используется в международной медицинской практике (синтетические пептиды найдут широкое применение в качестве вакцин).
У синтетических пептидов нет недостатков, характерных для живых вакцин (реверсии патогенных свойств, остаточной вирулентности, неполной инактивации и т.п.).
Синтетические вакцины отличаются высокой степенью стандартности, обладают слабой реактогенностью, безопасны, с помощью таких вакцин можно избежать развития аутоиммунных процессов при иммунизации.
При использовании доминантных пептидов можно получить вакцины против возбудителей с высокой степенью изменчивости.
Слайд 58ВОЗ одобрила рекомендации по разработке и контролю синтетических пептидных вакцин (1997).
должен быть детально отработан метод искусственного синтеза выбранных пептидов и получены доказательства устойчивости такого синтеза.
идентифицированы отдельные пептиды,
определены модифицирующие гликозильные, липидные и другие группировки,
охарактеризованы примеси, которые могут быть при синтезе пептидного мономера, описаны методы его очистки
Слайд 59
Синтетические пептиды обладают слабой иммуногенностью
Для их стабилизации, доставки к иммунокомпетентным клеткам
Носитель не только помогает пептиду, но и способен индуцировать ответ на себя, который не должен доминировать над ответом к пептиду и нарушать его специфичность.
Все химические и биологические реагенты, используемые в процессе получения вакцины, должны удовлетворять требованиям международной или национальной фармакопеи.
Доклиническая фаза изучения пептидных вакцин должна включать: биологические, биохимические, иммунологические, токсикологические, гистопатологические исследования, испытания разных доз и схем введения препарата, получение доказательств его стабильности и безвредности. В рамках рутинного контроля определяются пирогенность, стерильность, иммуногенность и другие параметры безопасности и активности вакцин..
Слайд 60ДНК-ВАКЦИНЫ
В настоящее время интенсивно разрабатываются вакцины из плазмидных ДНК, кодирующих протективные
Такая ДНК, введенная животному, проникает в ядро клетки, длительное время существует вне хромосом без репликации, транскрибируется и экспрессирует соответствующие антигены, вызывающие в организме привитого формирование иммунитета.
ДНК-вакцина индуцирует Т- и В-клеточный иммунитет, другие механизмы развития иммунного ответа на ДНК-вакцины остаются неизученными.
ДНК-вакцина может проникать непосредственно в макрофаг или дендритную клетку, в которых существуют хорошие условия для образования комплексов антигена с продуктами генов MHC и представления этих комплексов Т-хелперам и цитотоксическим Т-лимфоцитам.
Этот процесс может происходить в участке инъекции ДНК-вакцины, регионарных лимфатических узлах и других лимфоидных органах, куда антиген поступает быстро после его внутримышечного введения.
Слайд 61Проблемы безопасности при разработке вакцин из плазмидной ДНК: более важными.
Прежде всего
Длительная экспрессия антигена может вызывать иммунопатологические реакции. Образование антигена в организме может продолжаться несколько месяцев. Это может привести к развитию различных форм иммуносупрессии и других патологических явлений.
Использование генов, кодирующих цитокины или другие костимулирующие молекулы, представляет собой определенный риск. Назначением таких медиаторов, образующихся in situ благодаря введению дополнительных плазмидных ДНК, является усиление иммунного ответа к ДНК-вакцине (цитокины в высоких концентрациях могут вызывать различные формы патологии, например, интенсивное образование провоспалительных цитокинов может спровоцировать длительный воспалительный процесс.
Чужеродная ДНК может вызывать образование анти-ДНК-антител, которые в силу перекрестных свойств способны индуцировать различные формы аутоагрессии и иммунопатологии.
Сам экспрессированный антиген может обладать побочным биологическим действием.
Вакцины можно получать не только из ДНК, но и из РНК. Такие вакцины более безопасны в отношении бластогенного эффекта, однако они нестабильны и вызывают кратковременный иммунитет. Производство РНК-вакцины более трудоемкое.
Слайд 62АНТИИДИОТИПИЧЕСКИЕ ВАКЦИНЫ
Идиотипом называют структуру, характеризующую индивидуальные антигенные свойства V-области молекулы антител
Антиидиотипические антитела являются зеркальным отражением антигена и поэтому способны вызывать образование антител и цитотоксических клеток, реагирующих с антигеном.
Идиотипы отличаются от видоспецифических, изотипических и аллотипических маркеров клеточных рецепторов и антител.
Идиотипы способны взаимодействовать с антигеном и антиидиотипическими антителами.
Для приготовления вакцин могут быть использованы как гомологичные, так и гетерологичные идиотипы.
Вакцины безопасны, так как идиотипы являются естественными эндогенными регуляторами иммунного ответа.
Производство таких вакцин удобно в тех случаях, когда трудно получить достаточное количество антигена и он слабо иммуногенен.
С помощью таких вакцин не удается достичь необходимого уровня нейтрализующих антител и напряженного иммунитета.
При использовании гетерологичных идиотипов возможны аллергические реакции
Слайд 63РАСТИТЕЛЬНЫЕ ВАКЦИНЫ
Революционным направлением в современной вакцинологии является разработка вакцин на основе
Впервые эта концепция была выдвинута в 1995 г. C. Arntzen и его группой. Было показано, что листья трансгенных растений табака способны экспрессировать HBsAg. Полученный из растений и частично очищенный антиген, введенный мышам, вызывает иммунный ответ подобно вакцине против гепатита В.
Показана возможность образования IgG- и IgA-антител к энтеротоксину E. coli при скармливании мышам клубней трансгенного картофеля.
Преимущества практического использования растительных вакцин:
Оральный способ иммунизации самый безопасный.
Ассортимент пищевых источников растительных вакцин не ограничен.
Немаловажное значение имеет высокая экономичность растительных вакцин
Слайд 64КОМБИНИРОВАННЫЕ ВАКЦИНЫ
Создание многокомпонентных вакцин способствует:
• упрощению календаря прививок и сокращению числа прививок;
• уменьшению
• сокращению числа амбулаторных приемов и вызовов;
• сокращению расходов на упаковки, ампулы, шприцы и др.;
• решению этических проблем, связанных с необходимостью многократного введения вакцин.
Слайд 65Комбинированные вакцины
Содержат антигены вакцинных штаммов разных возбудителей:
АКДС-вакцина
Дивакцина (корь-паротит)
Тривакцина (корь-паротит-краснуха)
Гепатит А
АКДС+инактивированная против полиомиелита
АКДС_против Гепатита В и др.
Содержит антиген разных серотипов одного и того же возбудителя:
трехвалентная полиомиелитная вакцина
Менингококковые вакцины из из 2-4 серотипов
Пневмококковая из многих серотипов пневмококка
Значение разработки новых комплексных вакцин:
Медицинское
Экономическое
Социальное
Слайд 66Основные положения по конструированию и свойствам комбинированных вакцин
Комплексные вакцины могут быть
Теоретически количество компонентов в ассоциированных вакцинах может быть неограниченным.
Сильные в иммунологическом отношении антигены могут угнетать активность слабых антигенов. Это зависит не от числа антигенов, а от их свойств. При введении комплексных препаратов может происходить запаздывание и быстрое угасание иммунного ответа на отдельные компоненты по сравнению с ответом на моновакцины.
Дозы слабых антигенов в вакцине должны быть выше по сравнению с дозами других компонентов.
В некоторых случаях наблюдается феномен синергии, когда один компонент вакцины стимулирует активность другого антигенного компонента.
Иммунизация комбинированной вакциной не влияет существенно на интенсивность иммунного ответа при введении других вакцин при условии соблюдения определенного промежутка времени после вакцинации комплексным препаратом.
Побочная реакция организма на ассоциированную вакцину не является простой суммой реакций на моновакцины. Реактогенность комплексной вакцины может быть равной, несколько выше или ниже реактогенности отдельных вакцин.
Слайд 67Трудности в разработке и применении многокомпонентных вакцин:
возможность конкуренции и интерференции
физико-химическая несовместимость некоторых антигенов, стабилизаторов, консервантов, адъювантов и других составных частей вакцины;
недостаточная стабильность сложных комбинаций из антигенов;
различная длительность приобретенного иммунитета к отдельным компонентам комплексной вакцины, что препятствует определению оптимального интервала между повторными введениями комбинированной вакцины;
экспериментальные разработки и клинические испытания комплексных вакцин являются трудоемкими, длительными и дорогостоящими;
лабораторный контроль комплексных вакцин сложнее, чем контроль моновакцин. Возможны большие материальные потери в случае производственного или рекламационного брака одного из компонентов сложной вакцины;
не все комплексные вакцины пригодны для любой страны. Особенности эпидемиологической ситуации в отдельных странах требуют применения особых сочетаний моновакцин. Свои комбинации моновакцин нужны для вакцинации отдельных возрастных контингентов населения и групп риска.