- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Новые перспективы патогенетической терапии рассеянного склероза презентация
Содержание
- 1. Новые перспективы патогенетической терапии рассеянного склероза
- 2. Ноябрь 2013 Регистрация в Канаде Сентябрь 2012
- 3. Абаджио: показание и дозировка Абаджио показан
- 4. Абаджио (терифлуномид) Aбаджио® Инструкция по медицинскому применению
- 5. Точный механизм действия терифлуномида продолжает изучаться. ДГОДГ,
- 6. Механизм действия Абаджио® Adapted from Gold R
- 7. ГЭБ ЦНС Периферия B РС
- 8. Одна из самых обширных программ клинических исследований
- 9. Обзор опорных исследований
- 10. TEMSO и TOWER: исходные
- 11. Доказанное снижение среднегодовой частоты обострений на фоне
- 12. Абаджио значительно снизил риск прогрессии инвалидизации, подтвержденной
- 13. Абаджио эффективен у больных с активным течением
- 14. Абаджио снижает активность РС по МРТ параметрам.
- 15. Сравнительное исследование эффективности терифлуномида и высокодозного подкожного
- 16. Эффективность терифлуномида
- 17. Частота прекращения лечения при приеме Абаджио меньше,
- 18. Эффективность Абаджио в отношении снижения частоты осложненных обострений РС
- 19. Абаджио снижает тяжесть обострений Более выраженный эффект
- 20. Долгосрочная эффективность Абаджио
- 21. Эффективность терифлуномида поддерживается в течение длительного времени
- 22. Средний балл EDSS оставался стабильным в течение
- 23. Обзор данных по безопасности Абаджио Частота серьезных
- 24. Обзор безопасности Самый частые побочные эффекты редко
- 25. Обзор безопасности a Нежелательные явления с распространенностью
- 26. Объединенный анализ показателей безопасности: нарушения функции печени
- 27. Истончение волос в сводных исследованиях 2 фазы и
- 28. АНАГЕНОВАЯ АЛОПЕЦИЯ: (химиотерапия) Механизмы выпадения волос Истончение
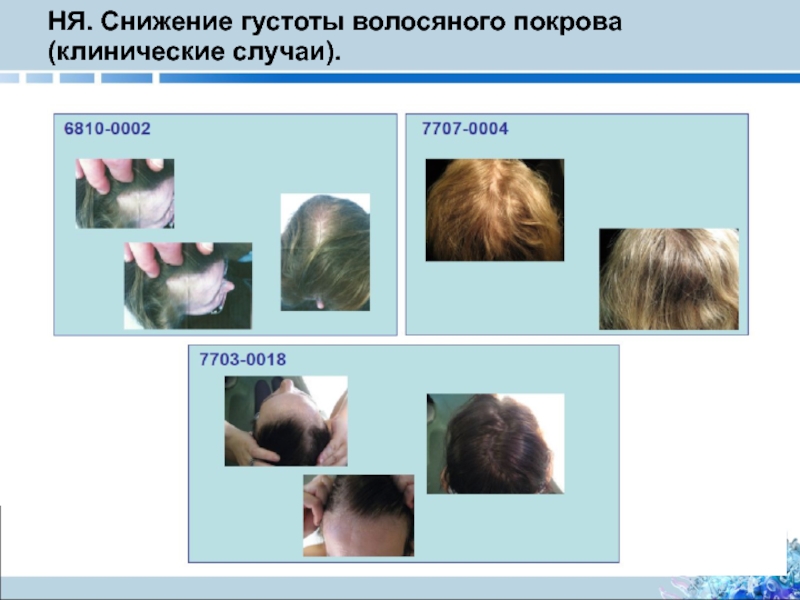
- 30. НЯ. Снижение густоты волосяного покрова (клинические случаи).
- 31. Диарея редко являлась причиной отмены препарата 1
- 32. Артериальное давление - среднее изменение со временем
- 33. Инфекции Два случая серьезных оппортунистических инфекций
- 34. Ретроспективный анализ базы данных клинических исследований терифлуномида:
- 35. Беременность В случае беременности или планирования беременности
- 36. Абаджио может назначаться женщинам с сохранной детородной
- 37. План обследований до начала и на фоне
- 38. Заключение: клинический опыт применения терифлуномида
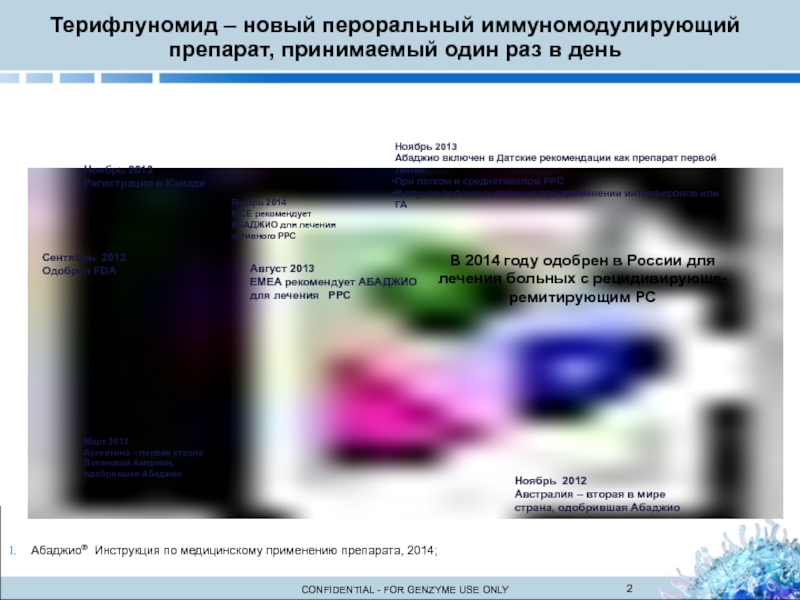
Слайд 2Ноябрь 2013
Регистрация в Канаде
Сентябрь 2012
Одобрен FDA
Январь 2014
NICE рекомендует
АБАДЖИО для
активного РРС
Август 2013
EMEA рекомендует АБАДЖИО для лечения РРС
Март 2013
Аргентина – первая страна Латинской Америки, одобрившая Абаджио
Ноябрь 2013
Абаджио включен в Датские рекомендации как препарат первой линии:
При легком и среднетяжелом РРС
В случае побочных явлений при применении интерферонов или ГА
Ноябрь 2012
Австралия – вторая в мире страна, одобрившая Абаджио
В 2014 году одобрен в России для лечения больных с рецидивирующе-ремитирующим РС
Aбаджио® Инструкция по медицинскому применению препарата, 2014;
Терифлуномид – новый пероральный иммуномодулирующий препарат, принимаемый один раз в день
Слайд 3Абаджио: показание и дозировка
Абаджио показан для лечения взрослых пациентов с
Рекомендованная доза: 14 мг один раз в день перорально
Фармакокинетика препарата не зависит от приема пищи
1. Aбаджио® Инструкция по медицинскому применению препарата 2014
14 мг таблетка
Слайд 4Абаджио (терифлуномид)
Aбаджио® Инструкция по медицинскому применению препарата, 2014;
Терифлуномид – новый пероральный
Одобрен FDA в сентябре 2012 для лечения пациентов с рецидивирующими формами РС
В 2013 одобрен EMEA для лечения больных с рецидивирующе-ремитирующим РС
В 2014 году одобрен в России для лечения больных с рецидивирующе-ремитирующим РС под торговым названием Абаджио®
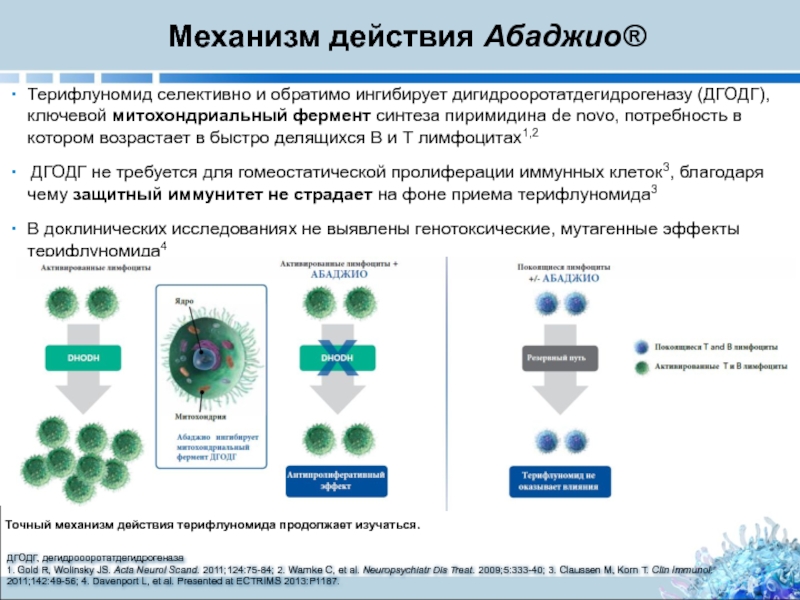
Слайд 5Точный механизм действия терифлуномида продолжает изучаться.
ДГОДГ, дегидроооротатдегидрогеназа
1. Gold R, Wolinsky JS.
Терифлуномид селективно и обратимо ингибирует дигидрооротатдегидрогеназу (ДГОДГ), ключевой митохондриальный фермент синтеза пиримидина de novo, потребность в котором возрастает в быстро делящихся В и Т лимфоцитах1,2
ДГОДГ не требуется для гомеостатической пролиферации иммунных клеток3, благодаря чему защитный иммунитет не страдает на фоне приема терифлуномида3
В доклинических исследованиях не выявлены генотоксические, мутагенные эффекты терифлуномида4
Механизм действия Абаджио®
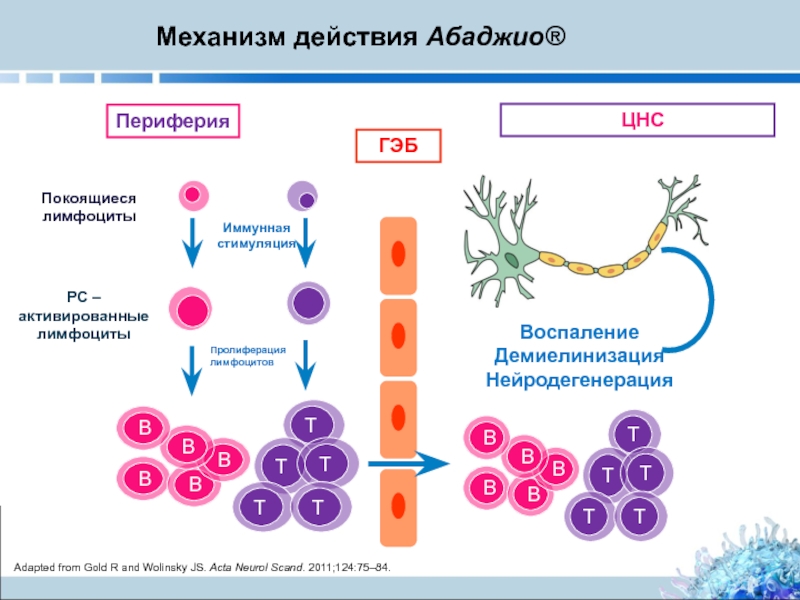
Слайд 6Механизм действия Абаджио®
Adapted from Gold R and Wolinsky JS. Acta Neurol
ГЭБ
ЦНС
Периферия
Воспаление
Демиелинизация
Нейродегенерация
B
РС – активированные лимфоциты
Пролиферация лимфоцитов
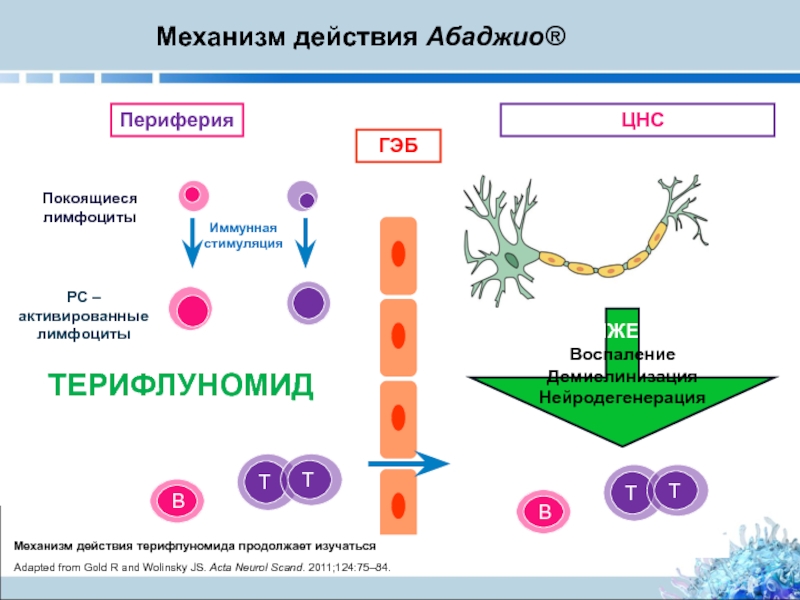
Слайд 7ГЭБ
ЦНС
Периферия
B
РС – активированные лимфоциты
ТЕРИФЛУНОМИД
СНИЖЕНИЕ
Воспаление
Демиелинизация
Нейродегенерация
Механизм действия терифлуномида продолжает изучаться
Механизм действия Абаджио®
Adapted
Слайд 8Одна из самых обширных программ клинических исследований при РС
>2700 пациентов в
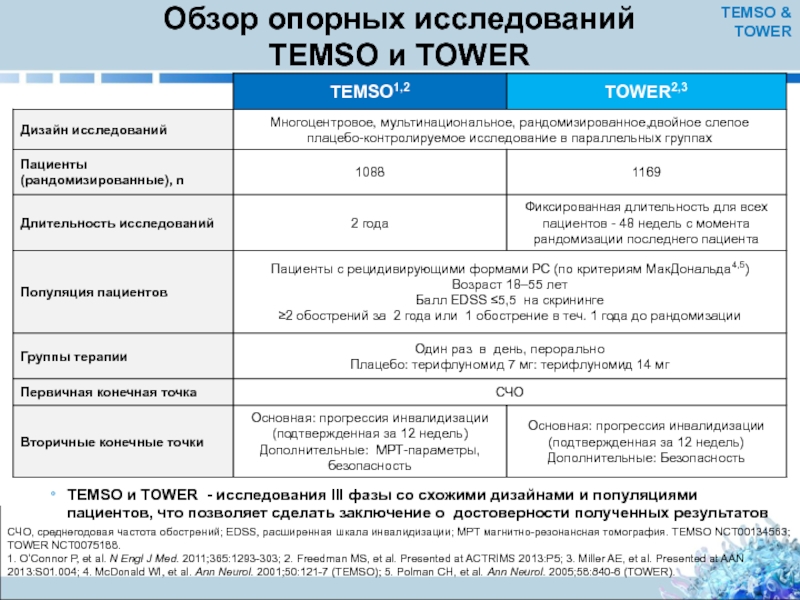
Слайд 9Обзор опорных исследований
TEMSO и TOWER - исследования III фазы со схожими дизайнами и популяциями пациентов, что позволяет сделать заключение о достоверности полученных результатов
СЧО, среднегодовая частота обострений; EDSS, расширенная шкала инвалидизации; MРТ магнитно-резонансная томография. TEMSO NCT00134563; TOWER NCT0075188.
1. O’Connor P, et al. N Engl J Med. 2011;365:1293-303; 2. Freedman MS, et al. Presented at ACTRIMS 2013:P5; 3. Miller AE, et al. Presented at AAN 2013:S01.004; 4. McDonald WI, et al. Ann Neurol. 2001;50:121-7 (TEMSO); 5. Polman CH, et al. Ann Neurol. 2005;58:840-6 (TOWER).
TEMSO & TOWER
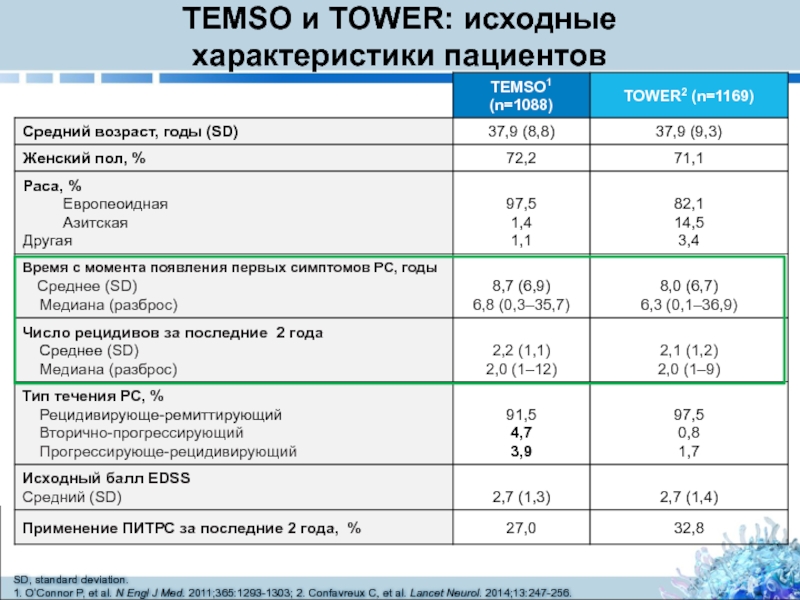
Слайд 10TEMSO и TOWER: исходные
SD, standard deviation.
1. O’Connor P, et al. N Engl J Med. 2011;365:1293-1303; 2. Confavreux C, et al. Lancet Neurol. 2014;13:247-256.
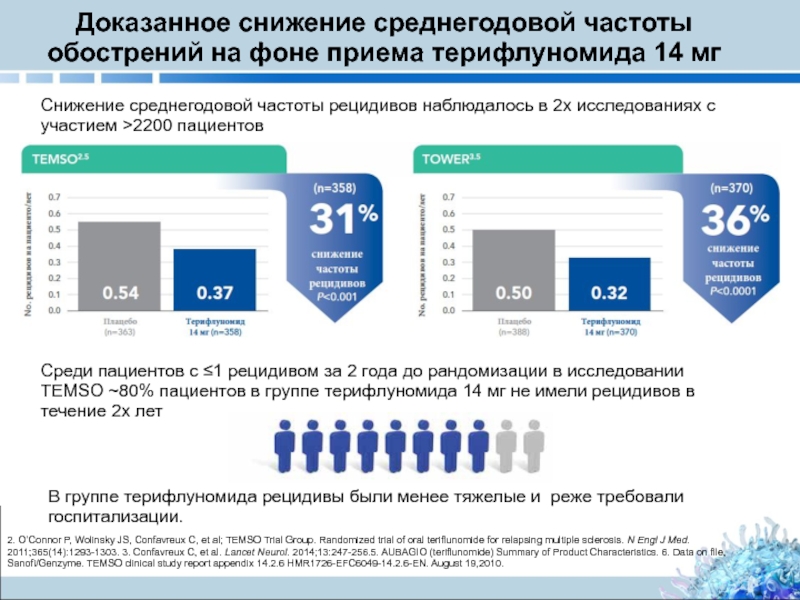
Слайд 11Доказанное снижение среднегодовой частоты обострений на фоне приема терифлуномида 14 мг
Среди
2. O’Connor P, Wolinsky JS, Confavreux C, et al; TEMSO Trial Group. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med. 2011;365(14):1293-1303. 3. Confavreux C, et al. Lancet Neurol. 2014;13:247-256.5. AUBAGIO (teriflunomide) Summary of Product Characteristics. 6. Data on file, Sanofi/Genzyme. TEMSO clinical study report appendix 14.2.6 HMR1726-EFC6049-14.2.6-EN. August 19,2010.
Снижение среднегодовой частоты рецидивов наблюдалось в 2х исследованиях с участием >2200 пациентов
В группе терифлуномида рецидивы были менее тяжелые и реже требовали госпитализации.
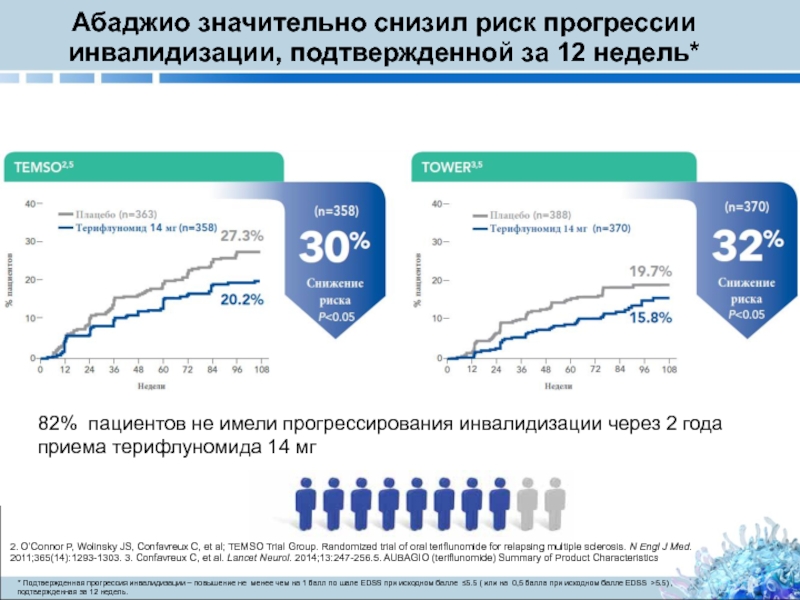
Слайд 12Абаджио значительно снизил риск прогрессии инвалидизации, подтвержденной за 12 недель*
2. O’Connor
* Подтвержденная прогрессия инвалидизации – повышение не менее чем на 1 балл по шале EDSS при исходном балле ≤5.5 ( или на 0,5 балла при исходном балле EDSS >5.5) , подтвержденная за 12 недель.
82% пациентов не имели прогрессирования инвалидизации через 2 года приема терифлуномида 14 мг
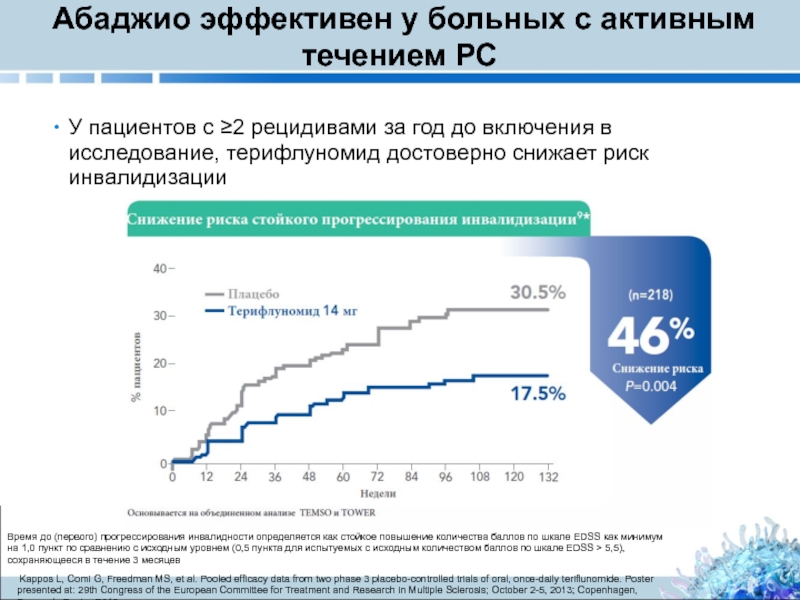
Слайд 13Абаджио эффективен у больных с активным течением РС
У пациентов c ≥2
Время до (первого) прогрессирования инвалидности определяется как стойкое повышение количества баллов по шкале EDSS как минимум на 1,0 пункт по сравнению с исходным уровнем (0,5 пункта для испытуемых с исходным количеством баллов по шкале EDSS > 5,5), сохраняющееся в течение 3 месяцев
Kappos L, Comi G, Freedman MS, et al. Pooled efficacy data from two phase 3 placebo-controlled trials of oral, once-daily teriflunomide. Poster presented at: 29th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; October 2-5, 2013; Copenhagen, Denmark. Poster P618.
Слайд 14Абаджио снижает активность РС по МРТ параметрам. Исследование TEMSO
* Уникальные активные
O’Connor P, et al; TEMSO Trial Group. N Eng J Med. 2011;365:1293-1303 [supplementary appendix].
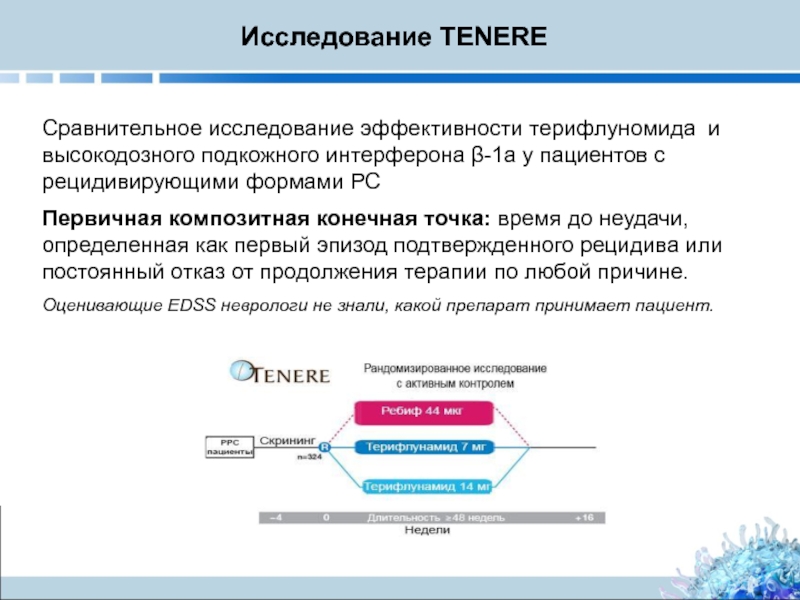
Слайд 15Сравнительное исследование эффективности терифлуномида и высокодозного подкожного интерферона β-1a у пациентов
Первичная композитная конечная точка: время до неудачи, определенная как первый эпизод подтвержденного рецидива или постоянный отказ от продолжения терапии по любой причине.
Оценивающие EDSS неврологи не знали, какой препарат принимает пациент.
Исследование TENERE
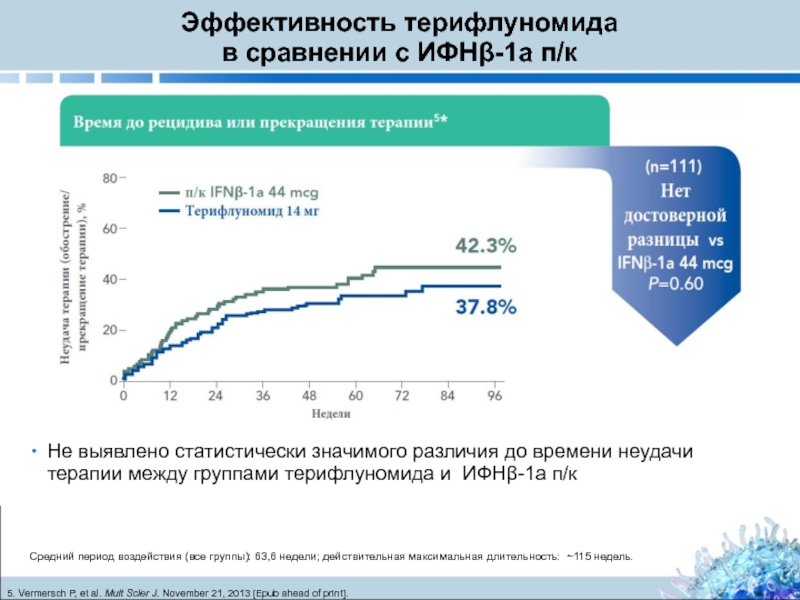
Слайд 16Эффективность терифлуномида
Средний период воздействия (все группы): 63,6 недели; действительная максимальная длительность: ~115 недель.
5. Vermersch P, et al. Mult Scler J. November 21, 2013 [Epub ahead of print].
Не выявлено статистически значимого различия до времени неудачи терапии между группами терифлуномида и ИФНβ-1a п/к
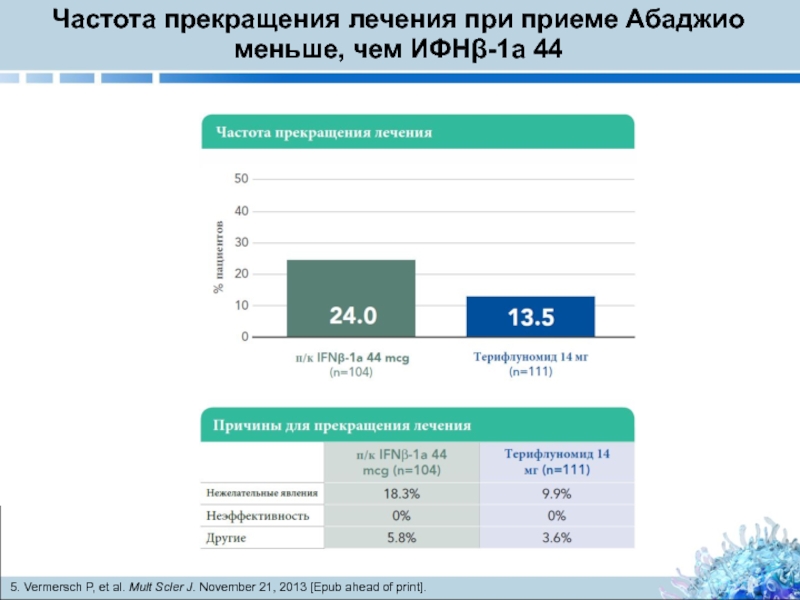
Слайд 17Частота прекращения лечения при приеме Абаджио меньше, чем ИФНβ-1a 44
5.
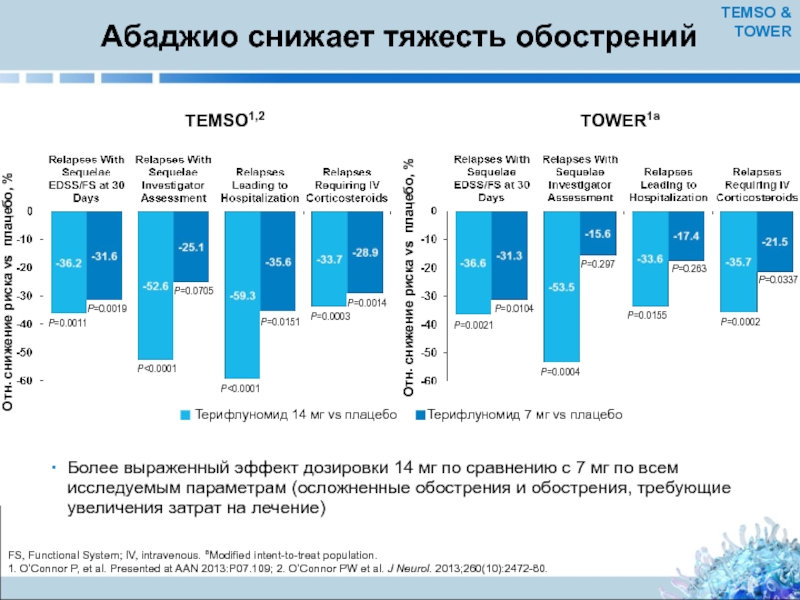
Слайд 19Абаджио снижает тяжесть обострений
Более выраженный эффект дозировки 14 мг по сравнению
FS, Functional System; IV, intravenous. aModified intent-to-treat population.
1. O’Connor P, et al. Presented at AAN 2013:P07.109; 2. O’Connor PW et al. J Neurol. 2013;260(10):2472-80.
TEMSO & TOWER
Отн. снижение риска vs плацебо, %
TEMSO1,2
P=0.0011
P<0.0001
P=0.0003
P<0.0001
P=0.0019
P=0.0705
P=0.0014
P=0.0151
P=0.0021
P=0.0004
P=0.0155
P=0.0002
P=0.0104
P=0.297
P=0.0337
P=0.263
Teрифлуномид 14 мг vs плацебо
Teрифлуномид 7 мг vs плацебо
TOWER1a
Отн. снижение риска vs плацебо, %
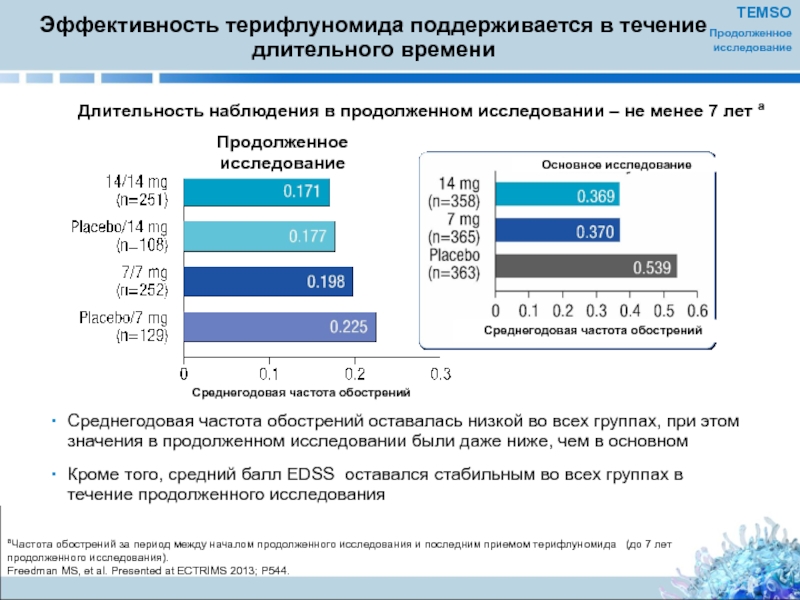
Слайд 21Эффективность терифлуномида поддерживается в течение длительного времени
TEMSO
Продолженное
исследование
аЧастота обострений за период
Freedman MS, et al. Presented at ECTRIMS 2013; P544.
Длительность наблюдения в продолженном исследовании – не менее 7 лет a
Среднегодовая частота обострений оставалась низкой во всех группах, при этом значения в продолженном исследовании были даже ниже, чем в основном
Кроме того, средний балл EDSS оставался стабильным во всех группах в течение продолженного исследования
Продолженное исследование
Основное исследование
Среднегодовая частота обострений
Среднегодовая частота обострений
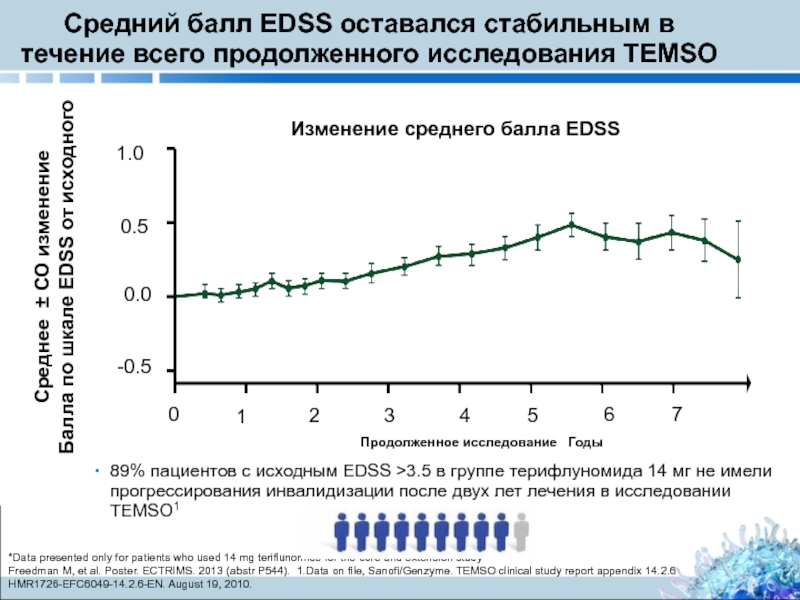
Слайд 22Средний балл EDSS оставался стабильным в течение всего продолженного исследования TEMSO
1.0
0.5
7
6
5
4
3
2
0
1
0.0
-0.5
Среднее
Балла по шкале EDSS от исходного
Продолженное исследование Годы
Изменение среднего балла EDSS
*Data presented only for patients who used 14 mg teriflunomide for the core and extension study
Freedman M, et al. Poster. ECTRIMS. 2013 (abstr P544). 1.Data on file, Sanofi/Genzyme. TEMSO clinical study report appendix 14.2.6 HMR1726-EFC6049-14.2.6-EN. August 19, 2010.
89% пациентов с исходным EDSS >3.5 в группе терифлуномида 14 мг не имели прогрессирования инвалидизации после двух лет лечения в исследовании TEMSO1
Слайд 23Обзор данных по безопасности Абаджио
Частота серьезных инфекций была низкой и сравнима
Длительный прием терифлуномида в продолженных исследованиях не повышал риск серьезных инфекций2*
Не было выявлено повышения частоты новообразований1,2
Это подтверждает, что терифлуномид обладает иммуномодулирующим, а не иммуносупрессивным эффектом
1. Leist T, et al. Poster. ECTRIMS. 2013 (abstr P633). 2. Confavreux C, et al. Mult Scler. 2012;18:278-289. 3. Kappos L, Comi G, Confavreux C, et al. The efficacy and safety of teriflunomide in patients with relapsing MS: results from TOWER, a phase III placebo-controlled study. Presented at: 28th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; October 10-13, 2012; Lyon, France. Oral presentation O153. 13. Data on file, Sanofi/Genzyme. TEMSO clinical study report HMR1726-EFC6049-teriflunomide. January 12, 2011. 14. Data on file, Sanofi/Genzyme. TOWER clinical study report HMR1726-EFC10531-teriflunomide. July 31, 2012.
ВГН – верхняя граница нормы
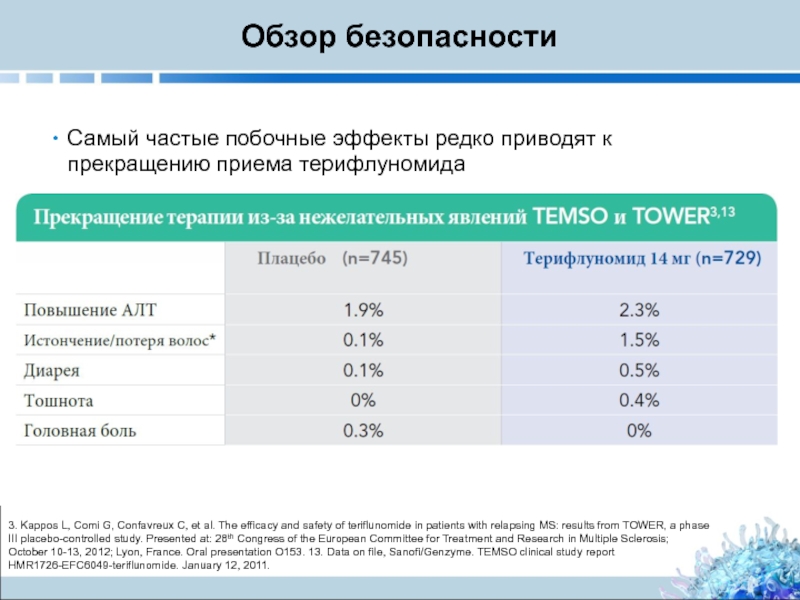
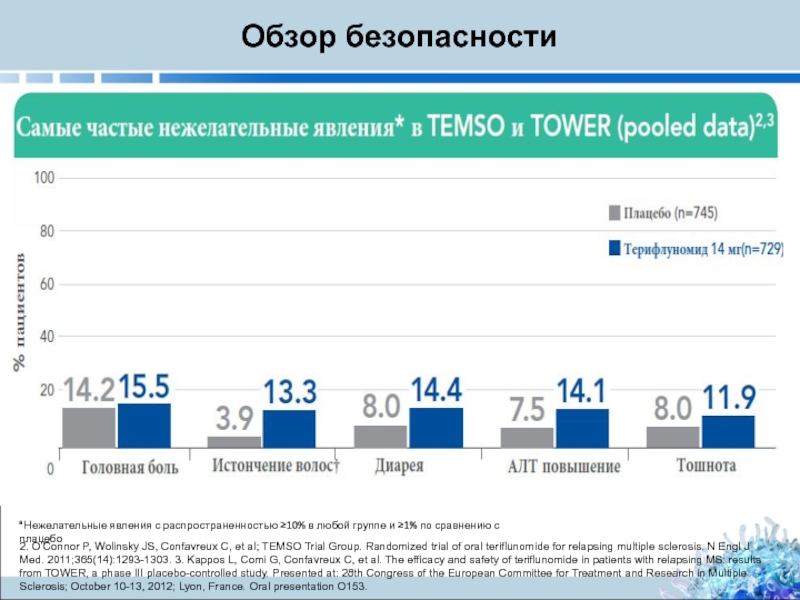
Слайд 24Обзор безопасности
Самый частые побочные эффекты редко приводят к прекращению приема терифлуномида
3.
Слайд 25Обзор безопасности
a Нежелательные явления с распространенностью ≥10% в любой группе и
2. O’Connor P, Wolinsky JS, Confavreux C, et al; TEMSO Trial Group. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med. 2011;365(14):1293-1303. 3. Kappos L, Comi G, Confavreux C, et al. The efficacy and safety of teriflunomide in patients with relapsing MS: results from TOWER, a phase III placebo-controlled study. Presented at: 28th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; October 10-13, 2012; Lyon, France. Oral presentation O153.
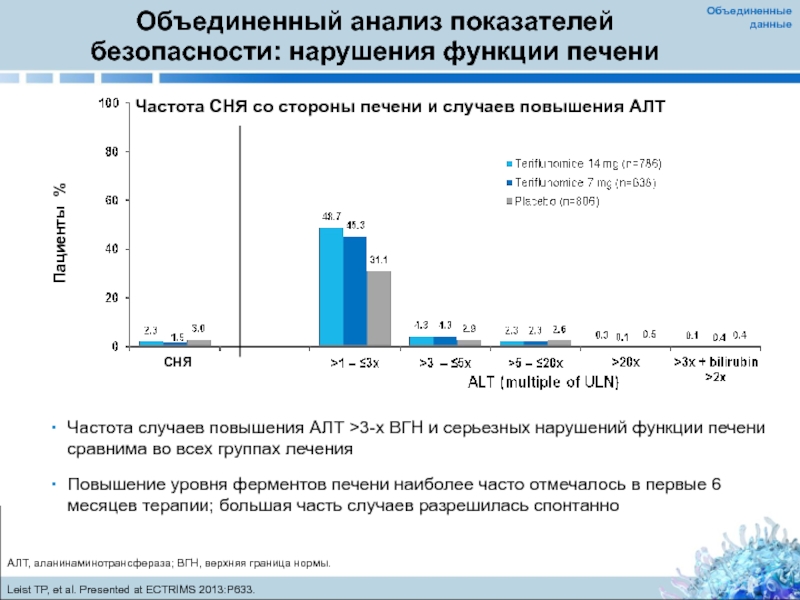
Слайд 26Объединенный анализ показателей безопасности: нарушения функции печени
Частота случаев повышения АЛТ >3-x
Повышение уровня ферментов печени наиболее часто отмечалось в первые 6 месяцев терапии; большая часть случаев разрешилась спонтанно
Частота СНЯ со стороны печени и случаев повышения АЛТ
CНЯ
Пациенты %
AЛT, аланинаминотрансфераза; ВГН, верхняя граница нормы.
Leist TP, et al. Presented at ECTRIMS 2013:P633.
Объединенные данные
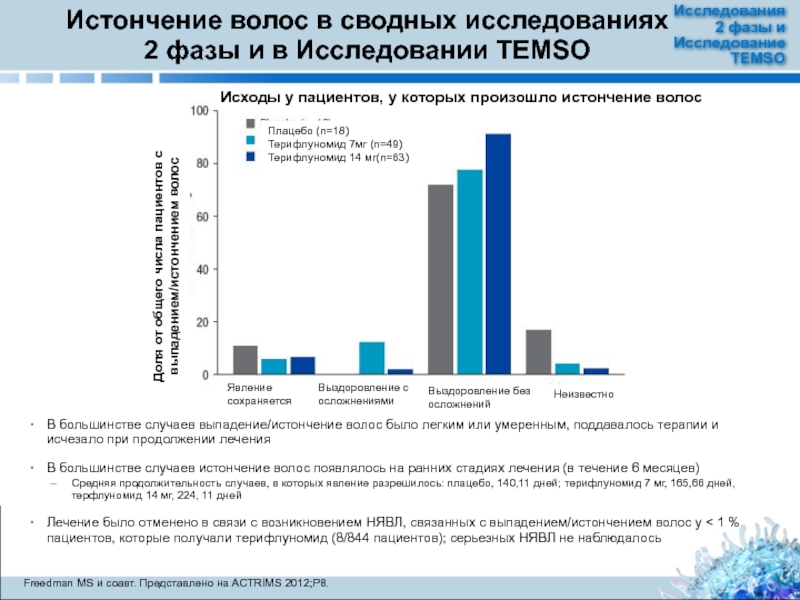
Слайд 27Истончение волос в сводных исследованиях 2 фазы и в Исследовании TEMSO
В большинстве
В большинстве случаев истончение волос появлялось на ранних стадиях лечения (в течение 6 месяцев)
Средняя продолжительность случаев, в которых явление разрешилось: плацебо, 140,11 дней; терифлуномид 7 мг, 165,66 дней, терфлуномид 14 мг, 224, 11 дней
Лечение было отменено в связи с возникновением НЯВЛ, связанных с выпадением/истончением волос у < 1 % пациентов, которые получали терифлуномид (8/844 пациентов); серьезных НЯВЛ не наблюдалось
Доля от общего числа пациентов с выпадением/истончением волос
Freedman MS и соавт. Представлено на ACTRIMS 2012;P8.
Исследования 2 фазы и Исследование TEMSO
Исходы у пациентов, у которых произошло истончение волос
Плацебо (n=18)
Терифлуномид 7мг (n=49)
Терифлуномид 14 мг(n=63)
Явление сохраняется
Выздоровление с осложнениями
Выздоровление без осложнений
Неизвестно
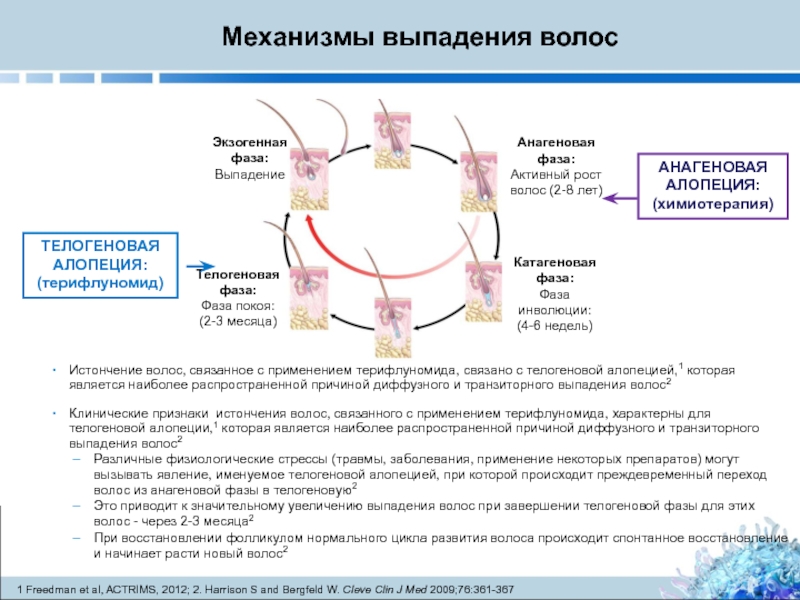
Слайд 28АНАГЕНОВАЯ АЛОПЕЦИЯ:
(химиотерапия)
Механизмы выпадения волос
Истончение волос, связанное с применением терифлуномида, связано с
Клинические признаки истончения волос, связанного с применением терифлуномида, характерны для телогеновой алопеции,1 которая является наиболее распространенной причиной диффузного и транзиторного выпадения волос2
Различные физиологические стрессы (травмы, заболевания, применение некоторых препаратов) могут вызывать явление, именуемое телогеновой алопецией, при которой происходит преждевременный переход волос из анагеновой фазы в телогеновую2
Это приводит к значительному увеличению выпадения волос при завершении телогеновой фазы для этих волос - через 2-3 месяца2
При восстановлении фолликулом нормального цикла развития волоса происходит спонтанное восстановление и начинает расти новый волос2
ТЕЛОГЕНОВАЯ АЛОПЕЦИЯ:
(терифлуномид)
1 Freedman et al, ACTRIMS, 2012; 2. Harrison S and Bergfeld W. Cleve Clin J Med 2009;76:361-367
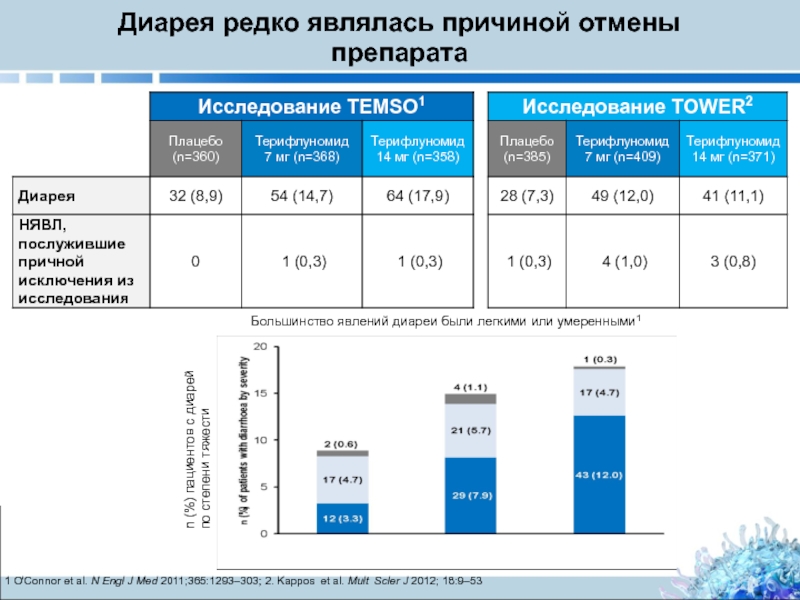
Слайд 31Диарея редко являлась причиной отмены препарата
1 O'Connor et al. N Engl
Большинство явлений диареи были легкими или умеренными1
n (%) пациентов с диарей по степени тяжести
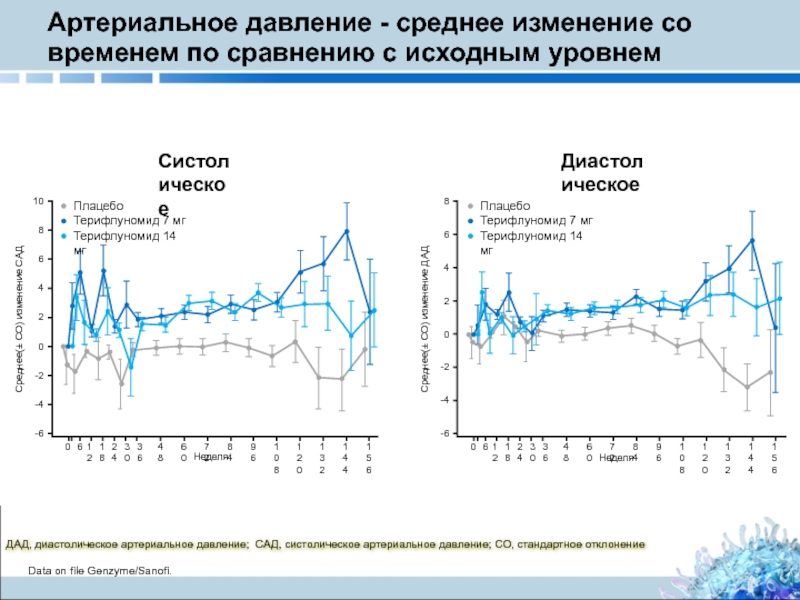
Слайд 32Артериальное давление - среднее изменение со временем по сравнению с исходным
ДАД, диастолическое артериальное давление; САД, систолическое артериальное давление; СО, стандартное отклонение
Data on file Genzyme/Sanofi.
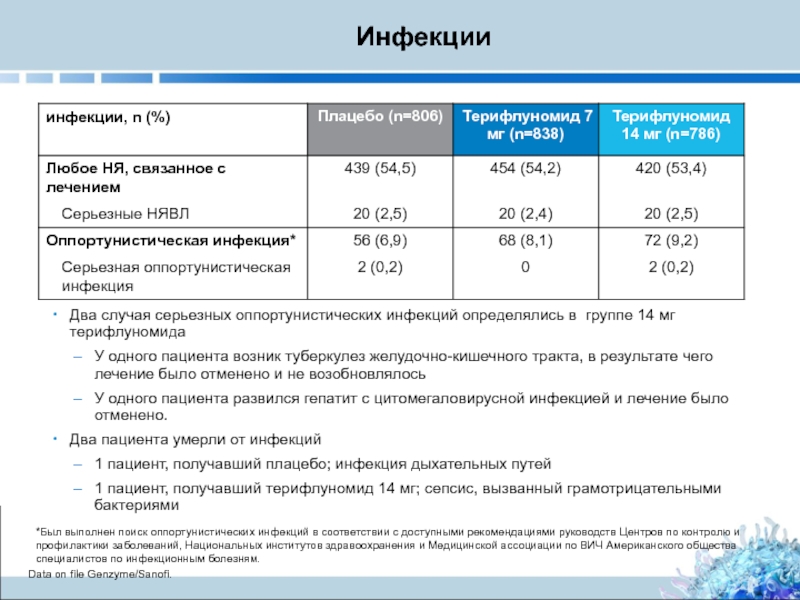
Слайд 33 Инфекции
Два случая серьезных оппортунистических инфекций определялись в группе 14 мг терифлуномида
У
У одного пациента развился гепатит с цитомегаловирусной инфекцией и лечение было отменено.
Два пациента умерли от инфекций
1 пациент, получавший плацебо; инфекция дыхательных путей
1 пациент, получавший терифлуномид 14 мг; сепсис, вызванный грамотрицательными бактериями
*Был выполнен поиск оппортунистических инфекций в соответствии с доступными рекомендациями руководств Центров по контролю и профилактики заболеваний, Национальных институтов здравоохранения и Медицинской ассоциации по ВИЧ Американского общества специалистов по инфекционным болезням.
Data on file Genzyme/Sanofi.
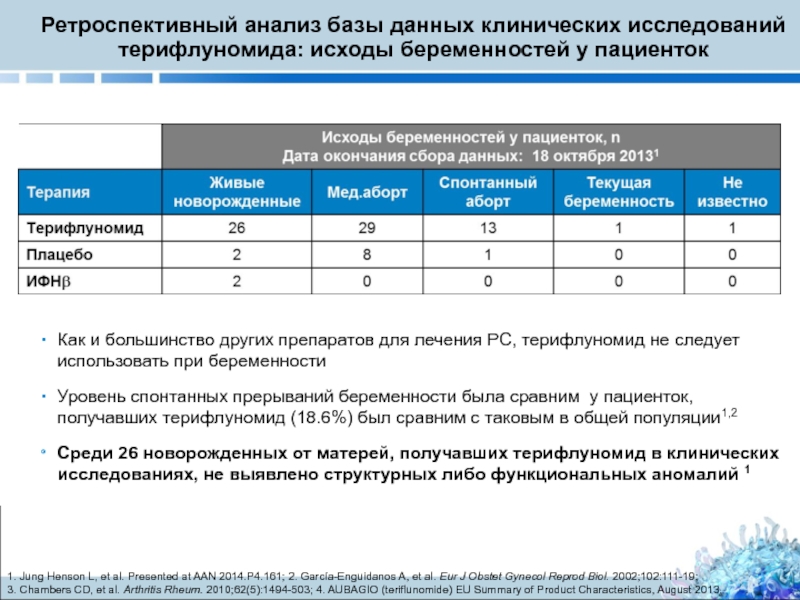
Слайд 34Ретроспективный анализ базы данных клинических исследований терифлуномида: исходы беременностей у пациенток
Как и большинство других препаратов для лечения РС, терифлуномид не следует использовать при беременности
Уровень спонтанных прерываний беременности была сравним у пациенток, получавших терифлуномид (18.6%) был сравним с таковым в общей популяции1,2
Среди 26 новорожденных от матерей, получавших терифлуномид в клинических исследованиях, не выявлено структурных либо функциональных аномалий 1
1. Jung Henson L, et al. Presented at AAN 2014.P4.161; 2. García-Enguidanos A, et al. Eur J Obstet Gynecol Reprod Biol. 2002;102:111-19;
3. Chambers CD, et al. Arthritis Rheum. 2010;62(5):1494-503; 4. AUBAGIO (teriflunomide) EU Summary of Product Characteristics, August 2013.
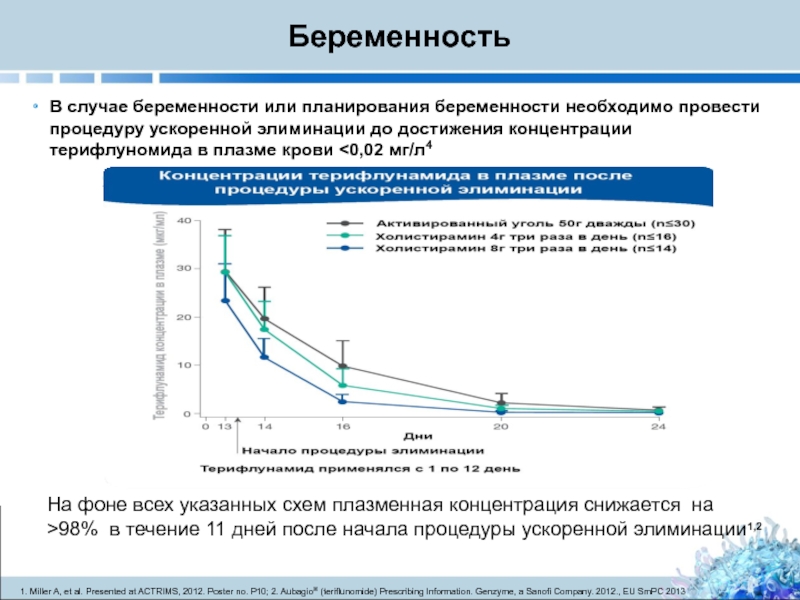
Слайд 35Беременность
В случае беременности или планирования беременности необходимо провести процедуру ускоренной элиминации
1. Miller A, et al. Presented at ACTRIMS, 2012. Poster no. P10; 2. Aubagio® (teriflunomide) Prescribing Information. Genzyme, a Sanofi Company. 2012., EU SmPC 2013
На фоне всех указанных схем плазменная концентрация снижается на >98% в течение 11 дней после начала процедуры ускоренной элиминации1,2
Слайд 36Абаджио может назначаться женщинам с сохранной детородной функцией, при условии использования
Как и большинство препаратов для лечения рассеянного склероза, Абаджио не следует применять у беременных или кормящих женщин.1
Женщина, желающая забеременеть, должна прекратить прием Абаджио. Рекомендована процедура ускоренной элиминации для быстрого достижения плазменной концентрации < 0,02 мг/л.1
Ссылки: 1. Абаджио. Инструкция по медицинскому применению.2014
Возможность назначения Абаджио женщинам с сохранной детородной функцией
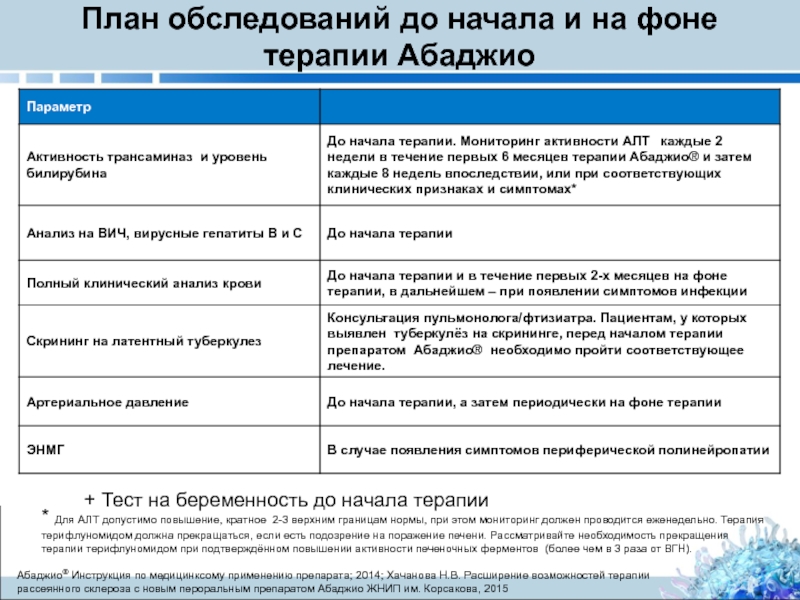
Слайд 37План обследований до начала и на фоне терапии Абаджио
Aбаджио® Инструкция по медицинксому применению препарата; 2014; Хачанова Н.В. Расширение возможностей терапии рассеянного склероза c новым пероральным препаратом Абаджио ЖНИП им. Корсакова, 2015
* Для AЛT допустимо повышение, кратное 2-3 верхним границам нормы, при этом мониторинг должен проводится еженедельно. Терапия терифлуномидом должна прекращаться, если есть подозрение на поражение печени. Рассматривайте необходимость прекращения терапии терифлуномидом при подтверждённом повышении активности печеночных ферментов (более чем в 3 раза от ВГН).
Слайд 38Заключение:
клинический опыт применения терифлуномида
Подтвержденная клиническая и МРТ-эффективность терифлуномида в
Единственный пероральный ПИТРС, доказавший способность замедлять прогрессию инвалидизации в 2 клинических плацебо-контролируемых исследованиях III фазы (TOWER и TEMSO)
Доказана эффективность терифлуномида у пациентов с рецидивирующими формами РС поддерживается в течение длительного времени
Доказано снижение тяжести обострений на фоне терапии терифлуномидом
Преимущества терифлуномида с точки зрения пациентов
Эффективность сопоставима с другими ПИТРС первой линии. Удовлетворенность приемом перорального препарата один раз в день и приверженность к терапии выше.
Хорошо изученный профиль безопасности в обширной программе клинических исследований
Соотношение польза-риск доказывает целесообразность применения терифлуномида в качестве начальной терапии у пациентов с рецидивирующе-ремиттирующей формой РС