- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярные основы патологии углеводного и липидного обмена презентация
Содержание
- 1. Молекулярные основы патологии углеводного и липидного обмена
- 2. УГЛЕВОДЫ Углеводы входят в состав живых организмов
- 3. Углеводы участвуют во многих метаболических процессах,
- 4. Структурная роль углеводов
- 5. Из углеводов в процессе метаболизма образуется
- 6. УГЛЕВОДЫ - это альдегиды
- 7. В организме наиболее распространены пентозы (они
- 8. В связи с этим высказываемые предположения
- 10. Эпителиальные клетки кишечника способны всасывать только
- 11. Потребление глюкозы клетками из кровотока происходит
- 12. В отсутствии инсулина плазматическая мембрана этих
- 13. ГЛЮТ 1 Мозг, плацента, почки,
- 14. ГЛЮТ 4 (инсулинзависимый).
- 15. Все типы переносчиков могут находиться как
- 16. После чего возможен облегченный транспорт глюкозы
- 19. Инсулин – синтезируется в виде препрогормона,
- 20. Проинсулин, не обладающий биологической активностью,
- 21. С-пептид Фрагмент молекулы проинсулина Соотношение С-пептид/инсулин 5:1
- 22. Главные мишени инсулина – печень, скелетные
- 23. Инсулин стимулирует: Мембранный транспорт глюкозы в мышцах
- 24. Гликолиз – ферментативный процесс расщепления глюкозы
- 25. Рецептор инсулина При взаимодействии инсулина с рецептором
- 26. Чувствительность инсулиновых рецепторов увеличивают физическая нагрузка,
- 27. Референтные значения инсулина, С-пептида и проинсулина в
- 28. Главный физиологический стимул секреции инсулина
- 29. В клетках нервной ткани, эритроцитах,
- 30. Гликирование происходит и при нормальной концентрации
- 31. Неферментативное гликирование белков существенно отражается на
- 32. Контринсулярные гормоны Глюкагон – полипептид, состоящий из
- 33. Глюкокортикоиды вырабатываются корой надпочечников, усиливают катаболизм
- 34. Адреналин синтезируется в мозговом слое
- 35. Адренокортикотропный гормон синтезируется в базофильных
- 36. Уровень глюкозы в крови – лабильный
- 37. Диагноз СД правомерен, если содержание глюкозы
- 38. Гипогликемия Глюкоза является жизненно важным энергетическим сырьем
- 39. Гипогликемия – это лабораторный диагноз, который
- 40. Клинические симптомы гипогликемии делятся на две
- 41. Симптомы, развивающиеся вследствие нарушений функций ЦНС,
- 42. Причины гипогликемии Сниженный выход глюкозы
- 43. Эндокринные заболевания
- 44. Сниженный выход и увеличенная утилизация глюкозы
- 45. Сниженный выход глюкозы Заболевания печени.
- 46. Употребление алкоголя. Алкоголь ингибирует глюконеогенез и симптомы гипогликемии, возникающие после употребления алкоголя.
- 47. Наследственные метаболические нарушения. Запасы гликогена в
- 48. Высвобождение глюкозы в постабсорбтивный период нарушается
- 49. Эндокринные заболевания Дефицит контринсулярных гормонов – нечастая
- 50. Увеличенная утилизация
- 51. Нарушение окисления жирных кислот.
- 52. Изолированные или множественные дефицитные состояния по
- 53. Сниженный выход и увеличенная
- 54. Гиперинсулинемия может быть следствием неадекватной эндогенной
- 55. Непанкреатические опухоли – большие
- 56. Постгастроэктомия Гипогликемия,
- 57. Болезни накопления гликогена (гликогенозы)
- 58. Гликогеноз 1 типа (болезнь фон Гирке)
- 59. Галактоземия. Нарушение метаболизма галактозы может быть
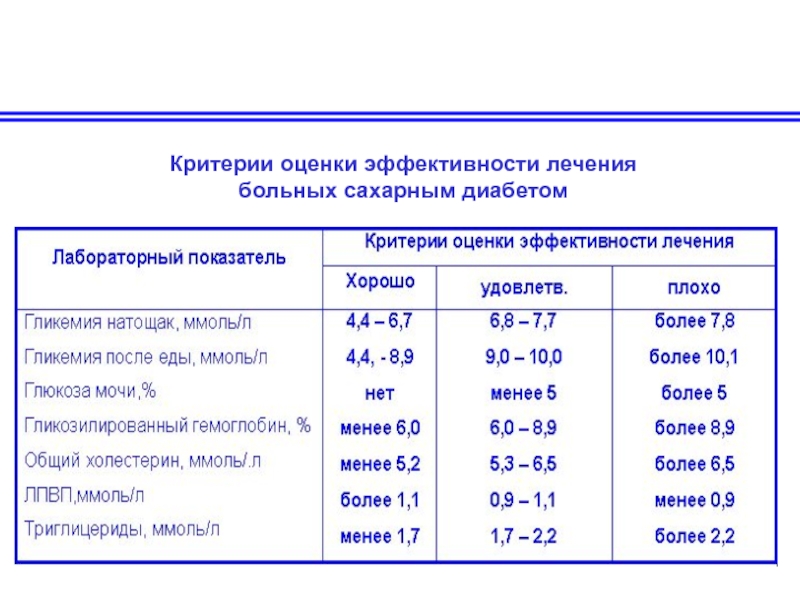
- 60. Симптомы болезней накопления гликогена
- 61. Катаракта вызывается превращением альдозоредуктазой в хрусталиках
- 62. Наследственная непереносимость фруктозы Связана с
- 63. Эссенциальная фруктозурия
- 64. САХАРНЫЙ ДИАБЕТ - это
- 65. При ИЗСД секреция инсулина отсутствует
- 66. Заболевание развивается при воздействии различных
- 67. Инсулиннезависимый сахарный диабет - это гетерогенная группа
- 68. Секреция инсулина при ИНЗСД сохранена, хотя
- 69. Ежегодная заболеваемость СД составляет 4-5 %
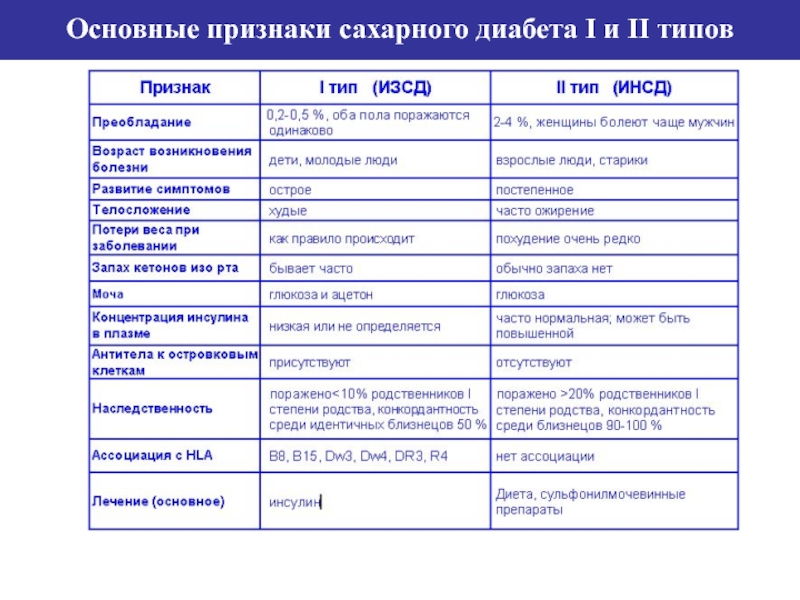
- 70. Основные признаки сахарного диабета I и II типов
- 71. ВТОРИЧНЫЙ ДИАБЕТ - развивается на фоне ряда
- 72. САХАРНЫЙ ДИАБЕТ БЕРЕМЕННЫХ называют гестационным
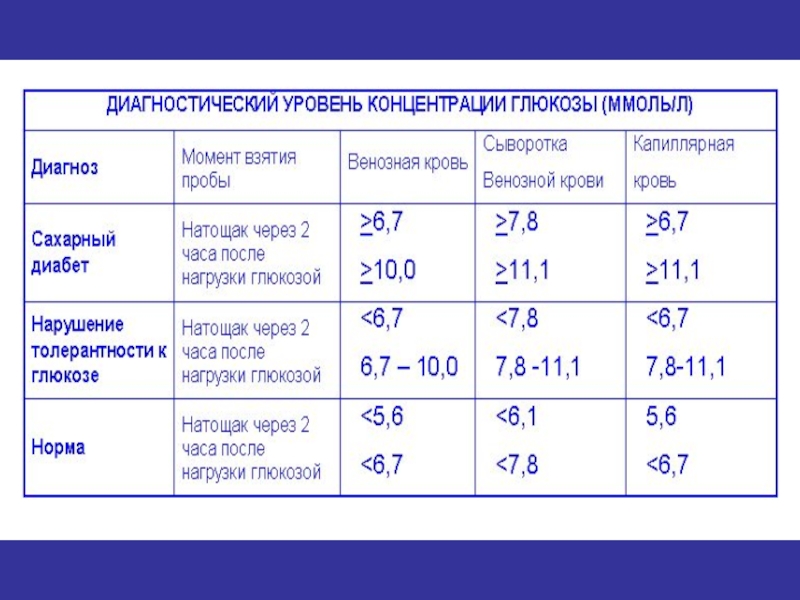
- 73. В диагностике сахарного диабета важную роль
- 74. Уровень глюкозы в крови
- 75. Гипогликемию вызывают следующие причины: длительное голодание
- 76. Иногда гипогликемические состояния наблюдаются у лиц
- 78. При содержании глюкозы от 5,6 до 6,7
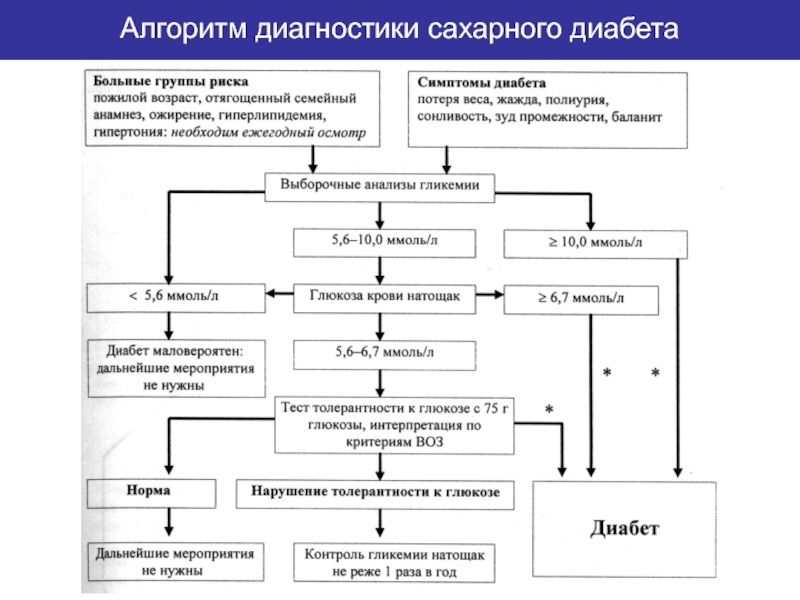
- 80. Алгоритм диагностики сахарного диабета
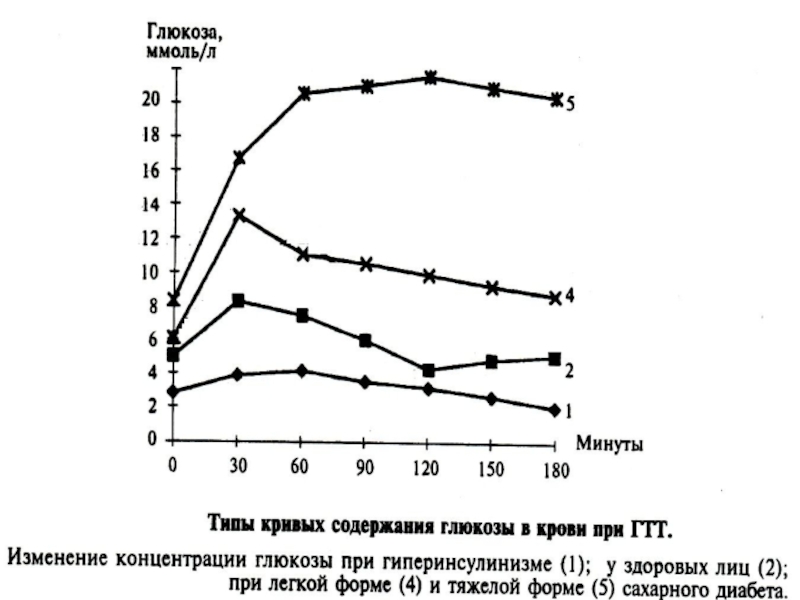
- 81. Гликемический профиль – результат 6- или
- 82. Сахарный диабет 1 типа ( инсулинзависимый )
- 83. Для оценки результатов ГТТ вычисляют два показателя:
- 84. Глюкоза мочи Почечный порог глюкозы
- 85. Определение антител против островковых клеток и
- 86. Глюкагон Содержание глюкагона в плазме у
- 87. Гликирование происходит и при
- 88. Неферментативное гликирование белков существенно отражается
- 89. В крови могут гликироваться некоторые компоненты
- 90. Значительное увеличение концентрации глюкагона в крови является
- 98. Гликированный гемоглобин в крови Содержание
- 99. Ложные сниженные значения
- 100. Фруктозамин в сыворотке
- 101. Определение фруктозамина имеет преимущество перед определением
- 102. Молочная кислота (лактат) в крови
- 103. Микроальбуминурия
- 104. Прогнозирование сахарного диабета определение антител
- 105. Критерии оценки эффективности лечения больных сахарным диабетом
Слайд 1
Нижегородская государственная медицинская академия
Кафедра клинической лабораторной диагностики
Зав.кафедрой, профессор,
КОНТОРЩИКОВА Клавдия Николаевна
Молекулярные основы
Слайд 2УГЛЕВОДЫ
Углеводы входят в состав
живых организмов и вместе
с белками, липидами и
нуклеиновыми кислотами
определяют специфичность
их строения и функционирования.
К углеводам относят соединения,
обладающие разнообразными и зачастую сильно отличающимися по функционированию свойствами
Слайд 3
Углеводы участвуют во многих метаболических процессах, но прежде всего они являются
На долю углеводов приходится примерно 75% массы пищевого суточного рациона и более 50% от суточного количества калорий.
Слайд 4
Структурная роль углеводов
Гликозамингликаны входят в состав межклеточного
Гликопротеины. Углеводная составляющая повышает специфичность белков.
Олигосахаридные фрагменты клеточной оболочки эритроцитов обеспечивают групповую принадлежность крови.
Слайд 5
Из углеводов в процессе метаболизма образуется большое число органических соединений, которые
Производные углеводов – глюкурониды – участвуют в детоксикации ксенобиотиков и инактивации веществ эндогенного происхождения.
Слайд 6УГЛЕВОДЫ
- это альдегиды и кетоны многоатомных спиртов
Моносахариды соединяются посредством гликозидной связи, образуя дисахариды, олигосахариды (до 6 моносахаридных остатков) и полисахариды (гликоген и крахмал).
Углеводы образуют соединения с белком (гликопротеины и протеогликаны), липидами (гликолипиды) и другими веществами (гетеромоносахариды).
Слайд 7
В организме наиболее распространены пентозы (они входят в состав нуклеиновых кислот
Глюкоза по структуре бывает в открытой и циклической форме. В циклической форме углеводы устойчивы и малоактивны, в открытой форме углеводы обладают высокой реакционной способностью и могут взаимодействовать без участия ферментов с белками, нуклеотидами и липидами; эти реакции называются реакциями гликирования.
Концентрация в сыворотке крови глюкозы самая высокая среди других углеводов, поэтому именно глюкоза вносит основной вклад в процесс гликирования внеклеточных белков.
Слайд 8
В связи с этим высказываемые предположения о замене пищевой глюкозы на
У фруктозы и галактозы больший процент молекул находится в открытой форме, они активнее, чем глюкоза взаимодействуют неферментативно с белками
Слайд 10
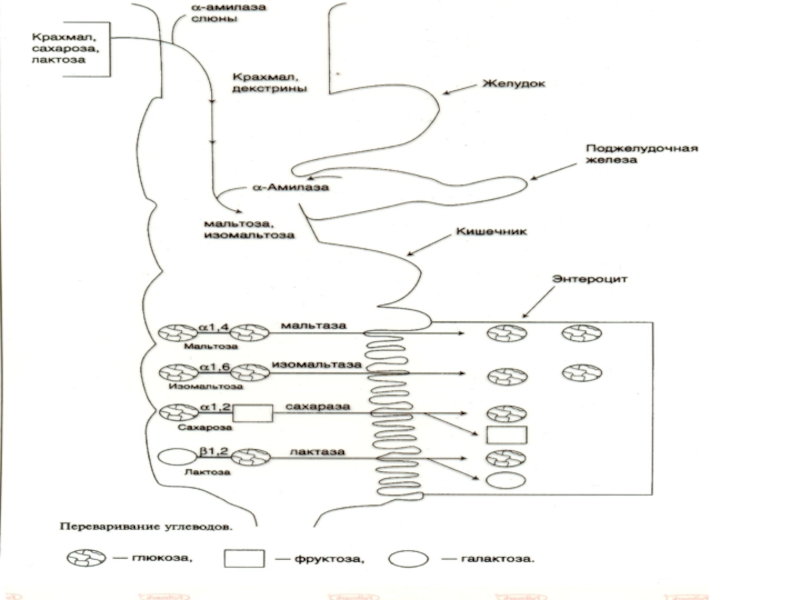
Эпителиальные клетки кишечника способны всасывать только моносахариды.
Процесс переваривания заключается в
Слайд 11
Потребление глюкозы клетками из кровотока происходит также путем облегченной диффузии.
Скорость трансмембранного
Исключение составляют клетки мышц и жировой ткани, где облегченная диффузия регулируется инсулином.
Слайд 12
В отсутствии инсулина плазматическая мембрана этих клеток непроницаема для глюкозы, так
Транспортеры глюкозы называют также рецепторами глюкозы.
Считают, что способ облегченной диффузии по сравнению с активным транспортом предотвращает транспорт ионов вместе с глюкозой, если она поступает по градиенту концентрации.
Слайд 13
ГЛЮТ 1 Мозг, плацента, почки, толстый
ГЛЮТ 2 Печень, почки, бета-клетки
островков Лангерганса,
эритроциты
ГЛЮТ 3 Во многих тканях, включая
мозг, плаценту, почки
Слайд 14
ГЛЮТ 4 (инсулинзависимый).
сердечной, жировой ткани.
Содержится в отсутствии
инсулина почти полностью в
цитоплазме
ГЛЮТ 5 В апикальном отделе
энтероцитов тонкого кишечника.
Является переносчиком
фруктозы.
Слайд 15
Все типы переносчиков могут находиться как в плазматической мембране, так и
ГЛЮТ 4 и в меньшей степени ГЛЮТ1 почти полностью находятся в цитоплазме клеток.
Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортеров в мембрану.
Слайд 16
После чего возможен облегченный транспорт глюкозы в эти клетки.
После снижения
Слайд 19
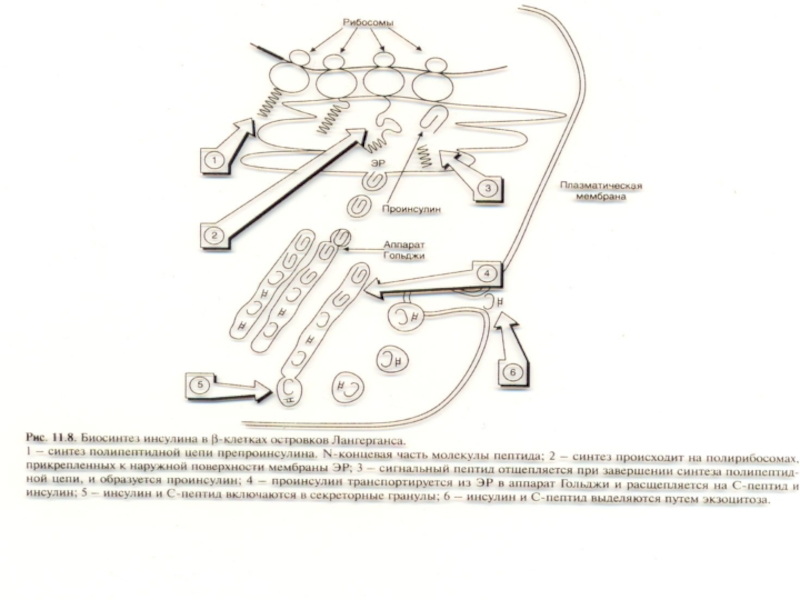
Инсулин – синтезируется в виде препрогормона, мол масса 11500 Да.
В
В аппарате Гольджи С-пептид вырезается, молекула инсулина приобретает вид димера, в котором A и В – цепи связаны дисульфидными мостиками, и вместе с С-пептидом упаковываются в секреторные везикулы.
Слайд 20
Проинсулин, не обладающий биологической активностью, в небольших количествах секретируется вместе с
При опухолях бета- клеток высвобождение проинсулина может заметно усиливаться.
Слайд 21С-пептид
Фрагмент молекулы проинсулина
Соотношение С-пептид/инсулин 5:1 - разное время полувыведения
Неактивен, более стабильный
Позволяет отличить эндогенный инсулин у больных на инсулинотерапии
Диагностика и эффективность оперативного лечения инсулиномы
Слайд 22
Главные мишени инсулина – печень, скелетные мышцы и жировые клетки.
Инсулин –
Это единственный гормон, снижающий концентрацию глюкозы в крови.
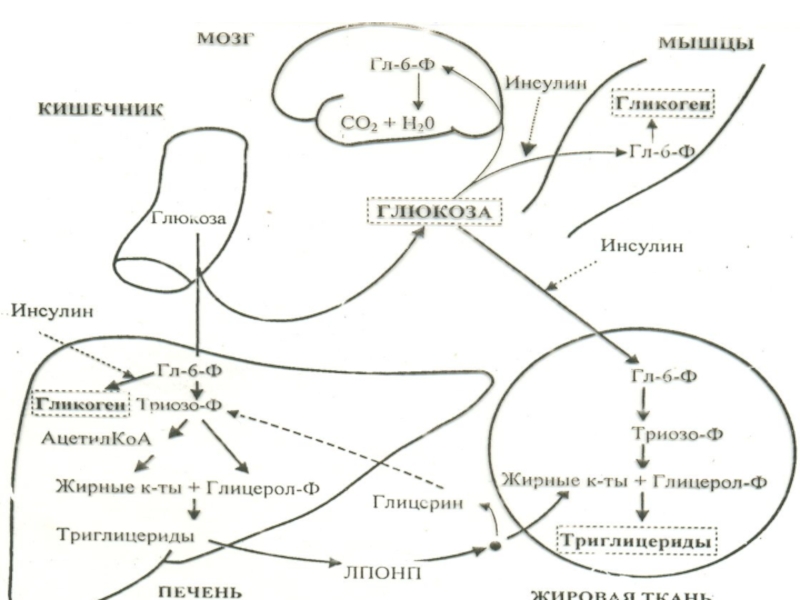
Слайд 23Инсулин стимулирует:
Мембранный транспорт глюкозы в мышцах и жировой ткани с помощью
В печени ферменты гексокиназу и глюкокиназу, что ускоряет проникновение глюкозы в клетку. Ферменты синтеза гликогена и триглицеридов.
Слайд 24
Гликолиз – ферментативный процесс расщепления глюкозы с образованием лактата и АТФ
Синтез АТФ, ДНК и РНК, что сопровождается ускоренной пролиферацией клеток.
Слайд 25Рецептор инсулина
При взаимодействии инсулина с рецептором в цитоплазматической мембране происходит активация
Слайд 26
Чувствительность инсулиновых рецепторов увеличивают физическая нагрузка, соблюдение диеты
Эффекты инсулина на рецепторы
Слайд 27Референтные значения инсулина, С-пептида и проинсулина в сыворотке
При 12-часовом воздержании от
Инсулин 6 -25 мЕд/л 36-150пмоль/л
С-пептид 0,7-2,0мкг/л 0,2-0,6пмоль/л
Проинсулин < 25нг/л <пмоль/л
Продолжительное голодание со снижением уровня глюкозы до < 3,3 ммоль/л:
Инсулин <6мЕд/л < 36 пмоль/л
С-пептид <0,7мкг/л < 0,2пмоль/л
Проинсулин <25нг/л <3 пмоль/л
Максимальное значение после стимуляции глюкозой или глюкагоном:
Инсулин > 200 мЕд/л > 1200 пмоль/л
С-пептид 2,7- 5,7 мкг/л 0,9- 1,9 пмоль/л
Проинсулин 77- 102нг/л 8,5 - 11,3 пмоль/л
Слайд 28
Главный физиологический стимул секреции инсулина – увеличение концентрации глюкозы в крови,
Помимо глюкозы секрецию инсулина активируют некоторые аминокислоты – аргинин и лейцин и агонисты бета-адренергических рецепторов.
Подавляют высвобождение инсулина соматостатин, альфа-адренергические агонисты и, конечно, снижение концентрации глюкозы в крови.
Слайд 29
В клетках нервной ткани, эритроцитах, хрусталике и в эндотелии сосудов скорость
Здесь глюкоза способна оказывать прямое токсическое действие на клетки. Это действие связано с так называемым ферментативным гликированием белков.
Слайд 30
Гликирование происходит и при нормальной концентрации глюкозы, однако скорость ее невысока
В условиях гипергликемии скорость этого процесса нарастает, и в клетках и во внеклеточном пространстве происходит накопление значительного количества неферментативно гликированных протеинов.
Слайд 31
Неферментативное гликирование белков существенно отражается на их функции. Так, гликирование структурных
Гликирование белков хрусталика глаза приводит к снижению его прозрачности и нарушениям зрения.
Гликирование белков миелиновой оболочки нервов приводит к нарушению проведения нервного импульса. Гликирование белков цитоскелета (спектрин, тубулины) ведет к нарушению аксонального транспорта в нейронах, снижению эластичности
Слайд 32Контринсулярные гормоны
Глюкагон – полипептид, состоящий из 29 аминокислот, секретируется альфа-клетками островков
Эффекты глюкагона противоположны действию инсулина.
Глюкагон стимулирует гликогенолиз в печени, глюконеогенез, способствует липолизу и кетогенезу.
Слайд 33
Глюкокортикоиды вырабатываются корой надпочечников, усиливают катаболизм белка и глюконеогенез, тормозят транспорт
Избыточной продукцией глюкокортикоида гидрокортизона характеризуется синдром Иценко – Кушинга, при котором глюкоза образуется из аминокислот и других субстратов.
Слайд 34
Адреналин синтезируется в мозговом слое надпочечников, он стимулирует в печени гликогенолиз,
Гиперпродукция адреналина наблюдается при феохромоцитоме, при этом в крови может быть транзиторная гипергликемия.
Слайд 35
Адренокортикотропный гормон синтезируется в базофильных клетках передней доли гипофиза. Является пептидным
Прямо и через стимуляцию освобождения глюкокортикоидов вызывает выраженный гипергликемический эффект.
Слайд 36
Уровень глюкозы в крови – лабильный показатель. Измеренный уровень глюкозы отражает
Исследование рекомендуется проводить натощак, в спокойном состоянии пациента, перед анализом нельзя курить, выполнять физическую работу. Стояние крови со сгустком или форменными элементами снижает результаты, при транспортировке крови в жаркое время усиливается гликолиз в эритроцитах, результаты получаются заниженными. При длительном хранении сыворотки или плазмы при комнатной температуре происходит рост микроорганизмов, при этом уровень глюкозы снижается.
Слайд 37
Диагноз СД правомерен, если содержание глюкозы в крови натощак составляет 6,7
Кроме СД, гипергликемия наблюдается при следующих состояниях и заболеваниях: эпидемический энцефалит, сифилис ЦНС, повышение гормональной активности щитовидной железы, коры и мозгового слоя надпочечников, гипофиза; травмы и опухоли мозга, эпилепсия, отравления окисью углерода, сильные эмоциональные и психические возбуждения.
Слайд 38Гипогликемия
Глюкоза является жизненно важным энергетическим сырьем для мозга. Дефицит глюкозы приводит
Натощак мозг потребляет энергию, эквивалентную 80 г/сут, что не может быть обеспечено НЭЖК, быстро мобилизуемым альтернативным топливом.
Мозг может утилизировать кетоновые тела, но они не продуцируются со скоростью, достаточной для противодействия гипогликемии
Слайд 39
Гипогликемия – это лабораторный диагноз, который ставится, если натощак в венозной
(глюкоза плазмы – менее 2,5 ммоль/л)
У пожилых больных развитие симптомов может наблюдаться и при более высоких уровнях, в то время как дети устойчивы и к более низким уровням.
Слайд 40
Клинические симптомы гипогликемии делятся на две основные группы: вызванные избыточной экскрецией
Симптомы, вызванные высвобождением адреналина, при острой гипогликемии развиваются раньше и включают раздражительность, слабость, головную боль, потливость , тремор, тахикардию, чувство страха и голода.
Слайд 41
Симптомы, развивающиеся вследствие нарушений функций ЦНС, включают визуальные симптомы, головную боль,
Слайд 42Причины гипогликемии
Сниженный выход глюкозы
Заболевания печени
Злоупотребление
Наследственные метаболические нарушения
-Дефицит гликогенсинтетазы
- Болезни накопления гликогена
- Галактоземия
- Наследственная непереносимость фруктозы
- Нарушение рециклинга гликолитических
интермедиатов
Слайд 43
Эндокринные заболевания
-Дефицит гормона роста
--------------------------------------------------------
Увеличенная утилизация глюкозы
Снижение запасов жиров
- Недоношенность
- Нарушения питания
- Окислительные дефекты
Нарушение окисления жирных кислот
-Дефекты транспорта ЖК в митохондрии
-Окислительные дефекты
-Нарушенная продукция или утилизация
кетоновых тел
Слайд 44Сниженный выход и увеличенная утилизация глюкозы
Гиперинсулинизм
- Экзогенная продукция
Инсулинома
Гиперплазия островковых клеток
Непанкреатические опухоли
Постгастроэктомия
--------------------------------------------------------------
Слайд 45Сниженный выход глюкозы
Заболевания печени.
Гипогликемия может быть осложнением заболеваний печени,
Гипогликемия может развиваться при массивной гепатоцеллюлярной деструкции.
Слайд 46
Употребление алкоголя. Алкоголь ингибирует глюконеогенез и симптомы гипогликемии, возникающие после употребления
Слайд 47
Наследственные метаболические нарушения.
Запасы гликогена в печени снижаются при
дефиците фермента гликогенсинтетазы, что
является
для постабсорбтивной гипогликемии.
Образование глюкозы из глюкозо-6-фосфата
нарушается при болезни накопления гликогена 1 типа.
Слайд 48
Высвобождение глюкозы в постабсорбтивный период нарушается при болезни накопления 111 типа.
При
Слайд 49Эндокринные заболевания
Дефицит контринсулярных гормонов – нечастая причина гипогликемии.
Так, гипогликемия может
Слайд 50
Увеличенная утилизация глюкозы.
Сниженная продукция кетоновых тел. Постоянная
Снижение запасов жиров. Низкие уровни запасов жиров обусловливают ограниченный кетогенез, и это может быть причиной гипогликемии у недоношенных детей, у людей с нарушенным питанием, при голодании
Слайд 51
Нарушение окисления жирных кислот.
Активированные длинноцепочечные жирные кислоты транспортируются карнитином
Этот процесс ускоряется двумя карнитин – трансферазами. Дефицит карнитина или недостаточная активность одного из двух ферментов могут вызывать нарушение окисления длинноцепочечных жирных кислот.
Внутримитохондриальные жирные кислоты окисляются группой ацилдегидрогеназ.
Слайд 52
Изолированные или множественные дефицитные состояния по этим ферментам могут вызывать гипогликемию
Аномалии карнитина и ацилдегидрогеназ вызывают повышение уровней НЭЖК в плазме.
Слайд 53
Сниженный выход и увеличенная утилизация глюкозы
Инсулин быстро
Слайд 54
Гиперинсулинемия может быть следствием неадекватной эндогенной продукции гормона инсулиномой- частой причиной
Инсулиномы – опухоли из панкреатических бета- клеток.
Слайд 55
Непанкреатические опухоли – большие мезенхимальные новообразования, первичные карциномы печени.
Слайд 56
Постгастроэктомия
Гипогликемия, развивающаяся спустя 2 часа после приема
Другие причины
Незидиобластоз – диффузное увеличение панкреатических эндокринных клеток.
Слайд 57
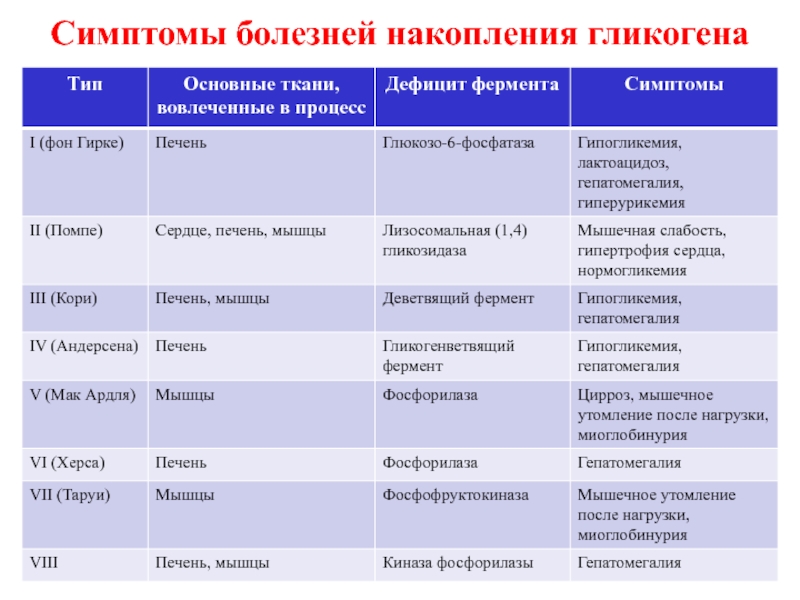
Болезни накопления гликогена (гликогенозы)
Характеризуются отложением в тканях гликогена
Гликоген в основном определяется в печени и мышцах, синтезируется из глюкозы с участием ферментов.
Слайд 58
Гликогеноз 1 типа (болезнь фон Гирке)
вызывается дефицитом глюкозо-6-фосфатазы, что приводит
Гликоген накапливается в печени, вызывая гепатомегалию.
Кроме того, нарушается метаболизм лактата, так как молочная кислота превращается в глюкозу через образование глюкозо-6 фосфата в цикле Кори. Поэтому клинически выявляется метаболический ацидоз.
Слайд 59
Галактоземия. Нарушение метаболизма галактозы может быть следствием дефектов трех ферментов. Чаще
Позднее развиваются гепатомегалия, желтуха, асцит, катаракта, задержка умственного развития, нарушение почечной канальцевой функции, в частности глюкозурия и аминоацидурия
Слайд 61
Катаракта вызывается превращением альдозоредуктазой в хрусталиках галактозы в галактитол, что приводит
Слайд 62
Наследственная непереносимость фруктозы
Связана с дефицитом фруктозо-1-фосфат-альдолазы В, превращающей в печени
Тогда развивается гипогликемия, рвота и сонливость, как результат внутриклеточного накопления фруктозо-1-фосфата.
Фруктоза экскретируется в мочу, давая позитивную реакцию на редуцирующие вещества, но не на глюкозу.
Слайд 63
Эссенциальная фруктозурия
Доброкачественное состояние вызывается дефицитом фруктокиназы, фосфорилирующей
Фруктоза при этом экскретируется с мочой.
Состояние диагностируется по определению в моче редуцирующих веществ
Слайд 64 САХАРНЫЙ ДИАБЕТ - это гетерогенная группа нарушений, характеризующихся
Слайд 65
При ИЗСД секреция инсулина отсутствует или сильно снижена, что является
У большинства пациентов обнаруживаются циркулирующие антитела к островковым клеткам; определяется инфильтрация островков Т-лимфоцитами. В развитии ИЗСД важны генетические факторы: индивидуумы с антигенами DR3 и DR4 системы антигенов лейкоцитов (НLA) обладают повышенной предрасположенностью к заболеванию, хотя риск передачи по наследству этого варианта диабета составляет только 5-10%.
Слайд 66
Заболевание развивается при воздействии различных факторов окружающей среды на людей,
Слайд 67Инсулиннезависимый сахарный диабет - это гетерогенная группа нарушений, имеющая ряд отличий
Слайд 68
Секреция инсулина при ИНЗСД сохранена, хотя неадекватна для контроля уровня глюкозы
Кетоз у таких больных наблюдается редко, хотя может отмечаться у больных ИНЗСД при острых состояниях. У пациентов с диабетом 11 типа может развиваться гиперосмолярная некетотическая кома.
Слайд 69
Ежегодная заболеваемость СД составляет
4-5 %
При этом 16% больных – СД 1
84% больных - СД 2 типа
В России зарегистрировано более 3 млн больных
Слайд 71ВТОРИЧНЫЙ ДИАБЕТ - развивается на фоне ряда патологических состояний, в частности,
Слайд 72 САХАРНЫЙ ДИАБЕТ БЕРЕМЕННЫХ называют гестационным диабетом,
Слайд 73
В диагностике сахарного диабета важную роль играют лабораторные методы исследования и
В связи с большим медицинским и социальным значением сахарного диабета диагностика его требует особой аккуратности и точности.
ДИАГНОСТИЧЕСКИМ КРИТЕРИЕМ сахарного диабета является повышение концентрации глюкозы в крови натощак и через 2 часа нагрузки глюкозой.
Определение проводится натощак, спустя, по крайней мере, 10 часов после последнего приема пищи.
Концентрация глюкозы в крови зависит от скорости ее поступления в систему циркуляции и интенсивности утилизации.
Официально признан диапазон нормальных значений для сыворотки и плазмы натощак 3,8 -6,1 ммоль/л, в цельной крови 3,3-5,5 ммоль/л, причем в артериальной крови выше, чем в венозной крови примерно на 0,25 ммоль/л У здоровых людей редко, когда уровень глюкозы в крови снижается ниже 2,5 или повышается свыше 8,0 ммоль/л
Слайд 74 Уровень глюкозы в крови - достаточно лабильный показатель.
При исследовании глюкозы в крови большое значение имеет преанали-тический этап. Исследование рекомендуется проводить натощак, в спокойном состоянии пациента, перед анализом он не должен курить, выполнять физическую работу. Стояние крови со сгустком или форменными элементами снижает результаты, при транспортировке крови в жаркое время усиливается гликолиз в эритроцитах, результаты получаются заниженными. При длительном хранении сыворотки или плазмы при комнатной температуре происходит рост микроорганизмов, при этом уровень глюкозы снижается.
Диагноз СД правомерен, если содержание глюкозы в крови натощак составляет 6,7 ммоль/ л и более, а дневные колебания на фоне обычного режима питания - до 10,0 ммоль/ л и более. Кроме СД, гипергликемия наблюдается при следующих состояниях и заболеваниях: эпидемический энцефалит, сифилис ЦНС, повышение гормональной активности щитовидной железы, коры и мозгового слоя надпочечников, гипофиза; травмы и опухоли мозга, эпилепсия, отравления окисью углерода, сильные эмоциональные и психические возбуждения.
Слайд 75Гипогликемию вызывают следующие причины:
длительное голодание
нарушение всасывания углеводов (заболевания желудка
хронические заболевания печени вследствие нарушения синтеза гликогена и уменьшения печеночного депо углеводов;
заболевания, связанные с нарушением секреции контринсулярных гормонов (гипопитуитаризм, хроническая недостаточность коры надпочечников, гипотиреоз)
у больных с сахарным диабетом, получающих инсулин, наиболее тяжелые гипогликемические состояния, вплоть до гипогликемической комы, обычно развиваются при нарушении режима питания - пропуске приема пищи, а также рвоте после еды
Легкие гипогликемические состояния могут наблюдаться при заболеваниях, протекающих с так называемой функциональной гиперинсулинемией: ожирение, сахарный диабет II типа легкой степени
Слайд 76 Иногда гипогликемические состояния наблюдаются у лиц с заболеваниями ЦНС: распространенными
Наиболее тяжелая гипогликемия (за исключением случаев передозировки инсулина) наблюдается при органическом гиперинсулинизме вследствие инсулиномы или гиперплазии- бета- клеток островков поджелудочной железы. В некоторых случаях содержание глюкозы в крови больных гиперинсулинизмом составляет менее 1 ммоль/л
Спонтанные гипогликемии при саркоидозе
Слайд 78При содержании глюкозы от 5,6 до 6,7 ммоль/л, а также лицам
Для его проведения больной 3 дня должен получать диету, содержащую не менее 125 г углеводов. Если обследуемый потреблял меньшее количество углеводов, то ему назначают диету с содержанием 130 - 150 г углеводов. Пробу проводят утром через 10-14 часов голодания. Берут исходную порцию крови, далее больной принимает 75 г глюкозы, растворенной в 200- 300 мл воды, а ребенок из расчета 1,75 г глюкозы на 1 кг веса (но не более 75 г). После этого кровь берут через 30, 60, 90 и 120 минут.
Согласно рекомендаций ВОЗ по СД, кровь при проведении ГТТ исследуют натощак и через 90 минут после приема глюкозы.
Диагноз СД ставится, если натощак концентрация глюкозы в пределах 6,7 и более ммоль/л, а через 2 часа - 10,0 и более ммоль/ л Если уровень глюкозы менее 6,7 ммоль/л, а через 2 часа в интервале 5,6- 10,0 ммоль/л, то это трактуется как нарушение толерантности к глюкозе.
Слайд 81 Гликемический профиль – результат 6- или 8 кратного определения глюкозы
Кровь берут из пальца перед завтраком, обедом, ужином и через 90 минут после приема пищи.
Определение уровня глюкозы в течение дня используется для оценки эффективности лечения и компенсации сахарного диабета.
Слайд 82 Сахарный диабет 1 типа ( инсулинзависимый )
считается компенсированным, если
При этом типе диабета допускается потеря глюкозы с мочой до 20-30 г в сутки
Сахарный диабет 2 типа (инсулиннезависимый)
имеет более строгие критерии компенсации:
содержание глюкозы в крови натощак не должно превышать 6,0ммоль/л, а в дневных колебаниях – не выше 8,25 ммоль/л.
В моче глюкоза должна отсутствовать ( аглюкозурия )
Слайд 83Для оценки результатов ГТТ вычисляют два показателя: гипергликеми-ческий и гипогликемический коэффициенты.
Гипергликемический
Гипогликемический коэффициент - отношение содержания глюкозы через 2 часа к ее уровню натощак; в норме он должен быть менее 1,3.
Если по изложенным критериям у больного не выявляется нарушений толерантности к глюкозе, но величина одного или обоих коэффициентов превышает нормальную, кривая нагрузки глюкозой трактуется как "сомнительная". Такому пациенту следует рекомендовать воздержаться от злоупотребления углеводами и повторить тест через 1 год. Причины нарушения толерантности к глюкозе изложены в таблице.
Слайд 84
Глюкоза мочи
Почечный порог глюкозы 8,8-9,9 ммоль/л
Почечная реабсорбция глюкозы
Слайд 85
Определение антител против островковых клеток и к инсулину
Антитела к инсулину находят
Слайд 86
Глюкагон
Содержание глюкагона в плазме у взрослых в норме - 60 -200
Глюкагон - полипептид, состоящий из 29 аминокислотных остатков. Он имеет короткий период полураспада (несколько минут) и является функциональным антогонистом инсулина. При сахарном диабете сочетанность действий этих гормонов проявляется тем, что недостаток инсулина сопровождается избытком глюкагона, который, собственно, и является причиной гипергликемии. Особенно хорошо это можно видеть на примере лечения инсулин-зависимого сахарного диабета, т.е. абсолютной недостаточности инсулина. В этом случае очень быстро развиваются гипергликемия и метаболический ацидоз, которые можно предотвратить, назначая соматостатин, ингибирующий синтез и секрецию глюкагона. После этого даже при полном отсутствии инсулина гипергликемия не превышает 9 ммоль/л.
Слайд 87
Гликирование происходит и при нормальной концентрации глюкозы, однако скорость
В условиях гипергликемии скорость этого процесса нарастает, и в клетках и во внеклеточном пространстве происходит накопление значительного количества неферментативно гликированных протеинов.
Слайд 88
Неферментативное гликирование белков существенно отражается на их функции. Так, гликирование
Гликирование белков хрусталика глаза приводит к снижению его прозрачности и нарушениям зрения.
Слайд 89
В крови могут гликироваться некоторые компоненты свертывающей системы, что является одной
В эритроцитах неферментативному гликированию подвергается гемоглобин. Глюкоза присоединяется к N- концевому Валину в бета-цепях. Такой гемоглобин называют HbA1c. В норме гликированный гемоглобин составляет 4-6% от общего гемоглобина. При гипергликемии этот показатель существенно возрастает. Гликированный гемоглобин обладает более высоким по сравнению с обычным гемоглобином А сродством к кислороду.
У больных с высоким содержанием гликированного гемоглобина отмечается повышение кислорода в венозной крови и уменьшение артерио-венозной разницы.
Слайд 90Значительное увеличение концентрации глюкагона в крови является признаком глюкагономы - опухоли
МОНИТОРИНГ САХАРНОГО ДИАБЕТА
Задачами мониторинга являются объективная оценка уровни гликемии за предшествующий промежуток времени ( до 2-х месяцев );
своевременная коррекция лечения; подбор оптимальных форм инсулина и др. сахароснижающих препаратов
мониторинг компенсации диабета.
Слайд 98
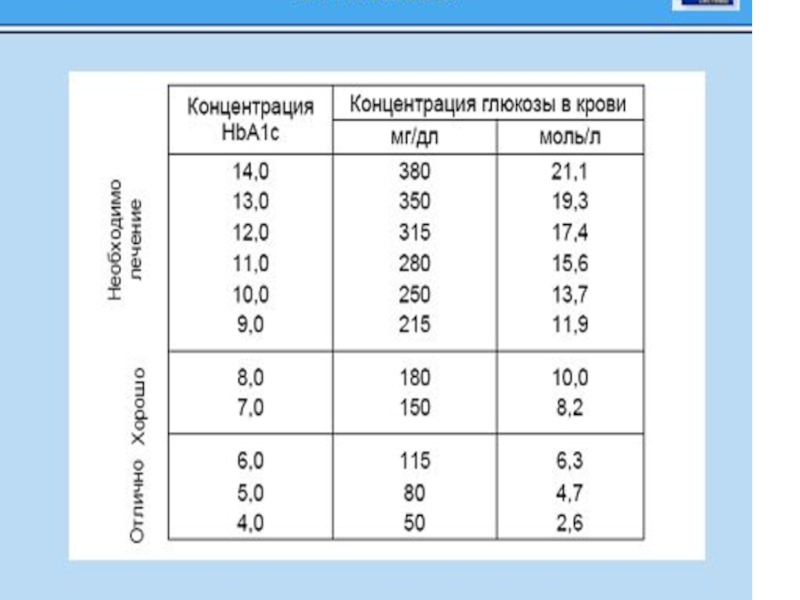
Гликированный гемоглобин в крови
Содержание гликированного гемоглобина (HbA1c) в крови в
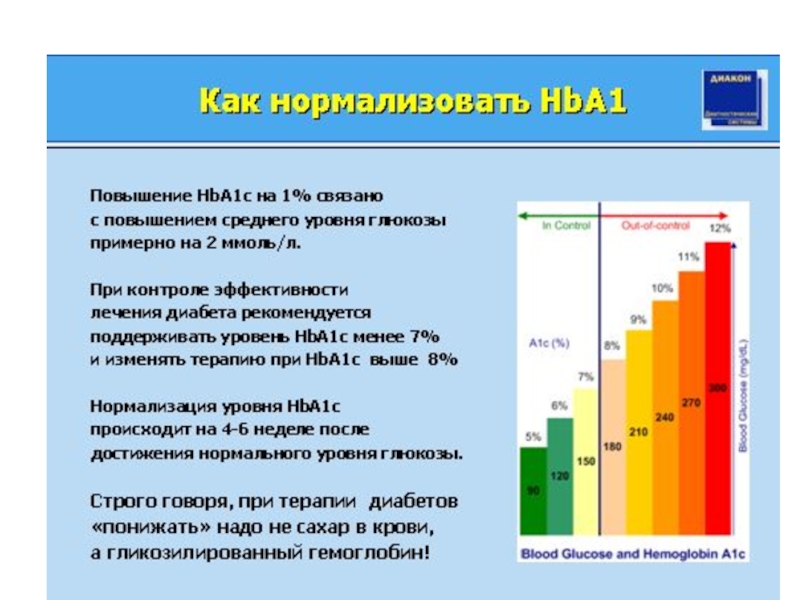
HbA1c является гликированной формой присутствую-щего в эритроцитах гемоглобина А. При повышенных концентрациях глюкозы в крови она вступает в неферментативное взаимодействие с белками плазмы с образованием шиффовых оснований, в том числе с гемоглобином. Степень гликирования гемоглобина зависит от концентрации глюкозы в крови и длительности контакта глюкозы с гемоглобином. Позтому количество гликированного гемоглобина пропорционально концентрации глюкозы и длительности инкубации (контакта с эритроцитами). Измерение концентрации HbA1c позволяет ретроспективно оценивать уровень гипергликемии при сахарном диабете. По сути HbA1c состоит из трех компонентов: HbA1a, HbA1b и HbA1c дает более тесную корреляцию со степенью выраженности гипергликемии у больных сахарным диабетом.
Уровень гликированного гемоглобина в эритроцитах является интегральным показателем состояния углеводного обмена за предшествующие 6-8 недель
Результаты исследования оцениваются следующим образом: 4-6 % свидетельствуют о хорошей компенсации сахарного диабета в последние 1-1,5 мес, 6-8,9 % - субкомпенсация, 9,0 % и выше - декомпенсация
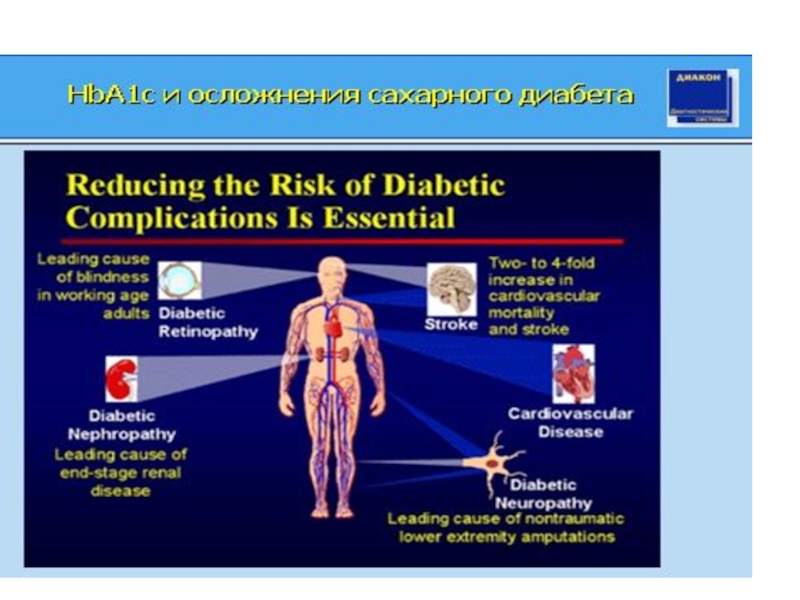
3Степень риска развития микро- и макро-сосудистых осложнений диабета
Слайд 99
Ложные сниженные значения HbA1c имеют место при уремии,
Гликированный гемоглобин – предиктор патологий беременности, осложненной сахарным диабетом. Особенно важно вести контроль в первом триместре беременности, когда происходит закладка внутренних органов плода. Повышенный уровень гликированного гемоглобина на протяжении 6 месяцев до зачатия и в течении 1 триместра беременности напрямую связан
с ее неблагоприятным исходом. Жесткий контроль за уровнем за уровнем гликемии позволяет снизить частоту пороков развития плода с 30-40% до 2%
Слайд 100
Фруктозамин в сыворотке
Содержание фруктозамина в сыворотке в
Фруктозамин представляет собой продукт гликирования белков плазмы крови.
Степень гликирования белков плазмы зависит от концентрации глюкозы в крови и длительности периода полураспада белков.
Количество фруктозамина в крови является хорошим показателем для ретроспективного контроля за содержанием глюкозы в крови у больных сахарным диабетом и позволяет оценивать эффективность проводимого лечения без отягощающего больного ежедневного контроля за уровнем гликемии в крови.
В отличие от гликированного гемоглобина Фруктозамин отражает средний уровень глюкозы в крови за 2-3 нед до измерения.
Это обусловлено периодом полураспада гликированных белков:
для альбумина он составляет 20 дней, тогда как для гемоглобина — определен длительностью полураспада эритроцитов (60 дней).
Слайд 101
Определение фруктозамина имеет преимущество перед определением гликированного гемоглобина, так как не
При оценке результатов исследования фруктозамина как критерия компенсации сахарного диабета считают, что при содержании его в крови от 280 до 320 мкмоль/л компенсация удовлетворительная,
выше 320 мкмоль/л — наступает декомпенсация.
Слайд 102
Молочная кислота (лактат) в крови
Лактат является конечным продуктом анаэробного гликолиза.
Слайд 103
Микроальбуминурия
Может быть определена как скорость экскреции альбумина,
Небольшое увеличение экскретируемого с мочой альбумина не определяется тест-полосками и необходимо проводить количественное определение белка в сборе мочи за 24 часа.
Слайд 104
Прогнозирование сахарного диабета
определение антител к GAD - к декарбоксилазе глутаминовой
определение эндогенных антител к островкам Лангерганса и антител к инсулину - выявление преддиабета и симптоматических явлений ИЗСД
лептин - это белок, секретируемый адипоцитами. Лептин - важнейший регулятор энергетического обмена. В норме лептин подавляет секрецию нейропептида Y в гипоталамусе. Нейропептид Y участвует в формировании чувства голода и стимулирует секрецию инсулина. У лиц с ожирением уровень лептина в сыворотке значительно повышен. Избыток лептина приводит к подавлению секреции инсулина и вызывает инсулинорезистентность скелнетных мышц и жировой ткани.
Женщины 1,1 – 27,6 нг/мл
Мужчины 0,5 – 13,8 нг/мл