- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Метаболічні перетворення білків і амінокислот презентация
Содержание
- 1. Метаболічні перетворення білків і амінокислот
- 3. ОСНОВНІ ФУНКЦІЇ БІЛКІВ Основні структурні компоненти органів
- 4. ОСНОВНІ ФУНКЦІЇ БІЛКІВ
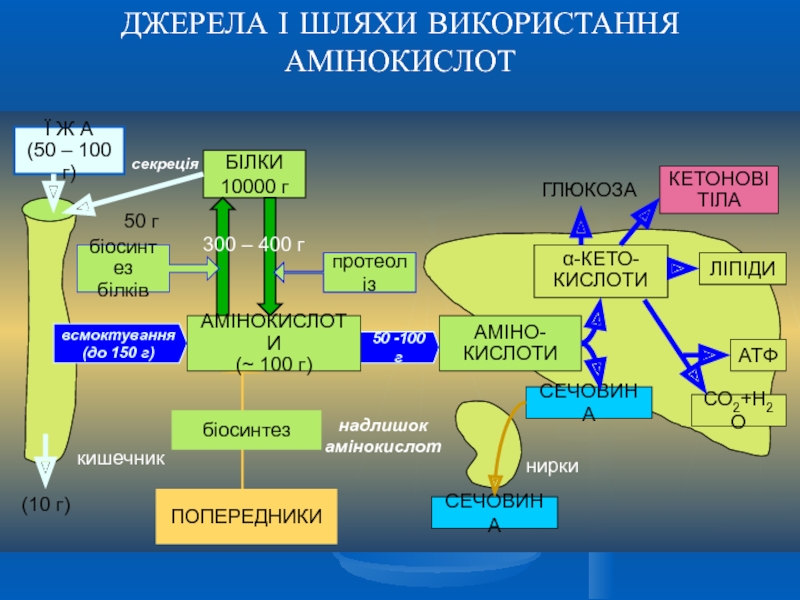
- 5. ДЖЕРЕЛА І ШЛЯХИ ВИКОРИСТАННЯ АМІНОКИСЛОТ
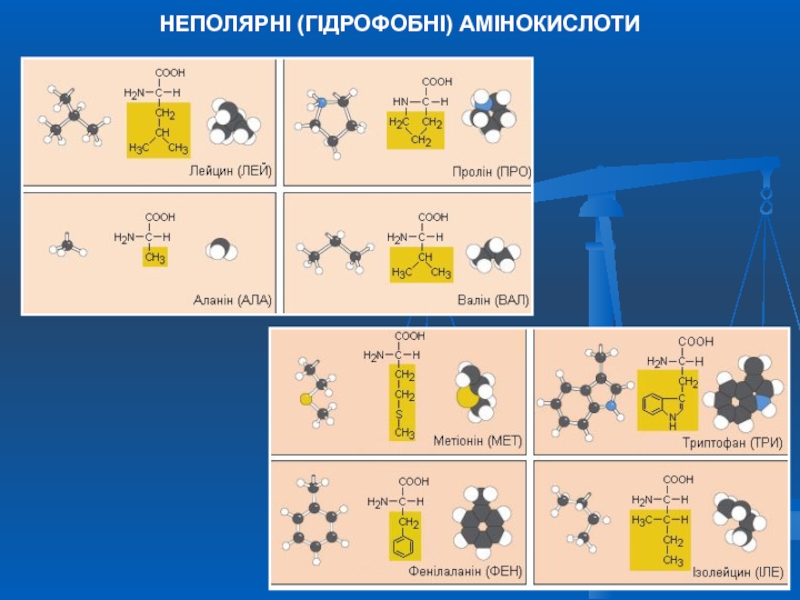
- 6. НЕПОЛЯРНІ (ГІДРОФОБНІ) АМІНОКИСЛОТИ
- 7. Полярні (гідрофільні) амінокислоти бувають: незаряджені, негативно заряджені, позитивно заряджені ПОЛЯРНІ (ГІДРОФІЛЬНІ) АМІНОКИСЛОТИ
- 8. НЕОБХІДНІ АМІНОКИСЛОТИ
- 9. МЕХАНІЗМ ДІЇ ПРОТЕЇНАЗ (Гідролази - КФ3.4.1- 3.4.4 ) ЕКЗО- ТА ЕНДОПЕПТИДАЗИ
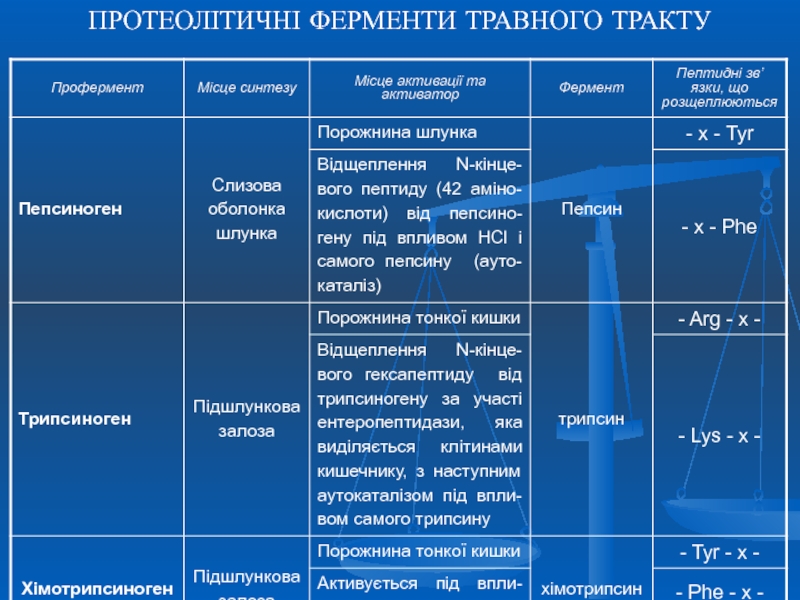
- 10. ПРОТЕОЛІТИЧНІ ФЕРМЕНТИ ТРАВНОГО ТРАКТУ
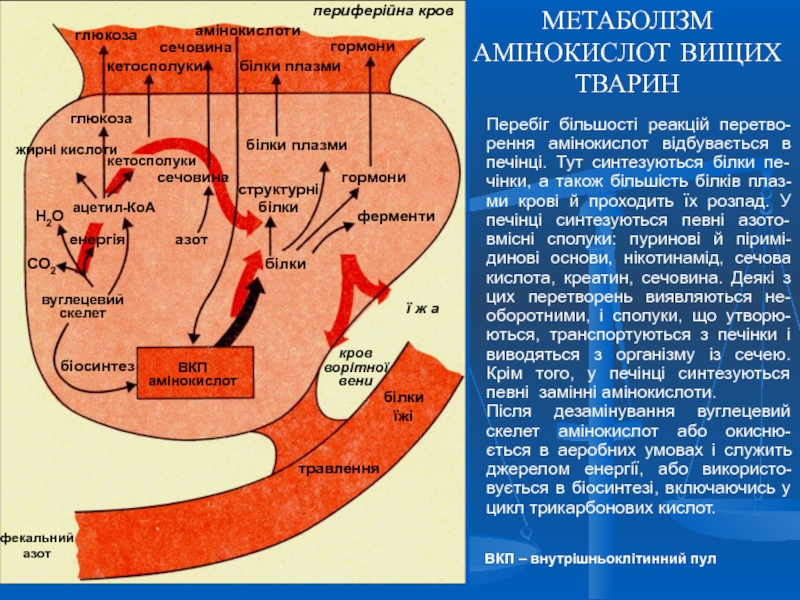
- 11. МЕТАБОЛІЗМ АМІНОКИСЛОТ ВИЩИХ ТВАРИН Перебіг більшості
- 12. П’ЯТЬ НАЙВАЖЛИВІШИХ МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ, а
- 13. П’ЯТЬ НАЙВАЖЛИВІШИХ МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ
- 14. α-амінокислота α-кетокислота
- 15. ТРАНСАМІНУВАННЯ ( ПЕРЕАМІНУВАННЯ ) Трансамінування – це
- 16. Модифікація бічного ланцюга відбувається головним чином при
- 17. Пептидні ланцюги (три-, тетра-, пента-, оліго- та поліпептиди) виникають за рахунок полімеризації амінокислот
- 18. НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування)
- 20. Біосинтез амінокислот Важливе місце в
- 23. Біосинтез окремих амінокислот
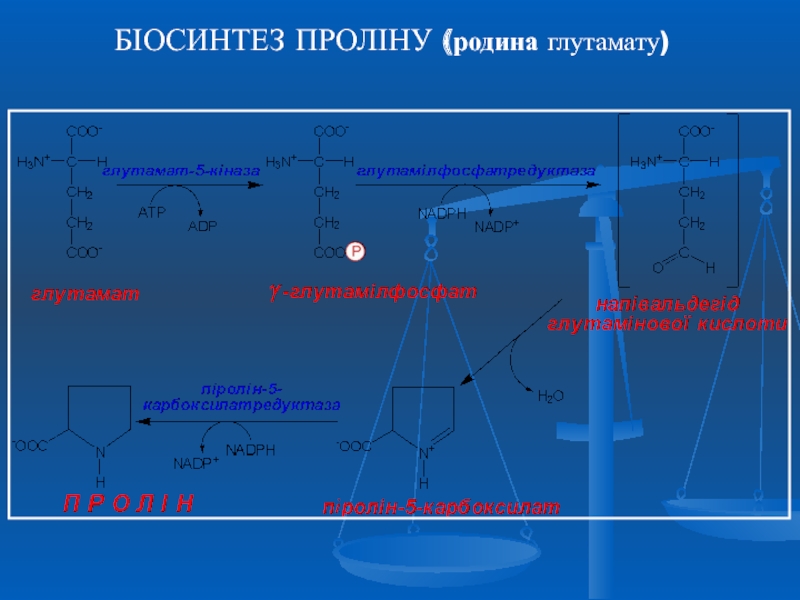
- 24. БІОСИНТЕЗ ПРОЛІНУ (родина глутамату)
- 25. БІОСИНТЕЗ АРГІНІНУ (родина глутамату) КГ - α-кетоглутарат ГЛУ - глутамат
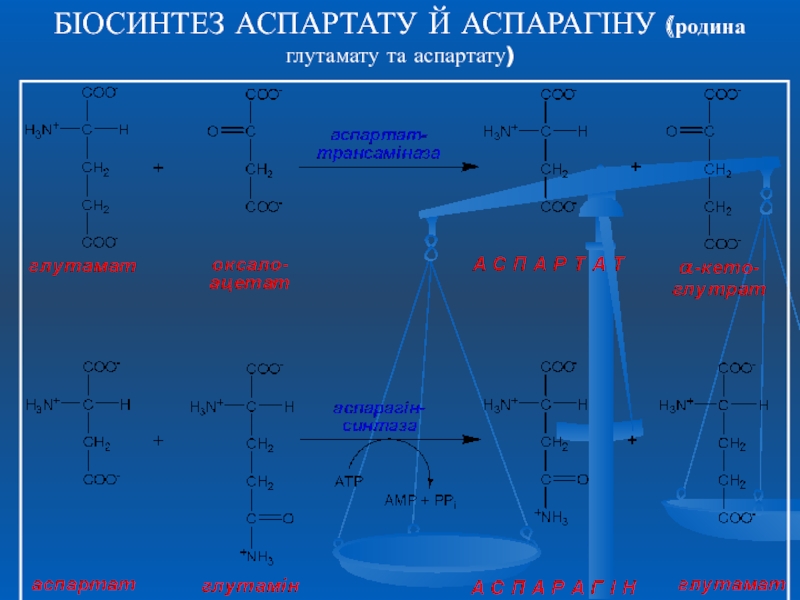
- 26. БІОСИНТЕЗ АСПАРТАТУ Й АСПАРАГІНУ (родина глутамату та аспартату)
- 27. БІОСИНТЕЗ ТРЕОНІНУ (родина аспартату) Схема шляхів біосинтезу метіоніну, лізину, ізолейцину (пунктирні стрілки)
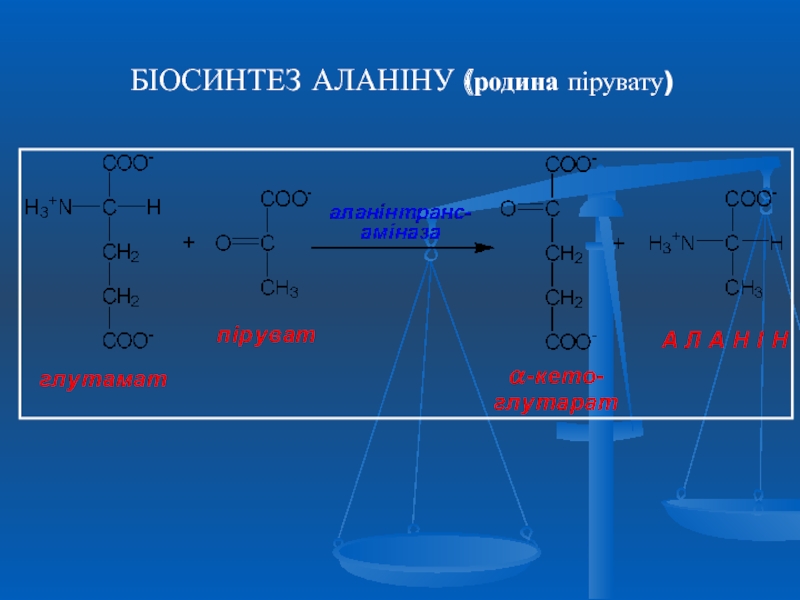
- 28. БІОСИНТЕЗ АЛАНІНУ (родина пірувату)
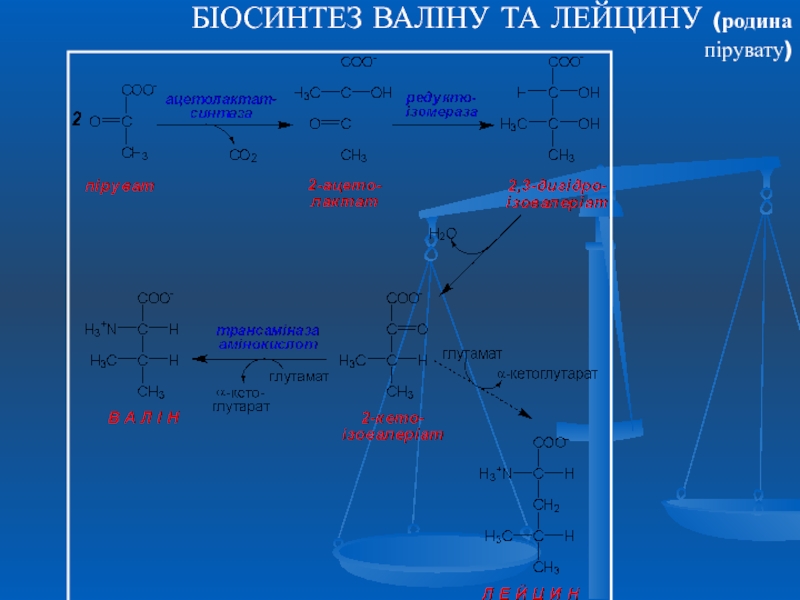
- 29. БІОСИНТЕЗ ВАЛІНУ ТА ЛЕЙЦИНУ (родина пірувату)
- 30. БІОСИНТЕЗ СЕРИНУ, ЦИСТЕЇНУ ТА ГЛІЦИНУ (родина серину)
- 31. ЗАГАЛЬНА СХЕМА БІОСИНТЕЗУ ГІСТИДИНУ, ТРИПТОФАНУ, ФЕНІЛАЛАНІНУ
- 32. БІОСИНТЕЗ АМІНОКИСЛОТ Важливою реакцією в син-тезі
- 33. Т Р А Н С А
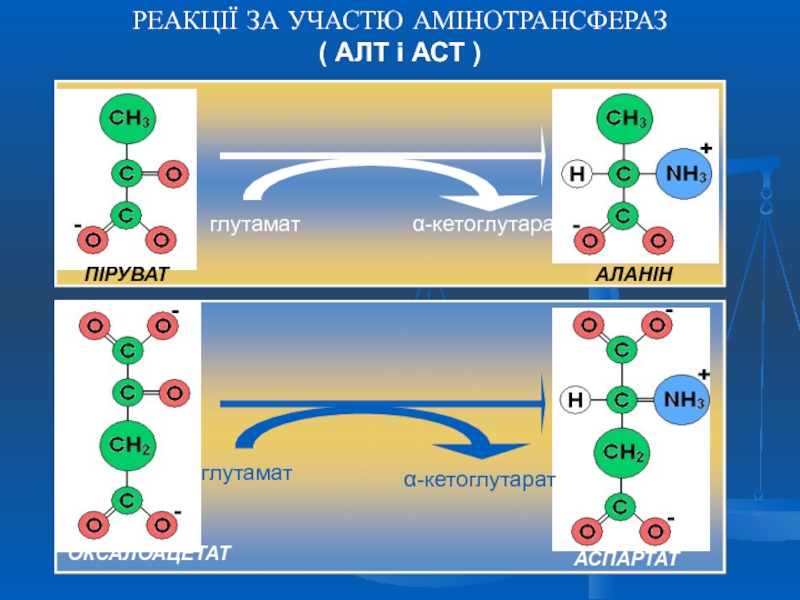
- 34. РЕАКЦІЇ ЗА УЧАСТЮ АМІНОТРАНСФЕРАЗ ( АЛТ і АСТ )
- 35. Біологічне значення трансамінування Реакції
- 36. КАТАБОЛІЗМ ВУГЛЕЦЕВИХ СКЕЛЕТІВ АМІНОКИСЛОТ
- 37. Амінокислоти, які перетворюються в піруват
- 38. КАТАБОЛІЗМ ВУГЛЕЦЕВИХ СКЕЛЕТІВ АМІНОКИСЛОТ
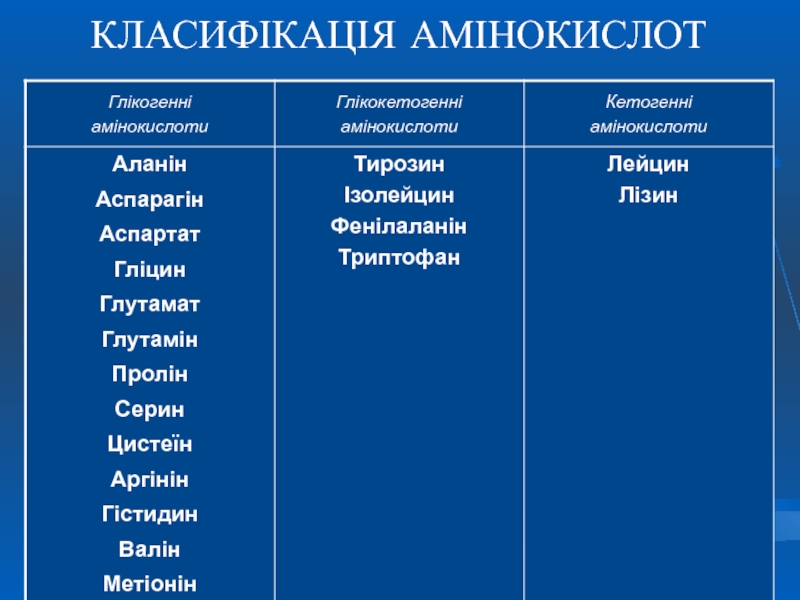
- 39. КЛАСИФІКАЦІЯ АМІНОКИСЛОТ
- 40. Спадкові порушення катаболізму амінокислот Фенілкетонурія. Тирозиноз. Алкаптонурія. Альбінізм. Хвороба Паркінсона.
- 41. Фенілкетонурія - відсутність або дефіцит
- 42. Тирозиноз (тирозинемія I типу)
- 43. Алкаптонурія (“чорна сеча”). Причина
- 44. Сеча набуває чорного кольору на повітрі Клінічні
- 45. Альбінізм - генетично детермінована відсутність або недостатність
- 46. Симптоми альбінізму: відсутність пігментації шкіри
- 47. Хвороба Паркінсона. Захворювання розвивається внаслідок
- 48. Залежно від форми виведення амінного
- 49. ОСНОВНИЙ ШЛЯХ ВИВЕДЕННЯ АМІАКУ З ОРГАНІЗМУ
- 50. СИНТЕЗ СЕЧОВИНИ орнітиновий цикл; цикл Кребса-Гензелейта NH3+
Слайд 3ОСНОВНІ ФУНКЦІЇ БІЛКІВ
Основні структурні компоненти органів і тканин, а також усіх
Енергетична функція (катаболітичні процеси).
Поживна, запасаюча функція.
Виявляють каталітичну (ферментативну) активність – проте у 1982 р.- відкриття РНКзимів.
Беруть участь у регуляції метаболізму -клітинний рівень: білки - репрессори та активатори транскрипції; організменний - білкова природа гормонів.
Виконують захисну функцію – антитіла.
Беруть участь у процесах скорочення м'язів і руху (актино-міозинові комплекси)
Беруть участь у процесах трансформації енергії - білки сітківки ока трансформують світлову енергію в електричну.
Транспортна функція: а)гемоглобін здійснює транспорт О2, СО2;б)трансферрин - транспорт заліза; в) пермеази - мембранні білки, які переносять полярні сполуки через мембрану як за, так і проти градієнту концентрації.
Буферна функція.
Клітинна сигналізація - приклад, епідермальний фактор росту, що є промотором клітинного поділу.
Беруть участь у процесах міжклітинної взаємодії та розпізнавання клітинних поверхонь - молекули адгезії, інтегрини.
Рецепторні білки - інсулінові рецептори і інші.
Білки, що виконують спеціальні функції - високоваріабельні протеїни, наприклад,
антифризові білки, які попереджають від замерзання кров арктичних і антарктичних риб, клейові білки, що сприяють надійному прикріпленню мідій та інших морських організмів до скель.
Слайд 7
Полярні (гідрофільні) амінокислоти бувають: незаряджені, негативно заряджені,
позитивно заряджені
ПОЛЯРНІ (ГІДРОФІЛЬНІ) АМІНОКИСЛОТИ
Слайд 11МЕТАБОЛІЗМ АМІНОКИСЛОТ ВИЩИХ ТВАРИН
Перебіг більшості реакцій перетво-рення амінокислот відбувається в
Після дезамінування вуглецевий скелет амінокислот або окисню-ється в аеробних умовах і служить джерелом енергії, або використо-вується в біосинтезі, включаючись у цикл трикарбонових кислот.
периферійна кров
гормони
білки плазми
амінокислоти
сечовина
кетосполуки
глюкоза
глюкоза
кетосполуки
жирні кислоти
сечовина
азот
білки
гормони
білки плазми
ферменти
ацетил-КоА
Н2О
СО2
енергія
вуглецевий скелет
фекальний
азот
ВКП
амінокислот
ВКП – внутрішньоклітинний пул
травлення
кров
ворітної
вени
ї ж а
білки
їжі
біосинтез
структурні
білки
Слайд 12П’ЯТЬ НАЙВАЖЛИВІШИХ
МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ, а також…
1. ДЕКАРБОКСИЛЮВАННЯ
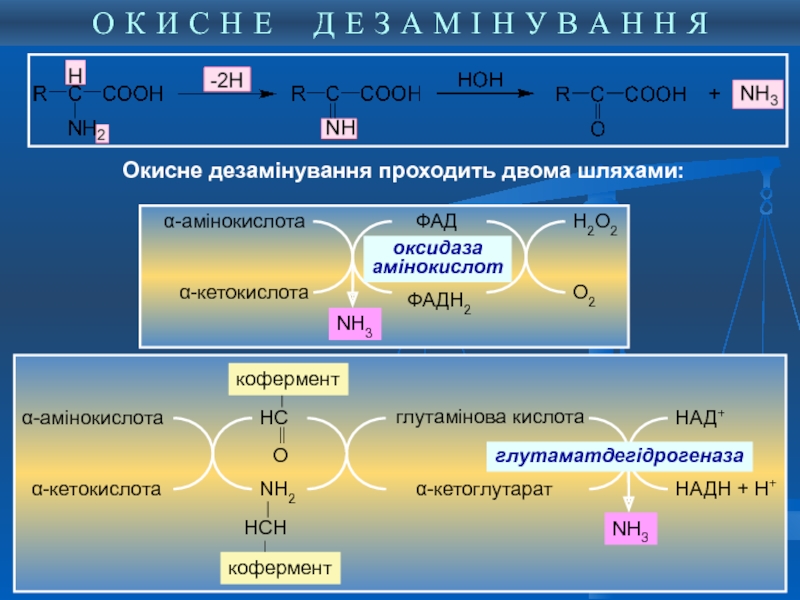
2. ОКИСНЕ ДЕЗАМІНУВАННЯ
3. ТРАНСАМІНУВАННЯ ( ПЕРЕАМІНУВАННЯ )
4. МОДИФІКАЦІЯ БІЧНОГО ЛАНЦЮГА
5. ПОЛІМЕРИЗАЦІЯ
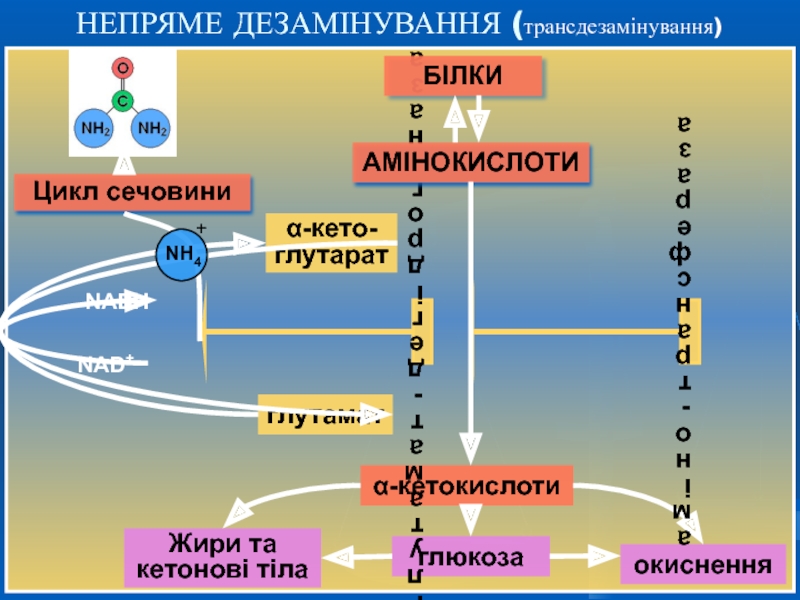
НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування)
Слайд 13П’ЯТЬ НАЙВАЖЛИВІШИХ
МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ
Амінокислоти підлягають декарбоксилюванню за участі
Слайд 14
α-амінокислота
α-кетокислота
ФАД
ФАДН2
оксидаза
амінокислот
Н2О2
О2
NH3
НС
О
NН2
α-амінокислота
α-кетокислота
кофермент
НСН
кофермент
глутамінова кислота
α-кетоглутарат
НАД+
НАДН + Н+
NH3
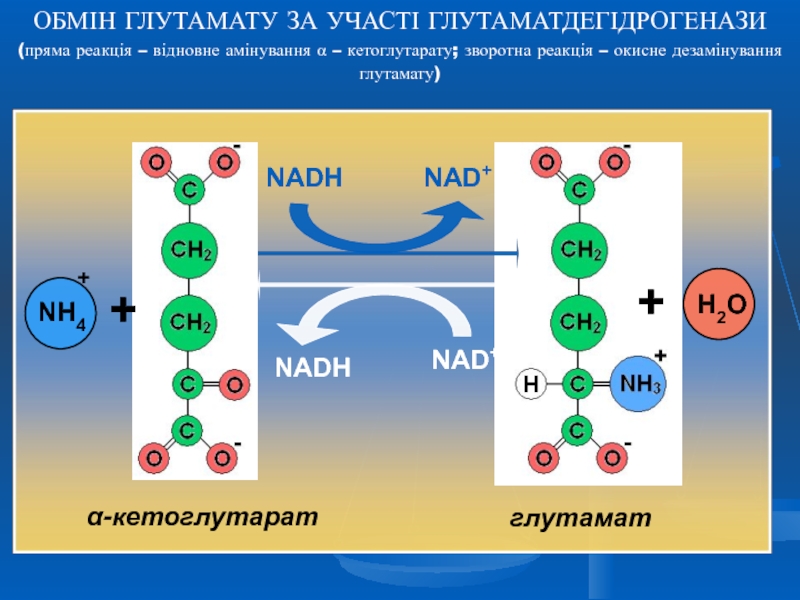
глутаматдегідрогеназа
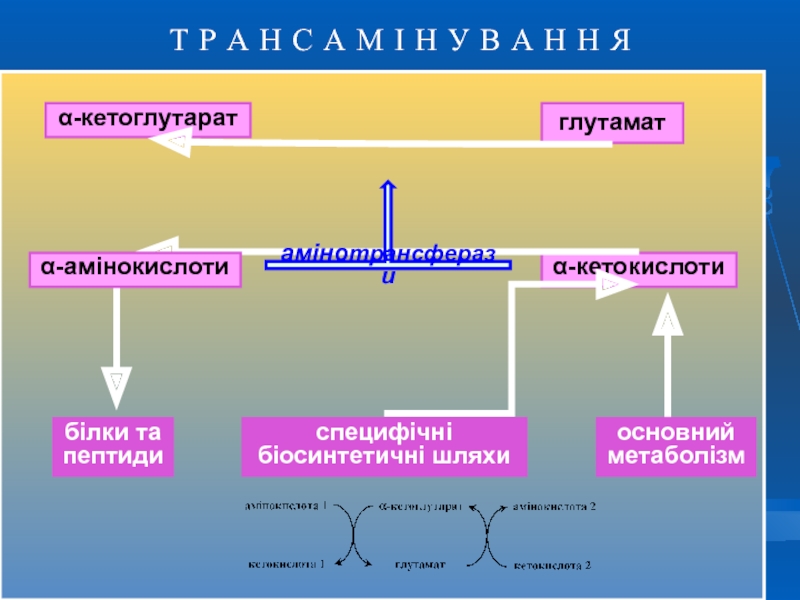
Слайд 15ТРАНСАМІНУВАННЯ ( ПЕРЕАМІНУВАННЯ )
Трансамінування – це основна біосинтетична реакція замінних амінокислот
Слайд 16Модифікація бічного ланцюга відбувається головним чином при взаємних перетвореннях гліцин ↔
Слайд 17Пептидні ланцюги (три-, тетра-, пента-, оліго- та поліпептиди) виникають за рахунок
Слайд 18 НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування)
Більшість амінокислот
За сукупності 2-х реакцій – трансамінування і окисного дезамінування аміногрупа амінокислоти перетворюється на аміак. Глутамінова кислота в цьому процесі виконує колекторну функцію - її аміногрупа “збирається” з інших амінокислот. Саме ця функція є визначальною в унікальній ролі глутамату в катаболізмі інших амінокислот.
Слайд 20Біосинтез амінокислот
Важливе місце в біосинтезі азотовмісних сполук є процес фіксації
глутаматдегідрогеназною та
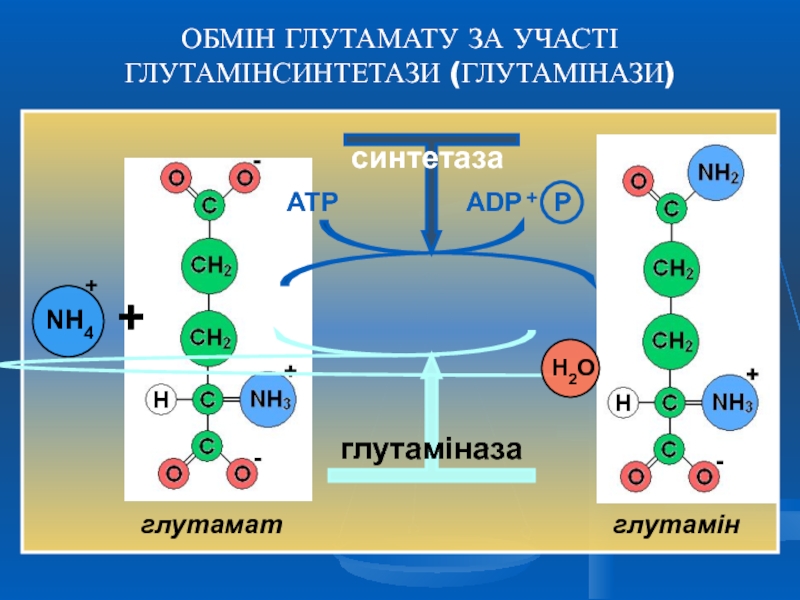
глутамінсинтетазною- послідовне включення двох молекул аміаку (амінокислоти)
карбамоїлфосфатсинтетазною - включення молекули аміаку (сечовина, піримідини)
Слайд 23Біосинтез окремих амінокислот
Функціонування біосинтетичних процесів
Родина глутамату – синтез власне глутамату, проліну, аргініну, аспартату і аспарагіну.
Родина аспартату – синтез власне аспартату, аспарагіну, треоніну, метіоніну, лізину, ізолейцину.
Родина пірувату - синтез аланіну, валіну, лейцину, ізолейцину.
Родина серину - синтез серину, цистеїну та гліцину.
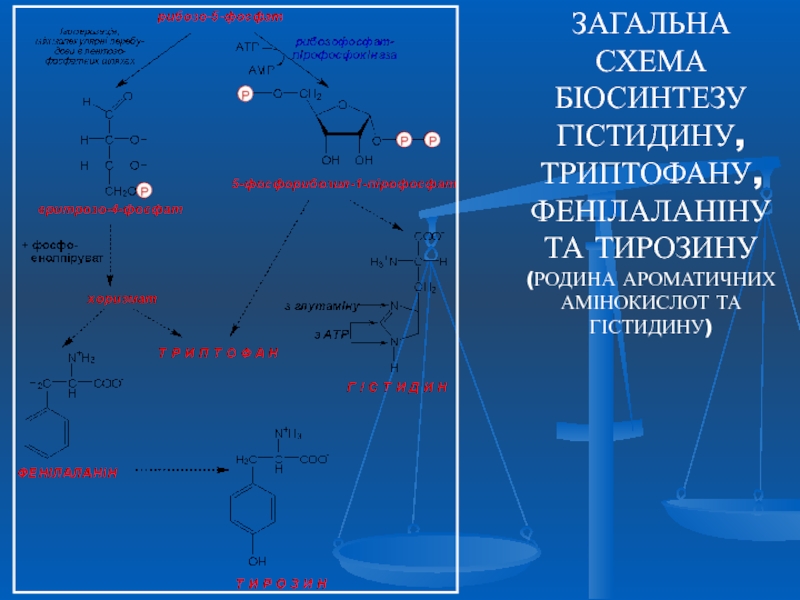
Родина ароматичних амінокислот та гістидину – синтез триптофану, фенілаланіну, тирозину та гістидину
Слайд 27БІОСИНТЕЗ ТРЕОНІНУ
(родина аспартату)
Схема шляхів біосинтезу метіоніну, лізину, ізолейцину (пунктирні стрілки)
Слайд 30БІОСИНТЕЗ СЕРИНУ,
ЦИСТЕЇНУ ТА ГЛІЦИНУ
(родина серину)
Пунктирною стрілкою показане багатоста-дійне перетворення метіоніну
Пунктирною лінією в молекулі цистатіоніну позначений зв'язок, що атакується циста-тіонін-γ-ліазою.
Глу – глутамат
КГ - α-кетоглутарат
Слайд 31ЗАГАЛЬНА
СХЕМА БІОСИНТЕЗУ ГІСТИДИНУ, ТРИПТОФАНУ, ФЕНІЛАЛАНІНУ
ТА ТИРОЗИНУ (РОДИНА АРОМАТИЧНИХ АМІНОКИСЛОТ
Слайд 32БІОСИНТЕЗ
АМІНОКИСЛОТ
Важливою реакцією в син-тезі амінокислот з α-кето-кислот є реакція трансамі-нування,
Слайд 33
Т Р А Н С А М І Н У В
α-кетоглутарат
глутамат
α-кетокислоти
амінотрансферази
білки та
пептиди
специфічні
біосинтетичні шляхи
α-амінокислоти
основний
метаболізм
Слайд 35Біологічне значення трансамінування
Реакції трансамінування відіграють значну роль в обміні
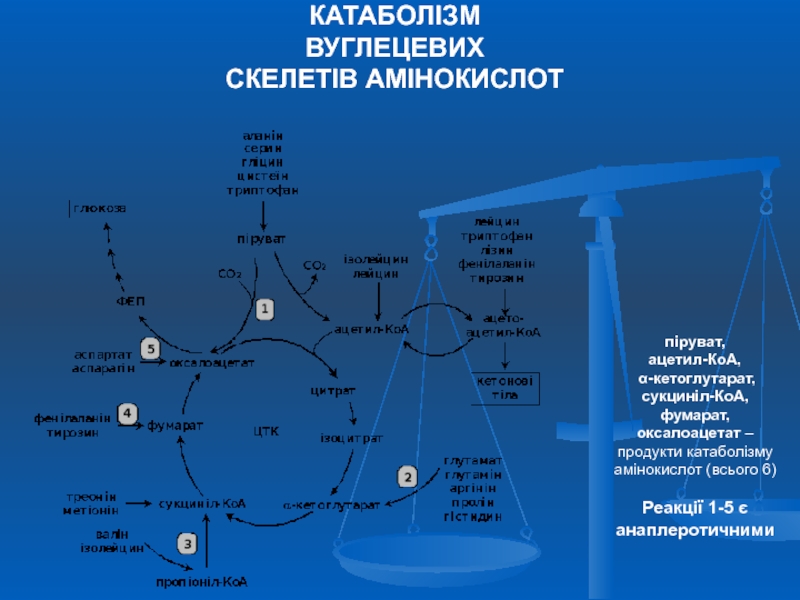
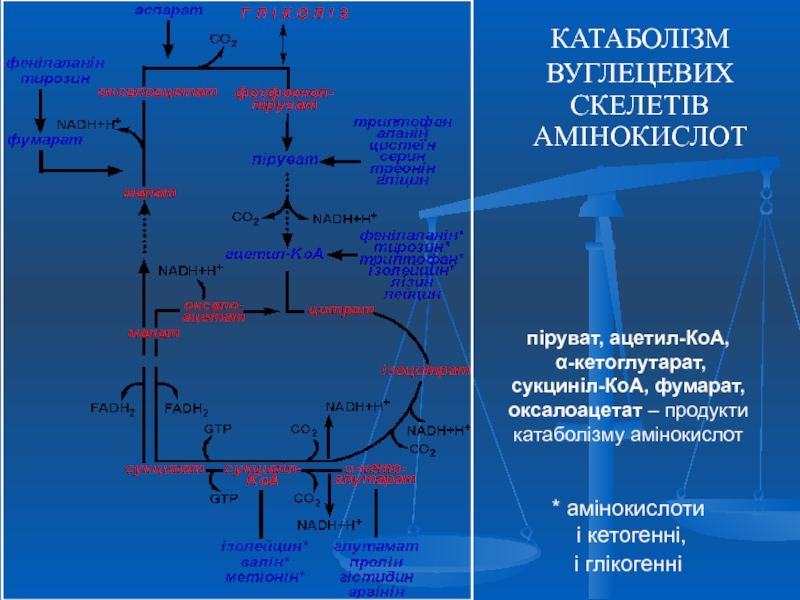
Слайд 36КАТАБОЛІЗМ
ВУГЛЕЦЕВИХ
СКЕЛЕТІВ АМІНОКИСЛОТ
піруват,
ацетил-КоА,
α-кетоглутарат,
сукциніл-КоА, фумарат, оксалоацетат –
Реакції 1-5 є анаплеротичними
Слайд 37 Амінокислоти, які перетворюються в піруват та проміжні продукти ЦТК
Деякі амінокислоти в процесі катаболізму перетворюються в ацетоацетат (Ліз, Лей) або ацетил-КоА (Лей) та можуть використовуватись в синтезі кетонових тіл - кетогенні (2).
Ряд амінокислот використовується і для синтезу глюкози, і для синтезу кетонових тіл, тому що в процесі їх катаболізму утворюються 2 продукти – певний метаболіт цитратного циклу та ацетоацетат (Три, Фен, Тир) або ацетил-КоА (Іле). Такі амінокислоти називають змішаними, або гліко-кетогенними(4) .
Слайд 38КАТАБОЛІЗМ
ВУГЛЕЦЕВИХ
СКЕЛЕТІВ АМІНОКИСЛОТ
піруват, ацетил-КоА,
α-кетоглутарат,
сукциніл-КоА, фумарат, оксалоацетат –
* амінокислоти
і кетогенні,
і глікогенні
Слайд 40Спадкові порушення катаболізму амінокислот
Фенілкетонурія.
Тирозиноз.
Алкаптонурія.
Альбінізм.
Хвороба Паркінсона.
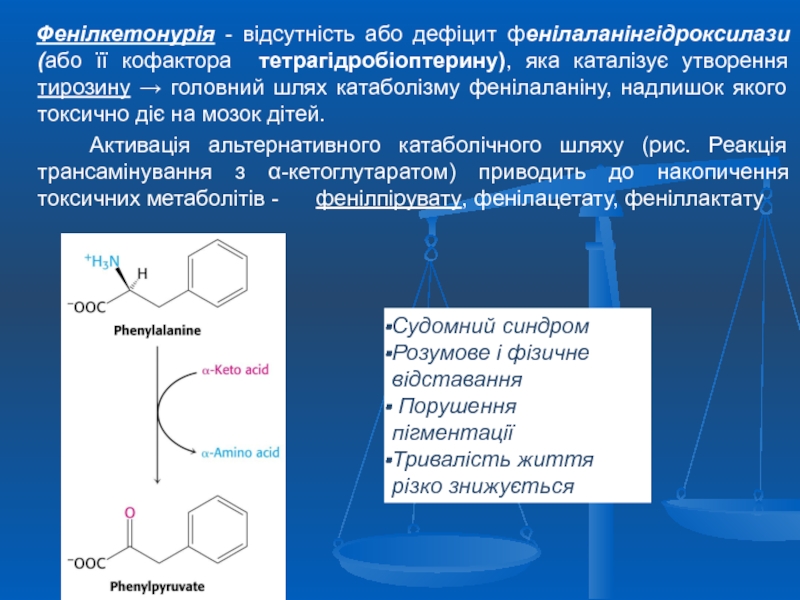
Слайд 41 Фенілкетонурія - відсутність або дефіцит фенілаланінгідроксилази (або її кофактора
Активація альтернативного катаболічного шляху (рис. Реакція трансамінування з α-кетоглутаратом) приводить до накопичення токсичних метаболітів - фенілпірувату, фенілацетату, феніллактату
Судомний синдром
Розумове і фізичне відставання
Порушення пігментації
Тривалість життя різко знижується
Слайд 42 Тирозиноз (тирозинемія I типу)
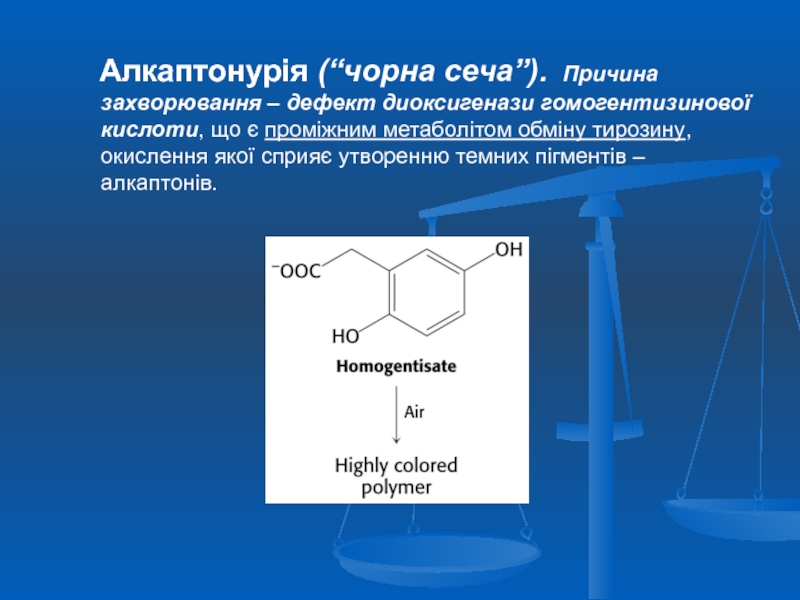
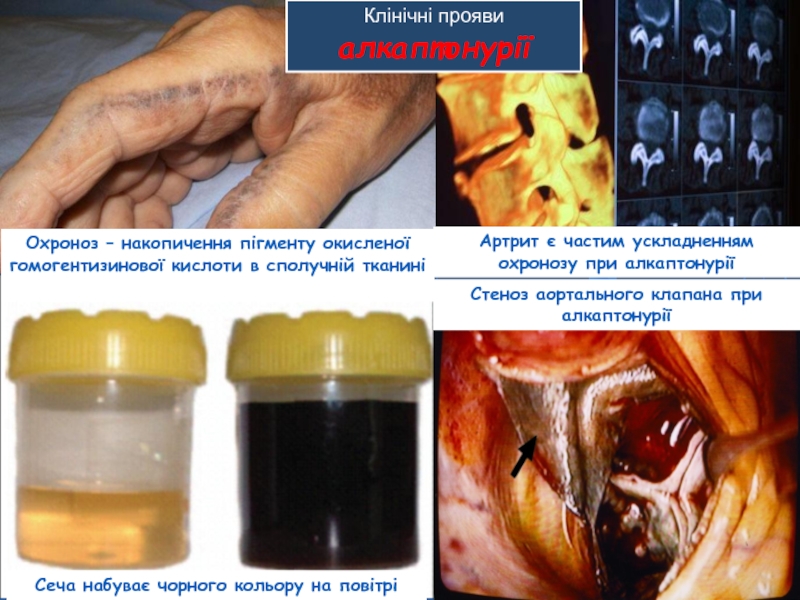
Слайд 43 Алкаптонурія (“чорна сеча”). Причина захворювання – дефект диоксигенази
Слайд 44Сеча набуває чорного кольору на повітрі
Клінічні прояви алкаптонурії
Стеноз аортального клапана при
Охроноз – накопичення пігменту окисленої гомогентизинової кислоти в сполучній тканині
Артрит є частим ускладненням охронозу при алкаптонурії
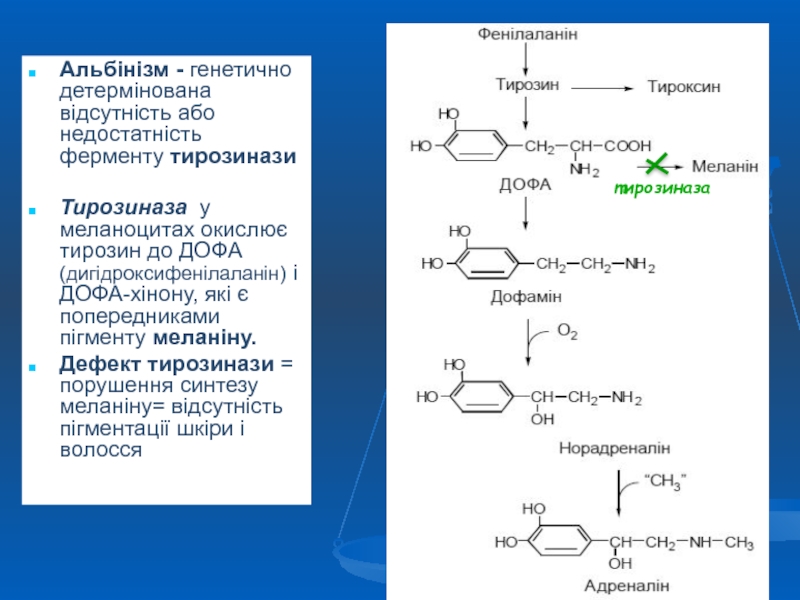
Слайд 45Альбінізм - генетично детермінована відсутність або недостатність ферменту тирозинази
Тирозиназа у меланоцитах
Дефект тирозинази = порушення синтезу меланіну= відсутність пігментації шкіри і волосся
Слайд 46Симптоми альбінізму:
відсутність пігментації шкіри і волосся за рахунок зниження продукції
висока чутливість до сонячного світла
підвищений ризик розвитку раку шкіри
сонячні опіки
фотофобія
зниження гостроти зору
частота захворювання на альбінізм становить 1 : 20000.
Слайд 47 Хвороба Паркінсона. Захворювання розвивається внаслідок нестачі дофаміну в чорній
Гіперсекреція дофаміну в скроневій частці мозку спостерігається під час шизофренії.
Слайд 48
Залежно від форми виведення амінного азоту різні види тварин можна
амоніотелічні тварини, амінний азот виводиться у вигляді вільного аміаку. Це – водні хребетні (костисті риби);
уреотелічні тварини, амінний азот виводиться у вигляді сечовини. Це – більшість наземних хребетних тварин.
урикотелічні тварини, амінний азот виводиться у вигляді сечової кислоти. Це – птахи, змії, ящірки.
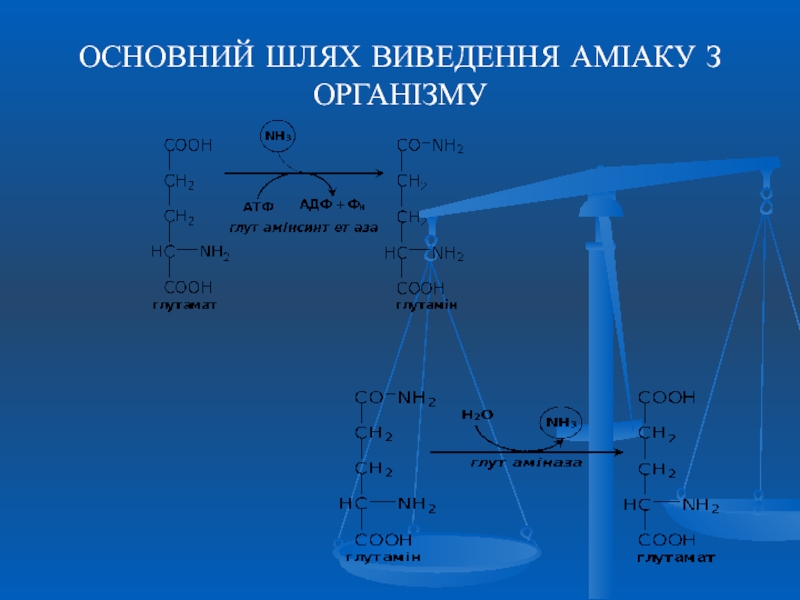
Аміак – токсична для організму речовина. Шляхи його виведення
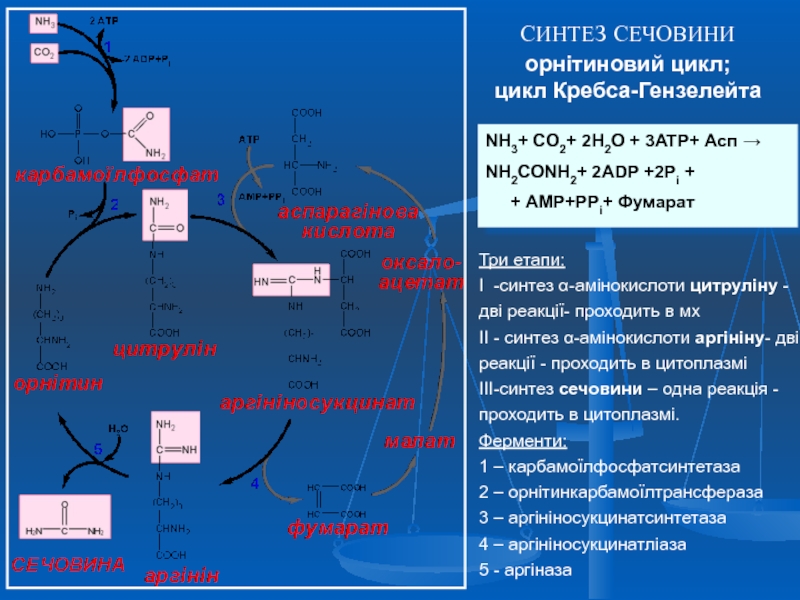
Слайд 50СИНТЕЗ СЕЧОВИНИ орнітиновий цикл;
цикл Кребса-Гензелейта
NH3+ CO2+ 2H2O + 3ATP+ Асп →
+ АМР+PPi+ Фумарат
Три етапи:
I -синтез α-амінокислоти цитруліну - дві реакції- проходить в мх
II - синтез α-амінокислоти аргініну- дві реакції - проходить в цитоплазмі
III-синтез сечовини – одна реакція - проходить в цитоплазмі.
Ферменти:
1 – карбамоїлфосфатсинтетаза
2 – орнітинкарбамоїлтрансфераза
3 – аргініносукцинатсинтетаза
4 – аргініносукцинатліаза
5 - аргіназа