ДЭС. Термодинамика ДЭС.
3. Уравнение Нернста.
4. Электроды сравнения.
5. Измерение величины электродных потенциалов. Гальванические цепи.
6. Электроды определения.
7. Окислительно-восстановительные электроды.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 8. Электрохимия презентация
Содержание
- 1. Лекция 8. Электрохимия
- 2. Электродный потенциал Электрохимия устанавливает механизмы процессов и
- 3. Электродным потенциалом (E) называют максимальную разность
- 4. Электродный потенциал Механизмы возникновения электродного потенциала
- 5. Электродный потенциал Возможны 2 случая возникновения потенциала
- 6. На электроде протекает процесс:
- 7. Электродный потенциал 2) При погружении неактивного металла
- 8. Поэтому часть ионов меди переходит из
- 9. Электродный потенциал Существуют и другие механизмы возникновения
- 10. Таким образом, ДЭС может формироваться за
- 11. Электродный потенциал Схему электрода изображают в виде
- 12. Строение ДЭС. Термодинамика ДЭС ДЭС можно сравнить
- 13. Подвижную часть ДЭС можно разделить на
- 14. Строение ДЭС. Термодинамика ДЭС Схема ДЭС
- 15. Строение ДЭС. Термодинамика ДЭС От величины электродного
- 16. Строение ДЭС. Термодинамика ДЭС
- 17. Уравнение Нернста Величину электродного потенциала можно рассчитать
- 18. Если потенциалопределяющими ионами являются катионы, то
- 19. Уравнение Нернста
- 20. При 180 С
- 21. Измерение величины электродных потенциалов. Гальванические цепи. Электродный
- 22. Для определения стандартных элек-тродных потенциалов металлов
- 23. Измерение величины электродных потенциалов. Гальванические цепи Нормальный
- 24. Измерение величины электродных потенциалов. Гальванические цепи Его
- 25. Для измерения стандартных электродных потенциалов металлов
- 26. Измерение величины электродных потенциалов. Гальванические цепи Схему
- 27. ЭДС всегда величина положи-тельная, т.е. при
- 28. Например цепь с медным электродом:
- 29. Водородный электрод сложен по конструкции и
- 30. Хлорсеребряный электрод (ХСЭ) сравнения представляет собой
- 31. Зависимость электродного потенциала от активности хлорид-ионов
- 32. Электроды определения (мембранные электроды)
- 33. Наиболее распространенным электродом определения является стеклянный
- 34. Стеклянный электрод перед использованием вымачивают не
- 35. При помещении стеклянного электрода в раствор
- 36. Ионоселективные электроды В последние годы ионоселективные
- 37. . В настоящее время число ионоселективных
- 38. Окислительно-восстановительные электроды Раствор, содержащий одновременно окисленную
- 39. Окислительно-восстановительные электроды Инертный металл выполняет
- 40. Окислительно-восстановительные электроды Например:
- 41. Окислительно-восстановительные электроды В осуществлении электродной реакции
- 42. Окислительно-восстановительные электроды Таким образом, в уравнение
- 43. Направление окислительно-восстановительных процессов Окислительно-восстановительный процесс будет протекать
- 44. Направление окислительно-восстановительных процессов Таким образом, первая система
- 45. БЛАГОДАРЮ ЗА ВНИМАНИЕ !
Слайд 1ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 8. Электрохимия
1. Электродный потенциал.
2. Строение
Слайд 2Электродный потенциал
Электрохимия устанавливает механизмы процессов и явлений, протекающих на границе раздела
фаз с участием заряженных частиц, в том числе и электрические явления в живых организмах.
Слайд 3
Электродным потенциалом (E) называют максимальную разность потенциалов, возникающую на границе твердая
фаза – раствор в момент установления равновесия.
Слайд 4Электродный потенциал
Механизмы возникновения электродного потенциала
При погружении металла в раствор
его одноименной соли, в системе металл – раствор устанавливается равновесие:
Меn+ + ne- ↔ Ме0
Данная реакция называется электродной реакцией.
Ионы Меn+ – потенциалопределяющими ионами (п. о. и.).
Меn+ + ne- ↔ Ме0
Данная реакция называется электродной реакцией.
Ионы Меn+ – потенциалопределяющими ионами (п. о. и.).
Слайд 5Электродный потенциал
Возможны 2 случая возникновения потенциала в данных условиях:
1) При
погружении активного металла (Zn) в раствор его соли (ZnSO4) возникает электродный процесс:
Zn2+ + 2e- ↔ Zn0
Т.к. энергия гидратации (Eгидр.) ионов цинка больше, чем энергия связи (Eсв.) этих ионов в кристаллической решетке Eгидр. > Eсв , то
равновесие электродной реакции смещается вправо.
Zn2+ + 2e- ↔ Zn0
Т.к. энергия гидратации (Eгидр.) ионов цинка больше, чем энергия связи (Eсв.) этих ионов в кристаллической решетке Eгидр. > Eсв , то
равновесие электродной реакции смещается вправо.
Слайд 6
На электроде протекает процесс:
Zn0 – 2e- ↔ Zn2+
При
этом часть ионов цинка с поверхности металла переходит в раствор, поверхность металла заряжается отрицательно, а раствор положительно, то есть на границе твердая фаза – раствор формируется двойной электрический слой (ДЭС).
Слайд 7Электродный потенциал
2) При погружении неактивного металла (Cu) в раствор его соли
(CuSO4) равновесие электродной реакции смещается влево. На электроде протекает процесс:
Cu2+ + 2e- ↔ Cu0
В этом случае энергия связи поверхностных ионов в узлах кристаллической решетки больше энергии гидратации ионов меди:
Eсв.. > Eгидр.
Cu2+ + 2e- ↔ Cu0
В этом случае энергия связи поверхностных ионов в узлах кристаллической решетки больше энергии гидратации ионов меди:
Eсв.. > Eгидр.
Слайд 8
Поэтому часть ионов меди переходит из раствора на пластинку, заряжая ее
положительно, раствор при этом заряжается отрицательно;
На границе твердая фаза – раствор формируется ДЭС.
На границе твердая фаза – раствор формируется ДЭС.
Слайд 9Электродный потенциал
Существуют и другие механизмы возникновения ДЭС, например, процесс адсорбции адсорбата
на поверхности адсорбента.
При помещении твердой фазы – хлорида серебра AgCl – в раствор нитрата серебра AgNO3 на поверхности твердой фазы из раствора адсорбируются те ионы, которые входят в состав кристаллической решетки, а именно ионы Ag+.
При этом твердая фаза заряжается положительно, а раствор – отрицательно.
При помещении твердой фазы – хлорида серебра AgCl – в раствор нитрата серебра AgNO3 на поверхности твердой фазы из раствора адсорбируются те ионы, которые входят в состав кристаллической решетки, а именно ионы Ag+.
При этом твердая фаза заряжается положительно, а раствор – отрицательно.
Слайд 10
Таким образом, ДЭС может формироваться за счет различных механизмов, в основе
которых лежат реакции осаждения, ионизации, окисления-восстановления, адсорбции и др.
Слайд 11Электродный потенциал
Схему электрода изображают в виде вертикальной черты, которая разделяет твердую
и жидкую фазы.
Например, схема металлического электрода:
Me Меn+
тв. ф. ж. ф.
Схема цинкового электрода:
Zn Zn2+
Например, схема металлического электрода:
Me Меn+
тв. ф. ж. ф.
Схема цинкового электрода:
Zn Zn2+
Слайд 12Строение ДЭС. Термодинамика ДЭС
ДЭС можно сравнить с конденсатором, одна обкладка которого
– металл, другая – слой противоположно заряженных ионов.
На поверхности металла за счет электродных процессов возникает электрический заряд, который определяется потенциалопределяющими ионами (п.о.и.).
Эта часть ДЭС – неподвижная или стабильная.
На поверхности металла за счет электродных процессов возникает электрический заряд, который определяется потенциалопределяющими ионами (п.о.и.).
Эта часть ДЭС – неподвижная или стабильная.
Слайд 13
Подвижную часть ДЭС можно разделить на две части:
1) Адсорбционный
слой – состоит из противоионов, расположенных на расстоянии ионного радиуса от поверхности металла. На него действуют в основном электростатические силы притяжения.
2) Диффузный слой – состоит из ионов, расположенных на расстоянии большем, чем ионный радиус. Они свободно перемещаются в растворе, в основном за счет теплового движения.
2) Диффузный слой – состоит из ионов, расположенных на расстоянии большем, чем ионный радиус. Они свободно перемещаются в растворе, в основном за счет теплового движения.
Слайд 14Строение ДЭС. Термодинамика ДЭС
Схема ДЭС для пластинки с «-» зарядом
имеет вид:
- +
- +
- +
- +
- +
- +
тв. неподв. адс. диффузный
часть слой слой
- +
- +
- +
- +
- +
- +
тв. неподв. адс. диффузный
часть слой слой
Слайд 15Строение ДЭС. Термодинамика ДЭС
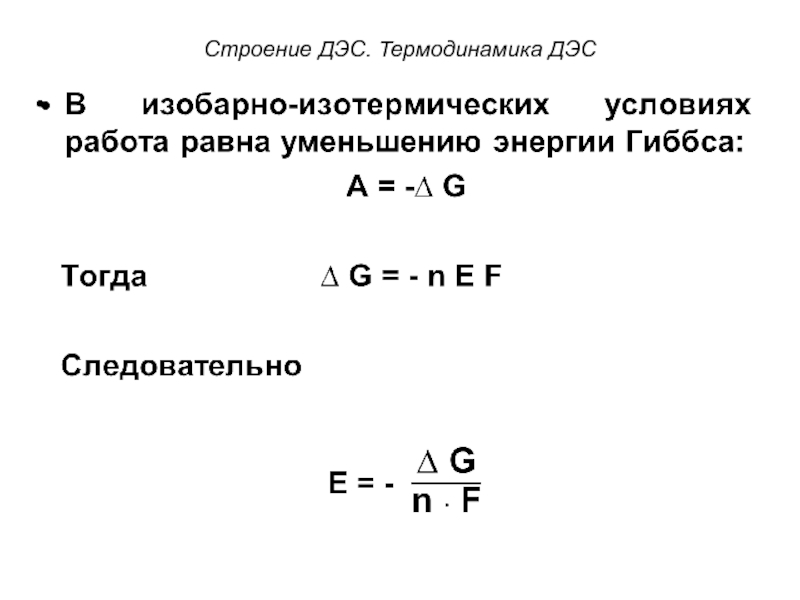
От величины электродного потенциала зависит величина работы, которая
совершается системой при образовании ДЭС. Величину этой работы можно выразить уравнением:
A = n E F [кДж ·моль-1], где
A – работа, которую надо совершить, чтобы перенести заряд с одной фазы на другую,
n – число электронов, участвующих в электродной реакции (для металлических электродов совпадает с зарядом иона),
F – число Фарадея = 96487 Кл · моль-1
A = n E F [кДж ·моль-1], где
A – работа, которую надо совершить, чтобы перенести заряд с одной фазы на другую,
n – число электронов, участвующих в электродной реакции (для металлических электродов совпадает с зарядом иона),
F – число Фарадея = 96487 Кл · моль-1
Слайд 17Уравнение Нернста
Величину электродного потенциала можно рассчитать по уравнению Нернста:
E
= E0 ± ln aкатион, анион.
E – электродный потенциал [В]
E0 – стандартный электродный потенциал [В]
R – универсальная газовая постоянная,
R =8,314 Дж· моль-1 · К-1
n – число электронов в электродной реакции
F – число Фарадея
а(п.о.и.) – активная концентрация потенциалопределяющих ионов [моль · дм-3]
E – электродный потенциал [В]
E0 – стандартный электродный потенциал [В]
R – универсальная газовая постоянная,
R =8,314 Дж· моль-1 · К-1
n – число электронов в электродной реакции
F – число Фарадея
а(п.о.и.) – активная концентрация потенциалопределяющих ионов [моль · дм-3]
Слайд 18
Если потенциалопределяющими ионами являются катионы, то в уравнении Нернста ставится знак
«+», если анионы – знак «-».
E = E0 ± ln aкат., ан.
При подстановке констант в выражение
и переводе натурального логарифма в десятичный (ln= 2,3 ·lg) , с учетом определенной температуры – уравнение Нернста принимает рабочий вид:
E = E0 ± ln aкат., ан.
При подстановке констант в выражение
и переводе натурального логарифма в десятичный (ln= 2,3 ·lg) , с учетом определенной температуры – уравнение Нернста принимает рабочий вид:
Слайд 20
При 180 С (291K) уравнение Нернста имеет вид:
E
= E0 ± lg aкат./анион.
Величина E0 –стандартный электродный потенциал - характеризует природу электрода.
E = E0, если a (п.о.и.) = 1 моль ·дм-3
Величина E0 –стандартный электродный потенциал - характеризует природу электрода.
E = E0, если a (п.о.и.) = 1 моль ·дм-3
Слайд 21Измерение величины электродных потенциалов. Гальванические цепи.
Электродный потенциал нельзя измерить непосредственно. Можно
измерять только разность потенциалов или электро-движущую силу (ЭДС).
Для этого необходимо собрать гальвани-ческую цепь из двух электродов.
Для этого необходимо собрать гальвани-ческую цепь из двух электродов.
Слайд 22
Для определения стандартных элек-тродных потенциалов металлов собирают гальваническую цепь из металлического
электрода и стан-дартного (нормального) водородного электрода, потенциал которого услов-но принят за 0 В .
E0H+/1/2 H2 = 0 В.
E0H+/1/2 H2 = 0 В.
Слайд 23Измерение величины электродных потенциалов. Гальванические цепи
Нормальный водородный электрод состоит из черненой
платиновой пластинки, насыщенной газообразным водородом при давлении 1 атм (101,3 кПа), и опущенной в раствор кислоты с активностью
a (Н+) = 1 моль·дм-3.
Схема нормального водородного электрода:
Pt (H2) H+
p (н2)= 1 атм a (н+) = 1 моль·дм-3
a (Н+) = 1 моль·дм-3.
Схема нормального водородного электрода:
Pt (H2) H+
p (н2)= 1 атм a (н+) = 1 моль·дм-3
Слайд 24Измерение величины электродных потенциалов. Гальванические цепи
Его электродная реакция:
H+ +
1e- ↔ 1/2 H20
Уравнение Нернста для нормального водородного электрода имеет вид:
EH+/1/2H2 = E0H+/1/2H2 + lg aH+.
Так как E0H+/1/2H2 = 0 В, тогда
EH+/1/2H2 = 0,059 lg aH+.
Так как pH = - lg aH+, тогда
EH+/1/2H2 = - 0,059pH
Уравнение Нернста для нормального водородного электрода имеет вид:
EH+/1/2H2 = E0H+/1/2H2 + lg aH+.
Так как E0H+/1/2H2 = 0 В, тогда
EH+/1/2H2 = 0,059 lg aH+.
Так как pH = - lg aH+, тогда
EH+/1/2H2 = - 0,059pH
Слайд 25
Для измерения стандартных электродных потенциалов металлов собирают гальваническую цепь, состоящую из
исследуемого электрода и стандартного водородного электрода.
Измеренные стандартные электродные потенциалы позволяют расположить металлы в порядке снижения их активности в электрохимический ряд напряжений металлов.
Измеренные стандартные электродные потенциалы позволяют расположить металлы в порядке снижения их активности в электрохимический ряд напряжений металлов.
Слайд 26Измерение величины электродных потенциалов. Гальванические цепи
Схему гальванической цепи записывают следующим образом:
тв1 ж1 ж2 тв2
E1 E2
При этом учитывается правило правого плюса:
справа записывают более положительный электрод (катод), слева – более отрица-тельный (анод).
На катоде происходит процесс восстановления, на аноде – окисления.
E1 E2
При этом учитывается правило правого плюса:
справа записывают более положительный электрод (катод), слева – более отрица-тельный (анод).
На катоде происходит процесс восстановления, на аноде – окисления.
Слайд 27
ЭДС всегда величина положи-тельная, т.е. при ее расчете необхо-димо из более
положительного значения электродного потенциала вычитать значение более отрицательного потенциала
ЭДС = E2 – E1 [ В ]
ЭДС = E2 – E1 [ В ]
Слайд 28
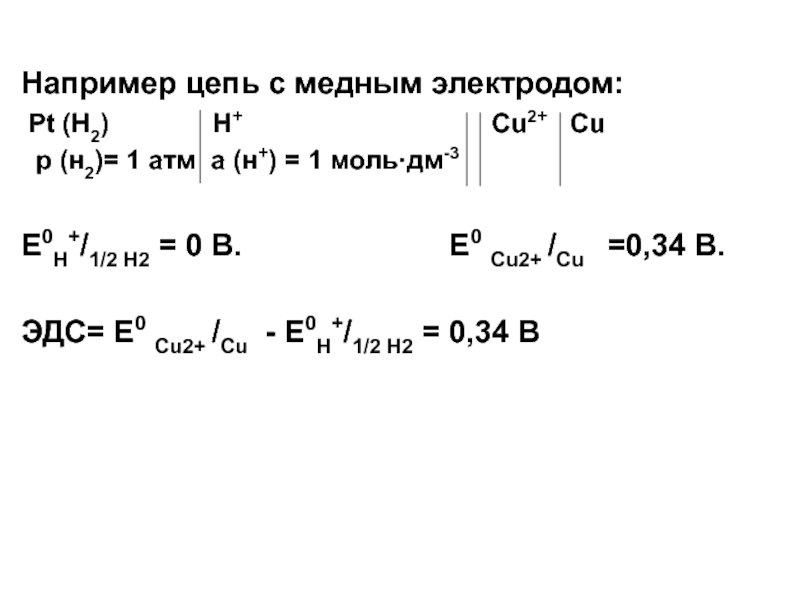
Например цепь с медным электродом:
Pt (H2)
H+ Cu2+ Cu
p (н2)= 1 атм a (н+) = 1 моль·дм-3
E0H+/1/2 H2 = 0 В. E0 Cu2+ /Cu =0,34 В.
ЭДС= E0 Cu2+ /Cu - E0H+/1/2 H2 = 0,34 В
p (н2)= 1 атм a (н+) = 1 моль·дм-3
E0H+/1/2 H2 = 0 В. E0 Cu2+ /Cu =0,34 В.
ЭДС= E0 Cu2+ /Cu - E0H+/1/2 H2 = 0,34 В
Слайд 29
Водородный электрод сложен по конструкции и его потенциал зависит от трудно
контролируемых факторов.
Поэтому на практике применяют более простые электроды, потенциалы которых известны, постоянны и воспроизводимы.
Такие электроды называют электродами сравнения.
В медико-биологических исследованиях в качестве электрода сравнения широко используют хлорсеребряный электрод.
Поэтому на практике применяют более простые электроды, потенциалы которых известны, постоянны и воспроизводимы.
Такие электроды называют электродами сравнения.
В медико-биологических исследованиях в качестве электрода сравнения широко используют хлорсеребряный электрод.
Слайд 30
Хлорсеребряный электрод (ХСЭ) сравнения представляет собой серебряную проволоку, покрытую слоем хлорида
серебра и опущенную в насыщенный раствор хлорида калия.
Ag AgCl
КCl (нас.)
На границе раздела металл-раствор протекает окислительно-восстановительная реакция:
AgCl + e- ↔ Ag0 + Cl-
Ag AgCl
КCl (нас.)
На границе раздела металл-раствор протекает окислительно-восстановительная реакция:
AgCl + e- ↔ Ag0 + Cl-
Слайд 31
Зависимость электродного потенциала от активности хлорид-ионов описывается уравнением Нернста:
Eх.с. =
E0х.с. - ln a (Cl-)
При 298 К потенциал хлорсеребряного электрода равен
Eх.с. = 0,222 В
При 298 К потенциал хлорсеребряного электрода равен
Eх.с. = 0,222 В
Слайд 32
Электроды определения
(мембранные электроды)
В электрохимических измерениях наряду с электродами сравнения
широко используются электроды определения или мембранные электроды.
Основные требования, предъявляемые к этим электродам -специфичность, селективность, высокая чувствительность к концентрации определенных ионов.
Основные требования, предъявляемые к этим электродам -специфичность, селективность, высокая чувствительность к концентрации определенных ионов.
Слайд 33
Наиболее распространенным электродом определения является стеклянный электрод.
Он состоит из стеклянной
трубки, заканчивающейся шариком из специального стекла. Внутрь этой системы наливают буферный раствор и для токоотвода помещают хлорсеребряный электрод ( см. Ю.А. Ершов, Общая химия, стр.477 ).
Потенциал, возникающий на хлорсеребряном электроде остается постоянным и не влияет на потенциал, возникающий между поверхностью стекла и исследуемым раствором.
Потенциал, возникающий на хлорсеребряном электроде остается постоянным и не влияет на потенциал, возникающий между поверхностью стекла и исследуемым раствором.
Слайд 34
Стеклянный электрод перед использованием вымачивают не менее суток в дистиллированной воде
или слабом растворе НСI.
Набухшая стеклянная плёнка представляет собой твёрдый буферный раствор кремниевой кислоты и её солей.
Концентрацию ионов водорода в стекле можно считать постоянной, а уравнение Нернста для стеклянного электрода:
Ест=Е0ст+0,059 Iga H+ ,или
Ест=Е°ст-0,059рН
Набухшая стеклянная плёнка представляет собой твёрдый буферный раствор кремниевой кислоты и её солей.
Концентрацию ионов водорода в стекле можно считать постоянной, а уравнение Нернста для стеклянного электрода:
Ест=Е0ст+0,059 Iga H+ ,или
Ест=Е°ст-0,059рН
Слайд 35
При помещении стеклянного электрода в раствор в поверхностный слой стекла из
раствора интенсивно проникают ионы водорода, вытесняя ионы Nа+ или Li+ , содержащиеся в стекле.
Ионы водорода распределяются между стеклом и раствором и на границе раздела фаз возникает разность потенциалов.
Т. к. переход ионов водорода в стекло зависит от концентрации их в растворе, то потенциал стеклянного электрода зависит от рН раствора.
Ионы водорода распределяются между стеклом и раствором и на границе раздела фаз возникает разность потенциалов.
Т. к. переход ионов водорода в стекло зависит от концентрации их в растворе, то потенциал стеклянного электрода зависит от рН раствора.
Слайд 36
Ионоселективные электроды
В последние годы ионоселективные электроды приобретают особо важное значение для
медицины.
Это электроды, проявляющие селективное действие относительно тех или иных ионов.
В медицине с их помощью стало возможным наблюдать за изменением ионного состава биологических жидкостей в динамике, а также получать информацию о внутриклеточном изменении концентрации ионов Na+, К+, Сa2+, СI- и т.д.
Это электроды, проявляющие селективное действие относительно тех или иных ионов.
В медицине с их помощью стало возможным наблюдать за изменением ионного состава биологических жидкостей в динамике, а также получать информацию о внутриклеточном изменении концентрации ионов Na+, К+, Сa2+, СI- и т.д.
Слайд 37
. В настоящее время число ионоселективных электродов с четко выраженной селективностью
к определенным ионам составляет более 20, например калиевый электрод, натриевый электрод и др..
Слайд 38Окислительно-восстановительные электроды
Раствор, содержащий одновременно окисленную и восстановленную формы вещества, называют окислительно-восстановительной
системой (red–ox) системой.
Инертный токопроводящий металл (например, платина или иридий), погруженный в red–ox систему, образует red–ox–электрод.
Схема red–ox–электрода:
ox (окисленная форма)
Pt
red (восстановленная форма)
Электродная реакция:
Инертный токопроводящий металл (например, платина или иридий), погруженный в red–ox систему, образует red–ox–электрод.
Схема red–ox–электрода:
ox (окисленная форма)
Pt
red (восстановленная форма)
Электродная реакция:
ox + n e- red
Слайд 39Окислительно-восстановительные электроды
Инертный металл выполняет роль посредника в осуществлении переноса электронов
между окисленной и восстановленной формами вещества, являясь донором или акцептором электронов (донором – по отношению к окисленной форме, акцептором – по отношению к восстановленной форме).
Red–ox–электроды делятся на простые и сложные.
В простых электродах для осуществления электродной реакции ox и red формы обмениваются только электронами.
Red–ox–электроды делятся на простые и сложные.
В простых электродах для осуществления электродной реакции ox и red формы обмениваются только электронами.
Слайд 40Окислительно-восстановительные электроды
Например:
[Fe (CN)6]3-
Pt
[Fe (CN)6]4-
Электродная реакция:
[Fe (CN)6]3- + 1e- [Fe (CN)6]4-
Уравнение Нернста-Петерса:
E = E0 + lg
Электродная реакция:
[Fe (CN)6]3- + 1e- [Fe (CN)6]4-
Уравнение Нернста-Петерса:
E = E0 + lg
Слайд 41Окислительно-восстановительные электроды
В осуществлении электродной реакции в сложных электродах помимо окисленной и
восстановленной форм принимают участие ионы среды (H+ или OH-).
Схема сложного электрода:
MnO4-, H+
Pt
Mn2+
Уравнение Нернста-Петерса для сложного электрода:
Схема сложного электрода:
MnO4-, H+
Pt
Mn2+
Уравнение Нернста-Петерса для сложного электрода:
Слайд 42Окислительно-восстановительные электроды
Таким образом, в уравнение Нернста-Петерса для сложного red–ox электрода, помимо
концентраций окисленной и восстановленной форм, входит концентрация ионов среды.
Слайд 43Направление окислительно-восстановительных процессов
Окислительно-восстановительный процесс будет протекать в нужном направлении при условии,
что разность электродных потенциалов будет положительной.
Например:
Сd2+ + 2e- Cd0,
IO3- + 6H+ + 6e- I- + 3Н2О,
Чем выше значение стандартного электродного потенциала Е0, тем выше у данной полупары окислительная способность, т.е. на этом электроде будет протекать процесс восстановления (+ е-). На электроде с более отрицательным значением Е0 протекает процесс окисления (- е-). У такой полупары выше восстановительная способность.
Например:
Сd2+ + 2e- Cd0,
IO3- + 6H+ + 6e- I- + 3Н2О,
Чем выше значение стандартного электродного потенциала Е0, тем выше у данной полупары окислительная способность, т.е. на этом электроде будет протекать процесс восстановления (+ е-). На электроде с более отрицательным значением Е0 протекает процесс окисления (- е-). У такой полупары выше восстановительная способность.
Слайд 44Направление окислительно-восстановительных процессов
Таким образом, первая система является системой восстановителя. На этом
электроде будет протекать процесс отдачи электронов (процесс окисления).
Cd0 - 2e- Сd2+
Вторая система – система окислителя. На этом электроде будет протекать процесс присоединения электронов (процесс восстановления)
Cd0 - 2e- Сd2+
Вторая система – система окислителя. На этом электроде будет протекать процесс присоединения электронов (процесс восстановления)





































![Окислительно-восстановительные электроды Например: [Fe (CN)6]3-Pt [Fe (CN)6]4-Электродная реакция:[Fe (CN)6]3-](/img/tmb/4/347775/e1afe8d9d98c8cf66ac323e88ee1850a-800x.jpg)










