- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Клинические исследования и регистрация лекарственных препаратов в России презентация
Содержание
- 1. Клинические исследования и регистрация лекарственных препаратов в России
- 2. Закон «Об обращении лекарственных средств» До
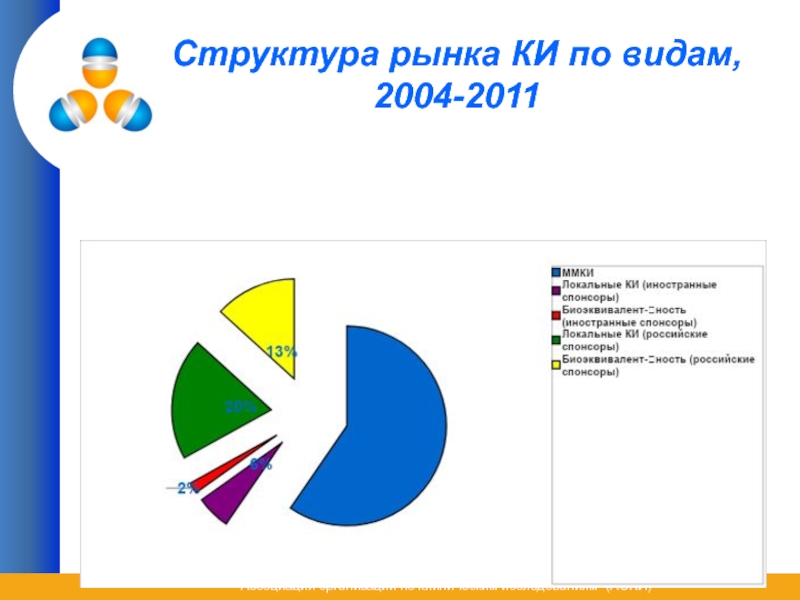
- 3. Система регистрации в России Особенность: Клинические
- 4. Система регистрации в России
- 5. Возможность проведения различных типов клинических исследований в
- 6. Система регистрации в России – требование о
- 7. Динамика выданных разрешений на клинические исследования, 2004-2012
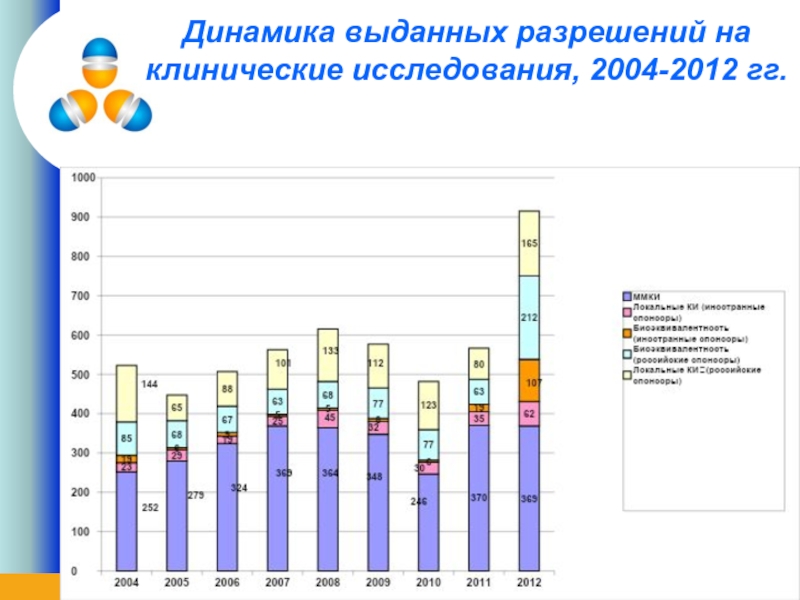
- 8. Динамика выданных разрешений на клинические исследования, 2004-2012 гг.
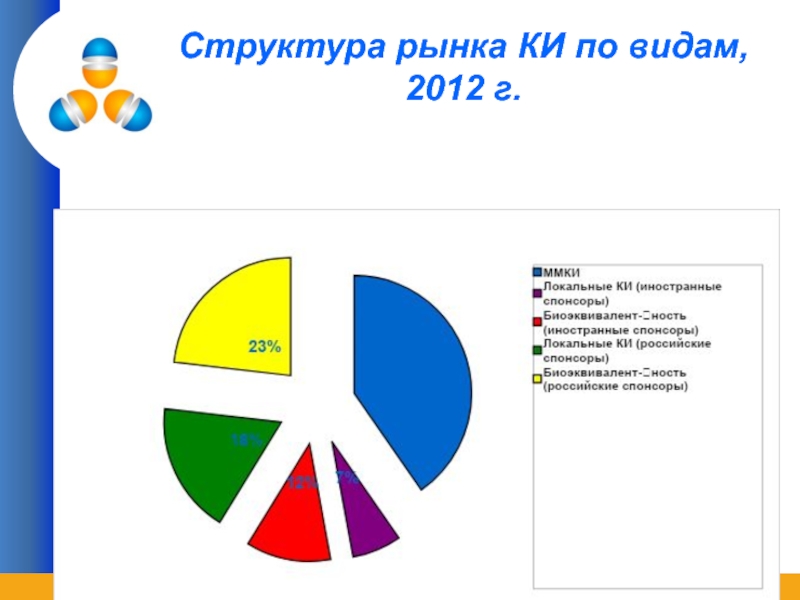
- 10. Структура рынка КИ по видам, 2012 г.
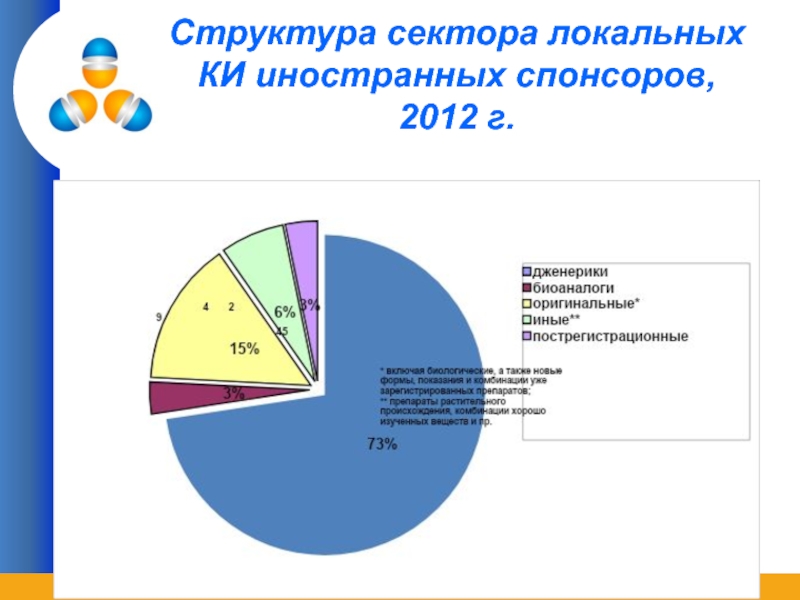
- 11. Структура сектора локальных КИ иностранных спонсоров, 2012 г.
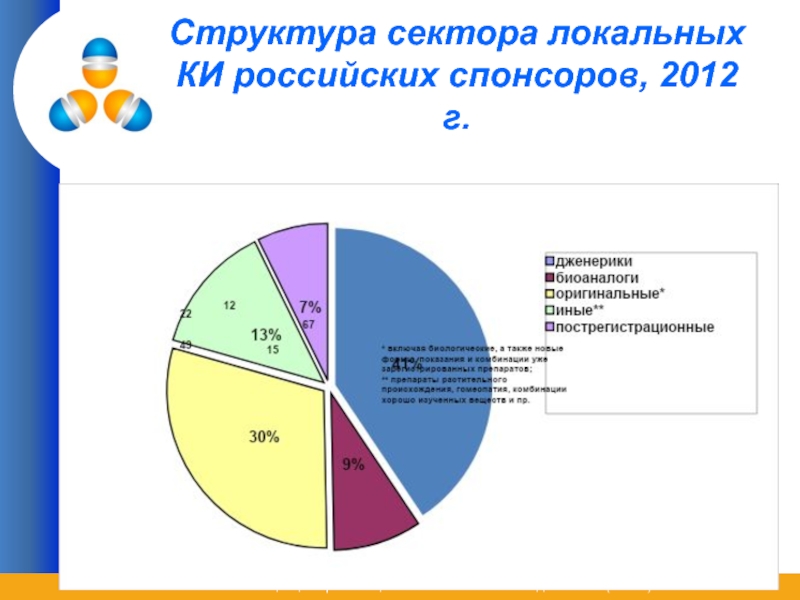
- 12. Структура сектора локальных КИ российских спонсоров, 2012 г.
- 13. Закон «Об обращении лекарственных средств», часть 3
Слайд 2Закон «Об обращении лекарственных средств»
До
Схема регистрации в целом соответствовала международному
подходу
После
Создана уникальная система регистрации, не имеющая аналогов в мире
Вступил в силу 01 сентября 2010 г.
Слайд 3Система регистрации в России
Особенность:
Клинические исследования включены в процесс регистрации, назначаются и
проводятся после подачи заявки на регистрацию и формирования регистрационного досье
Слайд 5Возможность проведения различных типов клинических исследований в России
Регистрационные - назначаются и
проводятся в рамках процесса регистрации;
Международные многоцентровые клинические исследования (ММКИ) и пострегистрационные КИ - проводятся независимо по самостоятельной процедуре
Международные многоцентровые клинические исследования (ММКИ) и пострегистрационные КИ - проводятся независимо по самостоятельной процедуре
Слайд 6Система регистрации в России – требование о проведении локальных исследований
Результаты ММКИ
не признаются (за исключением случаев, когда в них участвовали российские центры);
Производители вынуждены проводить повторные исследования в участием представителей «российской популяции»;
Норма относится не только к оригинальным препаратам, но и к дженерикам
Производители вынуждены проводить повторные исследования в участием представителей «российской популяции»;
Норма относится не только к оригинальным препаратам, но и к дженерикам
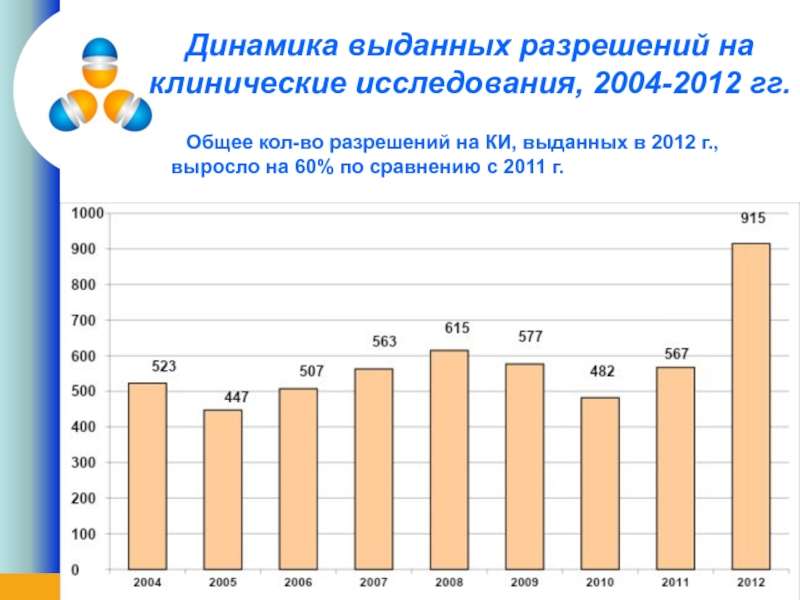
Слайд 7Динамика выданных разрешений на клинические исследования, 2004-2012 гг.
Общее кол-во разрешений
на КИ, выданных в 2012 г., выросло на 60% по сравнению с 2011 г.
Слайд 13Закон «Об обращении лекарственных средств»,
часть 3 статьи 5
«В Российской Федерации
в соответствии с международными договорами Российской Федерации и (или) на основе принципа взаимности признаются результаты клинических исследований лекарственных препаратов для медицинского применения, проведенных за пределами территории Российской Федерации.»