- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иммуноглобулины. Понятие об антителах презентация
Содержание
- 1. Иммуноглобулины. Понятие об антителах
- 2. Понятие об антителах АТ
- 3. Антителобразующие клетки Покоящийся лимфоцит Активирующийся лимфобласт Плазматическая клетка Апоптоз плазматической клетки
- 4. Типы иммуноглобулинов Иммуноглобулины: ∙
- 5. Молекулярное строение АТ Ig – гликопротеины.
- 6. Молекулярное строение АТ Легкие цепи: κ и
- 7. Молекулярное строение АТ Пепсин → два фрагмента:
- 8. Дополнительные полипептидные цепи Ig IgM, IgA –
- 9. Механизм взаимодействия АТ с АГ В процессе
- 10. Механизм взаимодействия АТ с АГ [АГ]+[АТ] ↔
- 11. Механизм взаимодействия АТ с АГ
- 12. Аффинность АТ Аффинность – прочность связи одного
- 13. Авидность АТ Авидность – прочность связывания АТ
- 14. Эффективность взаимодействия АГ и АТ Доступность эпитопа
- 15. Защитные механизмы гуморального иммунитета Cвязывание с АГ
- 16. Структурно-функциональные особенности иммуноглобулинов различных классов Молекулы, содержащие
- 17. Иммуноглобулин класса G IgG составляет 70 –
- 18. Иммуноглобулин класса G IgG синтезируется зрелыми B-лимфоцитами
- 19. Иммуноглобулин класса М IgМ – пентамер, 10
- 20. Иммуноглобулин класса М IgМ – высокая авидность,
- 21. Иммуноглобулин класса А Сывороточный IgА: около 15
- 22. Иммуноглобулин класса А Секреторный (sIgА): ди-, три-
- 23. Иммуноглобулин класса Е IgЕ – реагины –
- 24. Иммуноглобулин класса D IgD – 0,2 %
- 25. Рецепторные иммуноглобулины Рецепторные (мембранные) Ig локализуются на
- 26. Нормальные антитела Нормальные (естественные) АТ – базальный
- 27. Моноклональные антитела Каждый B-лимфоцит и его потомки
- 28. Полные и неполные антитела Полные АТ –
- 29. Генетика иммуноглобулинов Структура Ig контролируется большим числом
- 30. Динамика антителопродукции Первичный иммунный ответ: длительная
- 31. Формирование первичного и вторичного иммунного ответа (первичное воздействие) (повторное воздействие)
- 32. Теории разнообразия антител Теория «боковых цепей» П.
- 33. Теории разнообразия антител «Клонально-селекционная» теория Ф. Бернета.
- 34. Теории разнообразия антител Молекулярно-генетическая теория С. Тонегавы.
- 35. Теории разнообразия антител В 60-е годы П.Ф.
- 36. Источники разнообразия АТ ∙ Множественность гаметных генов
- 37. Иммунодиагностика инфекций Прямые методы: преципитация, агглютинация прямая
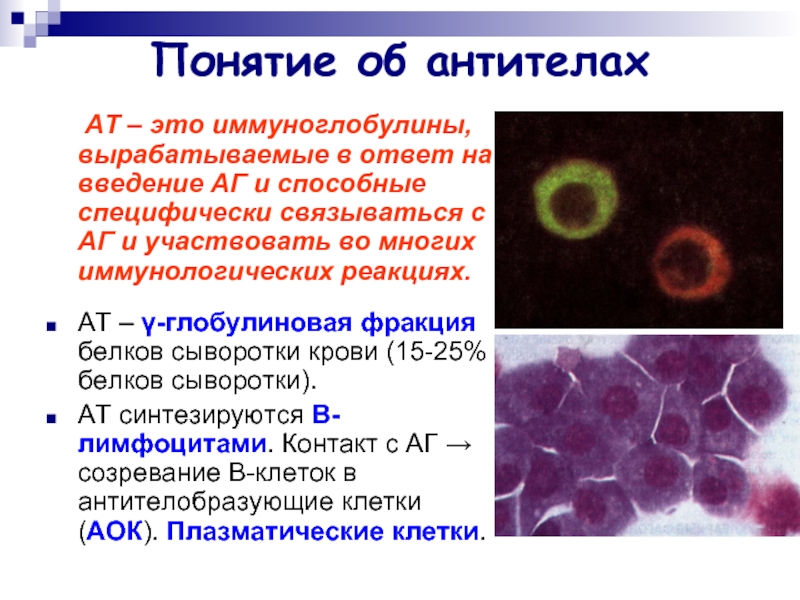
Слайд 2Понятие об антителах
АТ – это иммуноглобулины, вырабатываемые в
ответ на введение АГ и способные специфически связываться с АГ и участвовать во многих иммунологических реакциях.
АТ – γ-глобулиновая фракция белков сыворотки крови (15-25% белков сыворотки).
АТ синтезируются В-лимфоцитами. Контакт с АГ → созревание В-клеток в антителобразующие клетки (АОК). Плазматические клетки.
АТ – γ-глобулиновая фракция белков сыворотки крови (15-25% белков сыворотки).
АТ синтезируются В-лимфоцитами. Контакт с АГ → созревание В-клеток в антителобразующие клетки (АОК). Плазматические клетки.
Слайд 3Антителобразующие клетки
Покоящийся лимфоцит
Активирующийся лимфобласт
Плазматическая клетка
Апоптоз плазматической клетки
Слайд 4Типы иммуноглобулинов
Иммуноглобулины:
∙ циркулирующие АТ (сывороточные и секреторные);
∙ рецепторные молекулы на иммунных клетках;
∙ миеломные белки (белки Бенс-Джонса).
По структуре, антигенному составу и по выполняемым ими функциям Ig подразделяются на 5 классов: IgG, IgM, IgА, IgE, IgD.
Использование: диагностика, лечение, профилактика инфекционных и соматических болезней.
∙ миеломные белки (белки Бенс-Джонса).
По структуре, антигенному составу и по выполняемым ими функциям Ig подразделяются на 5 классов: IgG, IgM, IgА, IgE, IgD.
Использование: диагностика, лечение, профилактика инфекционных и соматических болезней.
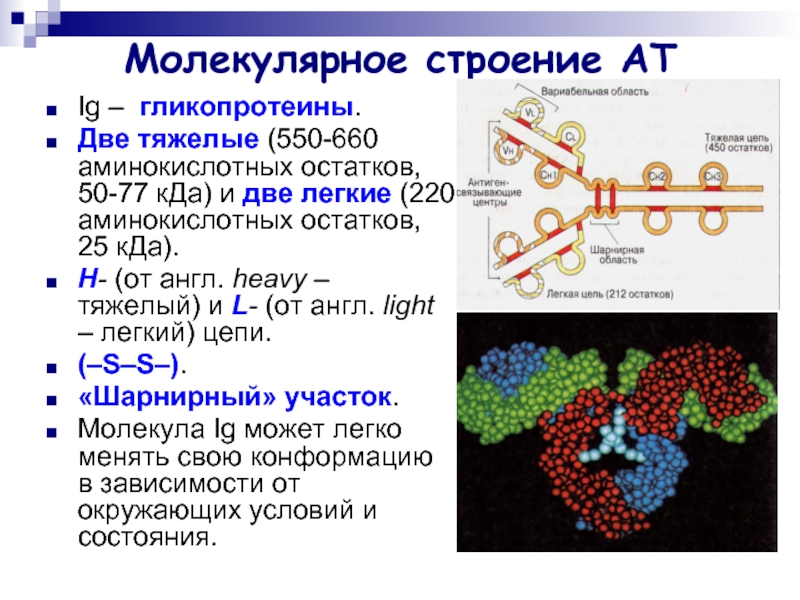
Слайд 5Молекулярное строение АТ
Ig – гликопротеины.
Две тяжелые (550-660 аминокислотных остатков, 50-77
кДа) и две легкие (220 аминокислотных остатков, 25 кДа).
Н- (от англ. heavy – тяжелый) и L- (от англ. light – легкий) цепи.
(–S–S–).
«Шарнирный» участок.
Молекула Ig может легко менять свою конформацию в зависимости от окружающих условий и состояния.
Н- (от англ. heavy – тяжелый) и L- (от англ. light – легкий) цепи.
(–S–S–).
«Шарнирный» участок.
Молекула Ig может легко менять свою конформацию в зависимости от окружающих условий и состояния.
Слайд 6Молекулярное строение АТ
Легкие цепи: κ и λ.
Тяжелые цепи: α, γ,
μ, ε и δ. Подтипы: α1- и α-2; γ1, γ2, γ3, γ4.
Вторичная структура – доменное строение: Н-цепи: 4-5, L-цепи: 2.
Домен – 110 аминокислотных остатков.
С-домены (от англ. constant – постоянный), и V-домены (от англ. variable – изменчивый). Легкая цепь: по одному V- и С-домену; тяжелая: один V- и 3-4 С-домена.
Вторичная структура – доменное строение: Н-цепи: 4-5, L-цепи: 2.
Домен – 110 аминокислотных остатков.
С-домены (от англ. constant – постоянный), и V-домены (от англ. variable – изменчивый). Легкая цепь: по одному V- и С-домену; тяжелая: один V- и 3-4 С-домена.
Гипервариабельная область – 25 % V-домена.
Антигенсвязывающий центр (паратоп).
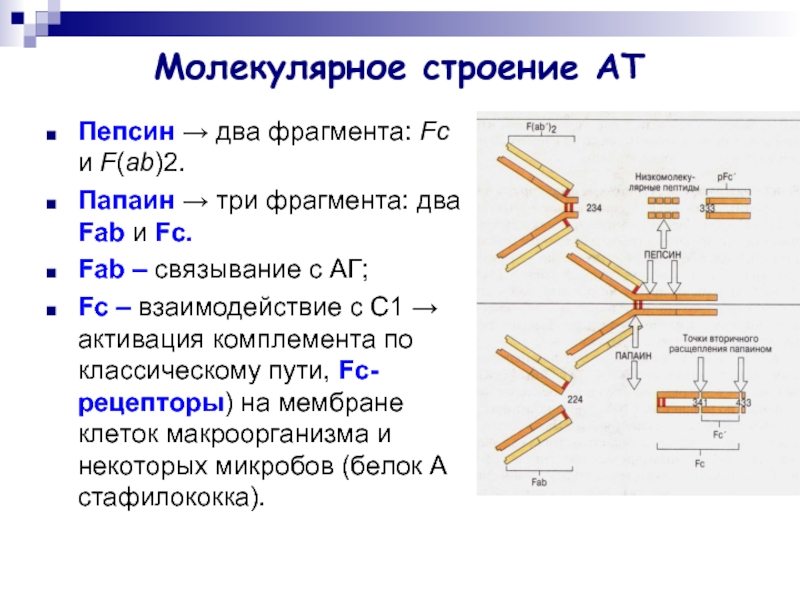
Слайд 7Молекулярное строение АТ
Пепсин → два фрагмента: Fc и F(ab)2.
Папаин → три
фрагмента: два Fab и Fc.
Fab – связывание с АГ;
Fc – взаимодействие с С1 → активация комплемента по классическому пути, Fc-рецепторы) на мембране клеток макроорганизма и некоторых микробов (белок А стафилококка).
Fab – связывание с АГ;
Fc – взаимодействие с С1 → активация комплемента по классическому пути, Fc-рецепторы) на мембране клеток макроорганизма и некоторых микробов (белок А стафилококка).
Слайд 8Дополнительные полипептидные цепи Ig
IgM, IgA – J-пептид (от англ. join –
соединяю).
Секреторные IgA – S-пептид (от англ. secret – секрет), секреторный компонент (71000, β-глобулин).
Рецепторный иммуноглобулин – М-пептид (от англ. membrane – мембрана).
J- и M-пептиды присоединяются к Ig в процессе биосинтеза. S-пептид синтезируется эпителиальными клетками и является их рецептором для IgA; присоединяется к молекуле IgA при его прохождении через эпителиальную клетку.
Секреторные IgA – S-пептид (от англ. secret – секрет), секреторный компонент (71000, β-глобулин).
Рецепторный иммуноглобулин – М-пептид (от англ. membrane – мембрана).
J- и M-пептиды присоединяются к Ig в процессе биосинтеза. S-пептид синтезируется эпителиальными клетками и является их рецептором для IgA; присоединяется к молекуле IgA при его прохождении через эпителиальную клетку.
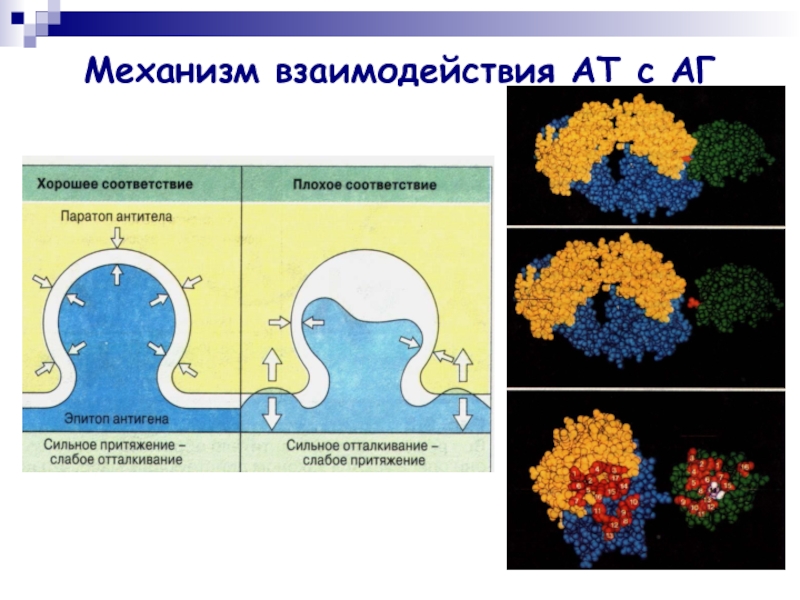
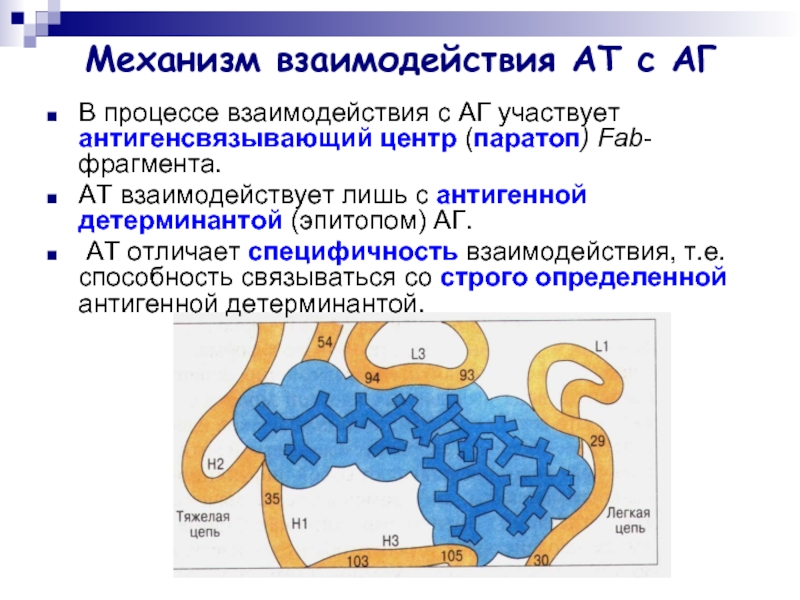
Слайд 9Механизм взаимодействия АТ с АГ
В процессе взаимодействия с АГ участвует антигенсвязывающий
центр (паратоп) Fab-фрагмента.
АТ взаимодействует лишь с антигенной детерминантой (эпитопом) АГ.
АТ отличает специфичность взаимодействия, т.е. способность связываться со строго определенной антигенной детерминантой.
АТ взаимодействует лишь с антигенной детерминантой (эпитопом) АГ.
АТ отличает специфичность взаимодействия, т.е. способность связываться со строго определенной антигенной детерминантой.
Слайд 10Механизм взаимодействия АТ с АГ
[АГ]+[АТ] ↔ [ИК]
Сила нековалентной связи зависит
прежде всего от расстояния между взаимодействующими химическими группами.
Слайд 12Аффинность АТ
Аффинность – прочность связи одного антигенсвязывающего центра с индивидуальным эпитопом
АГ.
Зависит от степени комплементарности антигенсвязывающего центра и эпитопа.
Наибольшим аффинитетом обладают МКА, наименьшим – нормальные АТ.
Аффинность антител повышается в процессе иммунного ответа в связи с селекцией наиболее специфичных клонов В-лимфоцитов.
Зависит от степени комплементарности антигенсвязывающего центра и эпитопа.
Наибольшим аффинитетом обладают МКА, наименьшим – нормальные АТ.
Аффинность антител повышается в процессе иммунного ответа в связи с селекцией наиболее специфичных клонов В-лимфоцитов.
Слайд 13Авидность АТ
Авидность – прочность связывания АТ и АГ (суммарная сила).
Определяется
аффинностью и числом антигенсвязывающих центров.
Поливалентность АГ и АТ существенно усиливает прочность их соединения, поскольку для диссоциации иммунных комплексов необходим разрыв сразу всех связей.
Поливалентность АГ и АТ существенно усиливает прочность их соединения, поскольку для диссоциации иммунных комплексов необходим разрыв сразу всех связей.
Слайд 14Эффективность взаимодействия АГ и АТ
Доступность эпитопа для антигенсвязывающего центра Ig, число
эпитопов в составе молекулы АГ.
Условия реакции.
Специфичность антисыворотки суммарно отражает
специфичность содержащихся в ней АТ.
Перекрестная реактивность: если АГ А имеет общие эпитопы с АГ В, часть АТ, специфичных к А, будет реагировать также и с В.
Условия реакции.
Специфичность антисыворотки суммарно отражает
специфичность содержащихся в ней АТ.
Перекрестная реактивность: если АГ А имеет общие эпитопы с АГ В, часть АТ, специфичных к А, будет реагировать также и с В.
Слайд 15Защитные механизмы гуморального иммунитета
Cвязывание с АГ :
∙ маркирование
АГ, инактивация биологически активных молекул (токсинов), опсонизация АГ, антителоопосредованный лизис клеток, иммунный фагоцитоз, ГНТ;
∙ функция антигенспецифического рецептора на поверхности В-лимфоцитов;
Эффекторные функции:
∙ связывание с различными клетками иммунной системы и компонентом комплемента С1q;
∙ инициация биологической активности клеток (фагоцитоз, зависимая от АТ клеточная цитотоксичность, высвобождение медиаторов и презентация АГ).
∙ функция антигенспецифического рецептора на поверхности В-лимфоцитов;
Эффекторные функции:
∙ связывание с различными клетками иммунной системы и компонентом комплемента С1q;
∙ инициация биологической активности клеток (фагоцитоз, зависимая от АТ клеточная цитотоксичность, высвобождение медиаторов и презентация АГ).
Слайд 16Структурно-функциональные особенности иммуноглобулинов различных классов
Молекулы, содержащие тяжелую цепь α-типа, относят к
изотипу А (сокращенно IgА), IgD обладает δ-цепью, IgЕ — ε-цепью, IgG— γ-цепью и IgМ — μ-цепью.
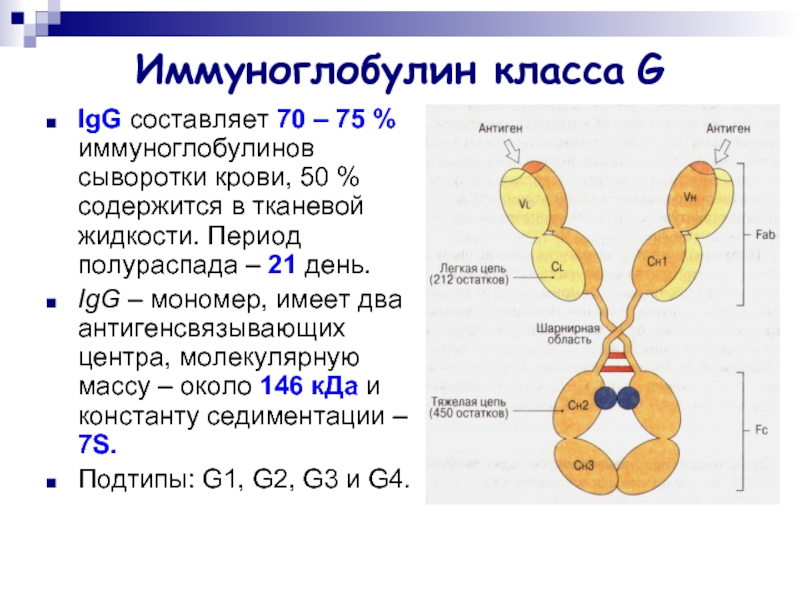
Слайд 17Иммуноглобулин класса G
IgG составляет 70 – 75 % иммуноглобулинов сыворотки крови,
50 % содержится в тканевой жидкости. Период полураспада – 21 день.
IgG – мономер, имеет два антигенсвязывающих центра, молекулярную массу – около 146 кДа и константу седиментации – 7S.
Подтипы: G1, G2, G3 и G4.
IgG – мономер, имеет два антигенсвязывающих центра, молекулярную массу – около 146 кДа и константу седиментации – 7S.
Подтипы: G1, G2, G3 и G4.
Слайд 18Иммуноглобулин класса G
IgG синтезируется зрелыми B-лимфоцитами (Вγ) и плазматическими клетками, хорошо
определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
IgG составляют большинство АТ вторичного иммунного ответа и антитоксинов.
IgG обладает высокой аффинностью, связывает комплемент, может быть неполным антителом.
IgG легко проходит через плацентарный барьер, способен выделяться в секрет слизистых оболочек путем диффузии.
Обнаружение высоких титров IgG к АГ конкретного возбудителя указывает на то, что организм находится на стадии реконвалесценции или инфекционное заболевание перенесено недавно.
IgG составляют большинство АТ вторичного иммунного ответа и антитоксинов.
IgG обладает высокой аффинностью, связывает комплемент, может быть неполным антителом.
IgG легко проходит через плацентарный барьер, способен выделяться в секрет слизистых оболочек путем диффузии.
Обнаружение высоких титров IgG к АГ конкретного возбудителя указывает на то, что организм находится на стадии реконвалесценции или инфекционное заболевание перенесено недавно.
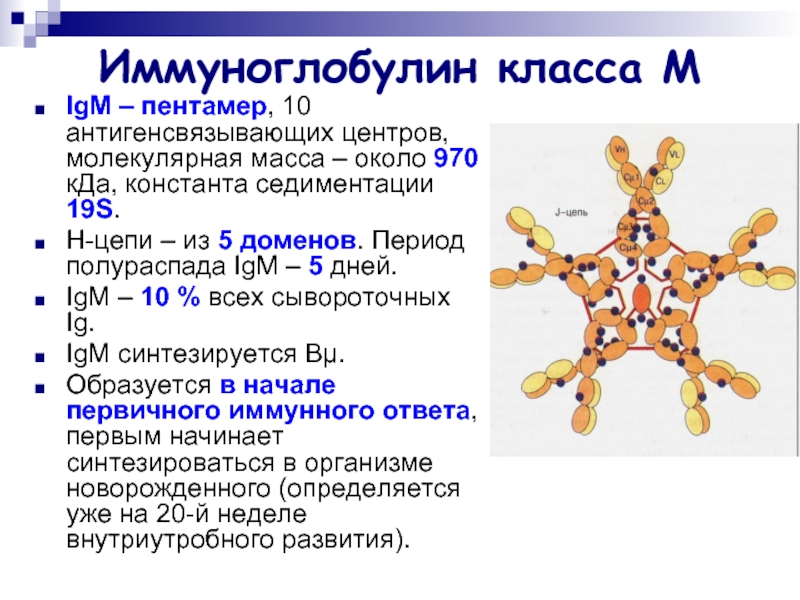
Слайд 19Иммуноглобулин класса М
IgМ – пентамер, 10 антигенсвязывающих центров, молекулярная масса –
около 970 кДа, константа седиментации 19S.
Н-цепи – из 5 доменов. Период полураспада IgМ – 5 дней.
IgМ – 10 % всех сывороточных Ig.
IgМ синтезируется Вμ.
Образуется в начале первичного иммунного ответа, первым начинает синтезироваться в организме новорожденного (определяется уже на 20-й неделе внутриутробного развития).
Н-цепи – из 5 доменов. Период полураспада IgМ – 5 дней.
IgМ – 10 % всех сывороточных Ig.
IgМ синтезируется Вμ.
Образуется в начале первичного иммунного ответа, первым начинает синтезироваться в организме новорожденного (определяется уже на 20-й неделе внутриутробного развития).
Слайд 20Иммуноглобулин класса М
IgМ – высокая авидность, связывает комплемент, сывороточный и секреторный
гуморальный иммунитет. Большая часть нормальных АТ и изоагглютининов относится к IgМ.
IgМ не проходит через плаценту. IgМ в сыворотке новорожденного → бывшая внутриутробная инфекция или дефект плаценты.
Наличие IgM к АГ конкретного возбудителя указывает на наличие острого инфекционного процесса.
IgМ не проходит через плаценту. IgМ в сыворотке новорожденного → бывшая внутриутробная инфекция или дефект плаценты.
Наличие IgM к АГ конкретного возбудителя указывает на наличие острого инфекционного процесса.
Слайд 21Иммуноглобулин класса А
Сывороточный IgА: около 15 – 20 % всех сывороточных
Ig. Период полураспада IgА – 6 дней.
IgА – мономер, два антигенсвязывающих центра, молекулярная масса около 160 кДа, константа седиментации 7S.
А1 и А2. IgА синтезируется зрелыми B-лимфоцитами (Вα) и плазматическими клетками. IgА хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
IgА обладает высокой аффинностью, может быть неполным АТ, не связывает комплемент, не проходит через плацентарный барьер.
IgА – мономер, два антигенсвязывающих центра, молекулярная масса около 160 кДа, константа седиментации 7S.
А1 и А2. IgА синтезируется зрелыми B-лимфоцитами (Вα) и плазматическими клетками. IgА хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
IgА обладает высокой аффинностью, может быть неполным АТ, не связывает комплемент, не проходит через плацентарный барьер.
Слайд 22Иммуноглобулин класса А
Секреторный (sIgА): ди-, три- или тетрамеры, содержит J- и
S-пептиды.
Молекулярная масса IgА 385 кДа и более, константа седиментации 11S и выше.
Секреторный IgА – основной фактор местного иммунитета слизистых оболочек ЖКТ, мочеполовой системы и респираторного тракта.
Секреторный IgА активирует комплемент и стимулирует фагоцитарную реакцию в слизистых оболочках.
Молекулярная масса IgА 385 кДа и более, константа седиментации 11S и выше.
Секреторный IgА – основной фактор местного иммунитета слизистых оболочек ЖКТ, мочеполовой системы и респираторного тракта.
Секреторный IgА активирует комплемент и стимулирует фагоцитарную реакцию в слизистых оболочках.
Слайд 23Иммуноглобулин класса Е
IgЕ – реагины – около 0,002 % всех циркулирующих
Ig, молекулярная масса около 188 кДа, константа седиментации примерно 8S. IgЕ — мономер. Тяжелые цепи IgЕ построены из 5 доменов.
IgЕ синтезируется зрелыми B-лимфоцитами (Вε) и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и ЖКТ. IgЕ не связывает комплемент, не проходит через плацентарный барьер.
IgЕ – цитофильность (тропность к тучным клеткам и базофилам) → аллергическая реакция I типа (анафилактическая).
Антигельминтозный иммунитет.
IgЕ синтезируется зрелыми B-лимфоцитами (Вε) и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и ЖКТ. IgЕ не связывает комплемент, не проходит через плацентарный барьер.
IgЕ – цитофильность (тропность к тучным клеткам и базофилам) → аллергическая реакция I типа (анафилактическая).
Антигельминтозный иммунитет.
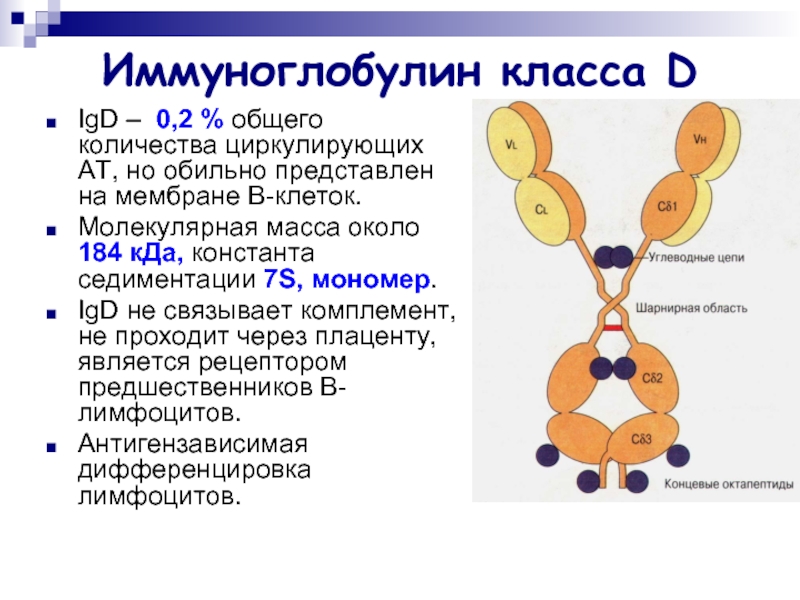
Слайд 24Иммуноглобулин класса D
IgD – 0,2 % общего количества циркулирующих АТ, но
обильно представлен на мембране В-клеток.
Молекулярная масса около 184 кДа, константа седиментации 7S, мономер.
IgD не связывает комплемент, не проходит через плаценту, является рецептором предшественников B-лимфоцитов.
Антигензависимая дифференцировка лимфоцитов.
Молекулярная масса около 184 кДа, константа седиментации 7S, мономер.
IgD не связывает комплемент, не проходит через плаценту, является рецептором предшественников B-лимфоцитов.
Антигензависимая дифференцировка лимфоцитов.
Слайд 25Рецепторные иммуноглобулины
Рецепторные (мембранные) Ig локализуются на ЦПМ B-лимфоцитов.
Антигенспецифические рецепторы.
Имеют
тот же изотип и специфичность, что и синтезируемые в межклеточную среду АТ.
M-пептид – фиксация в ЦПМ иммунокомпетентной клетки.
M-пептид – фиксация в ЦПМ иммунокомпетентной клетки.
Слайд 26Нормальные антитела
Нормальные (естественные) АТ – базальный уровень иммуноглобулинов.
Изогемагглютинины – АТ,
направленные против эритроцитарных АГ групп крови (система АВО), а также против бактерий кишечной группы, кокков и некоторых вирусов.
Нормальные АТ постоянно образуются в организме без явной антигенной стимуляции: отражают готовность макроорганизма к иммунному реагированию или свидетельствуют об отдаленном контакте с АГ.
Нормальные АТ постоянно образуются в организме без явной антигенной стимуляции: отражают готовность макроорганизма к иммунному реагированию или свидетельствуют об отдаленном контакте с АГ.
Слайд 27Моноклональные антитела
Каждый B-лимфоцит и его потомки (клон) → АТ строго определенной
специфичности – моноклинальные.
Д. Келлер и Ц. Мильштайн (1975) → гибридные клетки (слияние иммунных B-лимфоцитов с миеломной клеткой). Гибридомы: синтезировали АТ; были «бессмертны».
МКА широко применяются при создании диагностических и лечебных препаратов.
Д. Келлер и Ц. Мильштайн (1975) → гибридные клетки (слияние иммунных B-лимфоцитов с миеломной клеткой). Гибридомы: синтезировали АТ; были «бессмертны».
МКА широко применяются при создании диагностических и лечебных препаратов.
ГАТ:
гипоксантин,
аминоптерин,
тимидин
Слайд 28Полные и неполные антитела
Полные АТ – способны образовывать в РА или
РП хорошо различимую глазом макромолекулярную структуру гигантского иммунного комплекса. Полимерные молекулы IgМ, некоторые IgА и IgG.
Неполные антитела лишены такой способности несмотря на то, что они специфически связываются с АГ (непреципитирующие или блокирующие АТ).
Причины: экранирование или дефект второго антигенсвязывающего центра, недостаточное число или экранирование антигенных детерминант на молекуле АГ.
Выявление – реакция Кумбса (использование «вторых», антииммуноглобулиновых АТ).
Неполные антитела лишены такой способности несмотря на то, что они специфически связываются с АГ (непреципитирующие или блокирующие АТ).
Причины: экранирование или дефект второго антигенсвязывающего центра, недостаточное число или экранирование антигенных детерминант на молекуле АГ.
Выявление – реакция Кумбса (использование «вторых», антииммуноглобулиновых АТ).
Слайд 29Генетика иммуноглобулинов
Структура Ig контролируется большим числом генов, которые имеют фрагментарную организацию,
располагаются на 3 различных хромосомах и наследуются независимо.
При созревании B-лимфоцитов в их генетическом аппарате происходят произвольное сближение отдельных фрагментированных генов и сборка единых функциональных генов, которые кодируют всю молекулу Ig – сплайсинг (англ. splicing — сращивание).
В отдельных участках V-сегментов генов Ig наблюдается мутации – гипермутабельные области.
Дальнейшая дифференцировка В-лимфоцитов сопровождается рекомбинационными перестройками в пределах генов Ig → смена класса АТ.
При созревании B-лимфоцитов в их генетическом аппарате происходят произвольное сближение отдельных фрагментированных генов и сборка единых функциональных генов, которые кодируют всю молекулу Ig – сплайсинг (англ. splicing — сращивание).
В отдельных участках V-сегментов генов Ig наблюдается мутации – гипермутабельные области.
Дальнейшая дифференцировка В-лимфоцитов сопровождается рекомбинационными перестройками в пределах генов Ig → смена класса АТ.
Слайд 30Динамика антителопродукции
Первичный иммунный ответ: длительная латентная (3 – 5 сут)
и логарифмическая (7 – 15 сут) фазы. Первые диагностически титры АТ регистрируются на 10 – 14-е сутки. Стационарная фаза – 15 – 30 сут, а фаза снижения – 1 – 6 мес. B-лимфоциты иммунологической памяти, накапление специфических IgM→IgG, IgА.
Вторичный иммунный ответ: укороченная латентная фаза – от нескольких часов до 1 – 2 сут., более интенсивная логарифмическая фаза, более высокие титры АТ. Стационарная фаза и фаза снижения затяжные (несколько месяцев или даже лет). IgG.
Вторичный иммунный ответ: укороченная латентная фаза – от нескольких часов до 1 – 2 сут., более интенсивная логарифмическая фаза, более высокие титры АТ. Стационарная фаза и фаза снижения затяжные (несколько месяцев или даже лет). IgG.
Слайд 31Формирование первичного и вторичного иммунного ответа
(первичное воздействие)
(повторное воздействие)
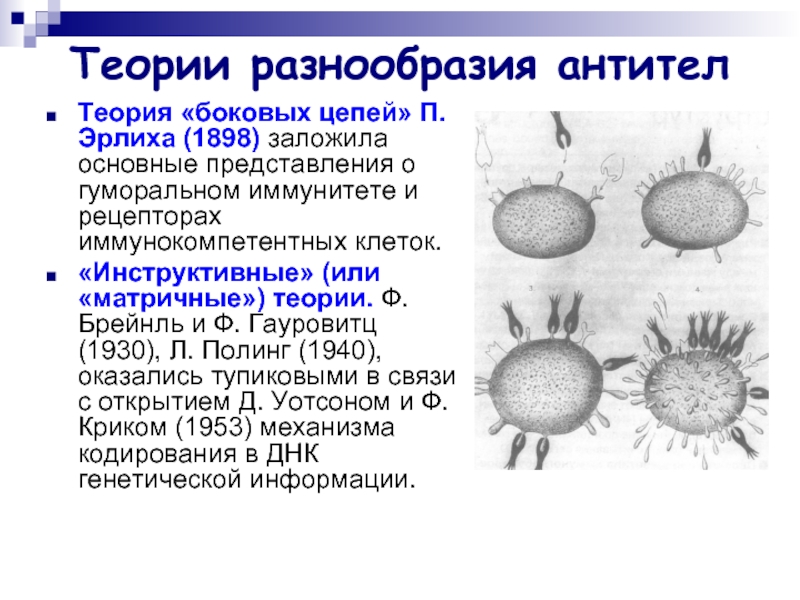
Слайд 32Теории разнообразия антител
Теория «боковых цепей» П. Эрлиха (1898) заложила основные представления
о гуморальном иммунитете и рецепторах иммунокомпетентных клеток.
«Инструктивные» (или «матричные») теории. Ф. Брейнль и Ф. Гауровитц (1930), Л. Полинг (1940), оказались тупиковыми в связи с открытием Д. Уотсоном и Ф. Криком (1953) механизма кодирования в ДНК генетической информации.
«Инструктивные» (или «матричные») теории. Ф. Брейнль и Ф. Гауровитц (1930), Л. Полинг (1940), оказались тупиковыми в связи с открытием Д. Уотсоном и Ф. Криком (1953) механизма кодирования в ДНК генетической информации.
Слайд 33Теории разнообразия антител
«Клонально-селекционная» теория Ф. Бернета.
Лимфоидная ткань состоит из огромного
числа клонов лимфоцитов, которые специализируются на продукции АТ к разнообразным АГ.
АГ→специфичный клон лимфоцитов →пролиферация, дифференцеровка→ АТ.
Большая доза АГ → клон элиминируется из организма → формированию в эмбриональном периоде иммунологической толерантности к собственным АГ.
АГ→специфичный клон лимфоцитов →пролиферация, дифференцеровка→ АТ.
Большая доза АГ → клон элиминируется из организма → формированию в эмбриональном периоде иммунологической толерантности к собственным АГ.
Слайд 34Теории разнообразия антител
Молекулярно-генетическая теория С. Тонегавы.
Теория сетевой регуляции иммунной системы. В
основе Н. идея Ерне (1974) идиотип-антиидиотипического взаимодействия. Можно понять формирование иммунологической памяти и возникновение аутоиммунных реакций, но не объясняет механизм иммунологического распознавания «свой – чужой», управление каскадом идиотип-антиидиотипических реакций.
Слайд 35Теории разнообразия антител
В 60-е годы П.Ф. Здродовский → физиологическая концепция иммуногенеза
– гипоталамо-адреналовая теория регуляции иммунитета.
Драйер и Беннетт: вариабельные и константные области кодируются отдельными генами, существует множество генов для вариабельных (V) и один или весьма ограниченное число генов для константных (С) областей.
Идея соматического мутагенеза (из относительно небольшого числа гаметных генов в течение жизни возникает множество модифицированных генов). Источник разнообразия вариабельных областей – генная конверсия с участием набора псевдогенов.
Драйер и Беннетт: вариабельные и константные области кодируются отдельными генами, существует множество генов для вариабельных (V) и один или весьма ограниченное число генов для константных (С) областей.
Идея соматического мутагенеза (из относительно небольшого числа гаметных генов в течение жизни возникает множество модифицированных генов). Источник разнообразия вариабельных областей – генная конверсия с участием набора псевдогенов.
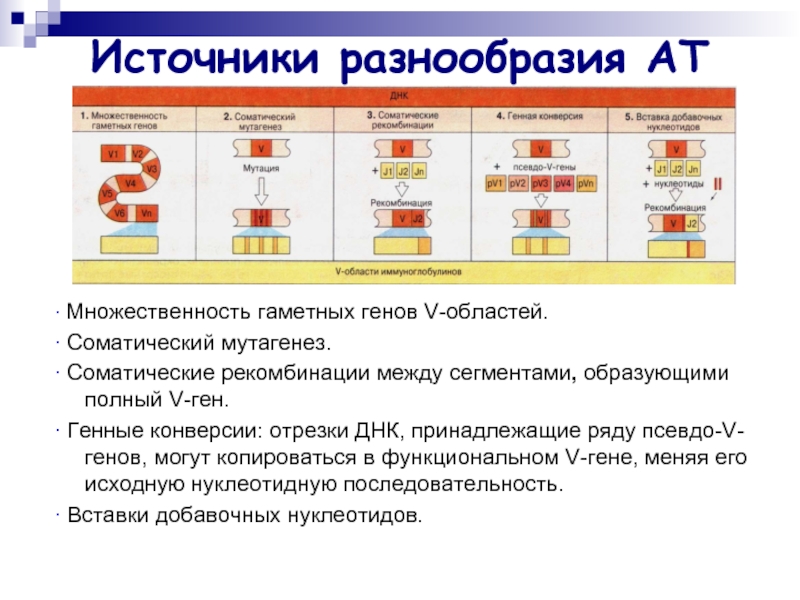
Слайд 36Источники разнообразия АТ
∙ Множественность гаметных генов V-областей.
∙ Соматический мутагенез.
∙ Соматические рекомбинации
между сегментами, образующими полный V-ген.
∙ Генные конверсии: отрезки ДНК, принадлежащие ряду псевдо-V-генов, могут копироваться в функциональном V-гене, меняя его исходную нуклеотидную последовательность.
∙ Вставки добавочных нуклеотидов.
∙ Генные конверсии: отрезки ДНК, принадлежащие ряду псевдо-V-генов, могут копироваться в функциональном V-гене, меняя его исходную нуклеотидную последовательность.
∙ Вставки добавочных нуклеотидов.
Слайд 37Иммунодиагностика инфекций
Прямые методы: преципитация, агглютинация прямая гемагглютинация.
Реакции пассивной агглютинации: реакция непрямой
геммагглютинации (РНГА), латексагглютинации, коагглютинации, агглютинации частиц бентонита, желатиновых капсул, частиц сефарозы и др.
Индикаторные методы основаны на использовании меток для выявления реакции антиген—антитело: ИФА, РИФ, РИА.
Иммуносенсоры основаны на изменении физико-химических свойств мембраны или другого носителя, связанного с АТ или АГ.
Индикаторные методы основаны на использовании меток для выявления реакции антиген—антитело: ИФА, РИФ, РИА.
Иммуносенсоры основаны на изменении физико-химических свойств мембраны или другого носителя, связанного с АТ или АГ.





![Механизм взаимодействия АТ с АГ[АГ]+[АТ] ↔ [ИК] Сила нековалентной связи зависит прежде всего от расстояния](/img/tmb/3/206997/d1c8fc0426dec9d8904a8e2561f16680-800x.jpg)