ИФА - основан на специфическом связывании антигена (АГ) с соответствующими антителами(АТ) с использованием фермента в качестве метки для регистрации сигнала.
Главный принцип ИФА – «узнавание» анализируемого соединения специфическим к нему антителом.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иммуноферментный анализ презентация
Содержание
- 1. Иммуноферментный анализ
- 2. ELISE (enzyme-linked immunosorbent assay) – разновидность ИФА
- 3. Антиген (Аг) в ИФА - любой патоген
- 4. Диагностика инфекционных и вирусных заболеваний (все инфекции,
- 5. Области применения ИФА Иммунология; Инфекционные и вирусные
- 6. 1. По условиям в которых проводится реакция
- 7. 2. По количеству этапов в постановке реакций
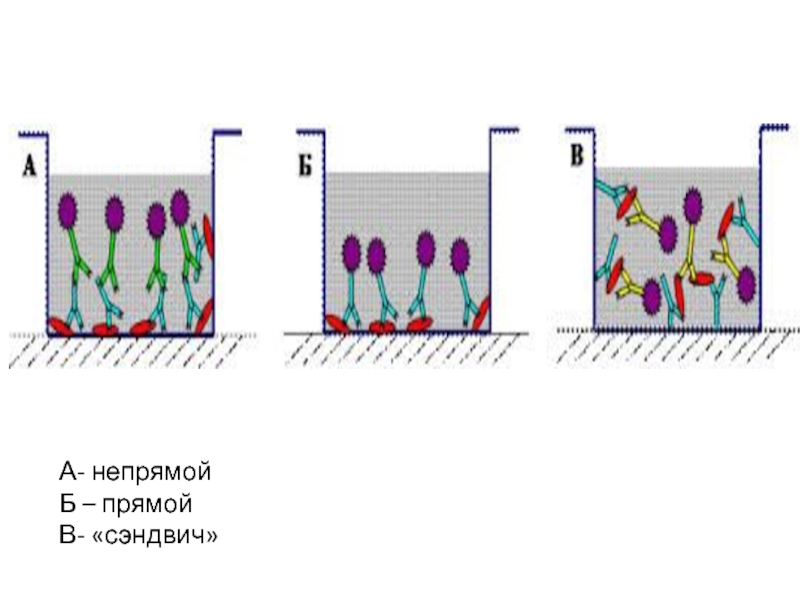
- 8. А- непрямой Б – прямой
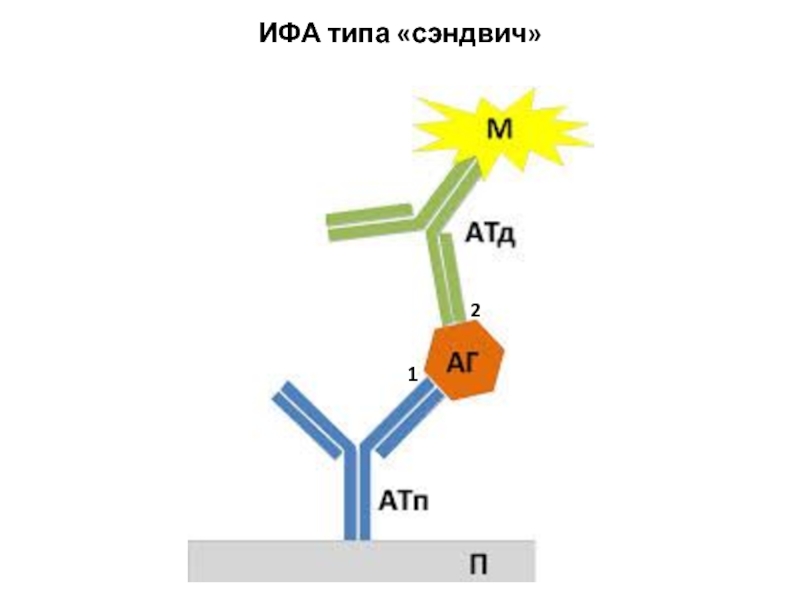
- 9. ИФА типа «сэндвич» 1 2
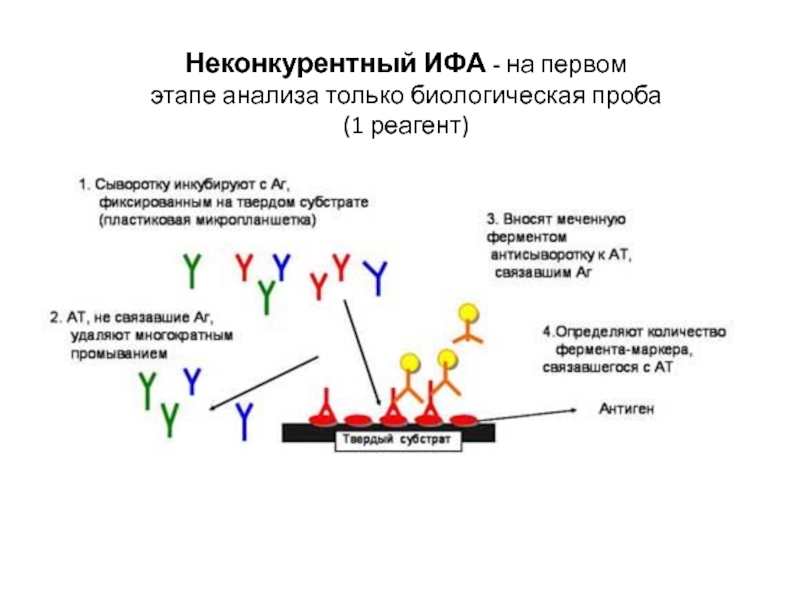
- 10. Неконкурентный ИФА - на первом этапе анализа только биологическая проба (1 реагент)
- 11. Конкурентный ИФА первом этапе анализа два реагента (for example биологическая проба и коньюгат)
- 12. АНАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ИФА Чувствительность (нижний предел обнаружения)
- 13. ПРОТОКОЛ ИФА Внесение биологического образца (сыворотка, плазма
- 14. 7. Внесение субстрат-хромогенной смеси; 8. Инкубация (в
- 15. Учет результатов: При количественном варианте ИФА
- 16. Гемостаз - биологическая система, функция которой заключается
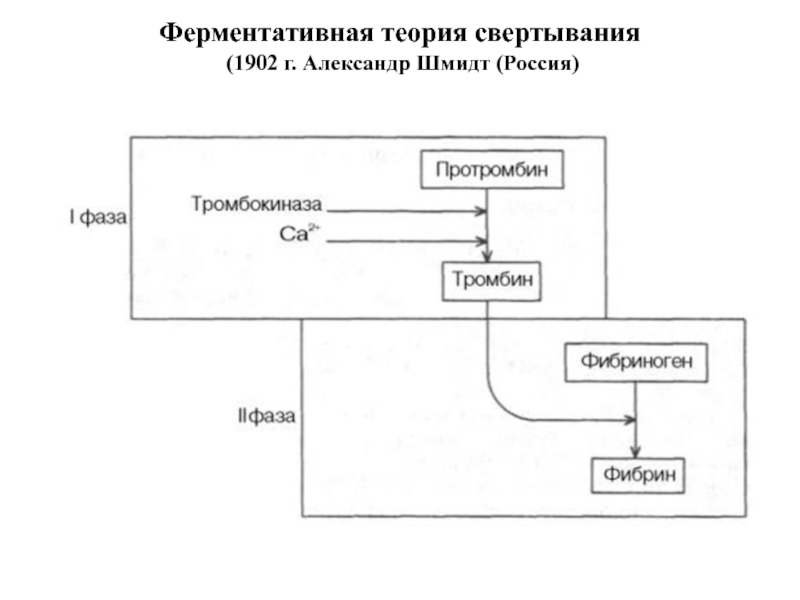
- 17. Ферментативная теория свертывания (1902 г. Александр Шмидт (Россия)
- 18. Современная схема свертывания крови (5 фаз) –
- 19. Современная схема свертывания крови тканевая протромбиназа XIIa+Ca2++XIa+III (ФЛ) Кровяная протромбиназа
- 20. III – тромбопластин (тканевой, кровяной, эритроцитарный,
- 21. Факторы свертывания крови Факторы свёртывания крови — группа
- 22. Классификация факторов свертывания I: Субстраты (фибриноген
- 23. Сосудисто-тромбоцитарный гемостаз - спазм сосудов и их
- 25. АКТИВАЦИЯ ТРОМБОЦИТОВ В ПРОЦЕССЕ СВЕРТЫВАНИЯ КРОВИ
- 26. Роль сосудов в остановке кровотечения
- 28. Лабораторные методы для оценки состояния первичного гемостаза
- 29. Длительность кровотечения по Дуке 0борудование
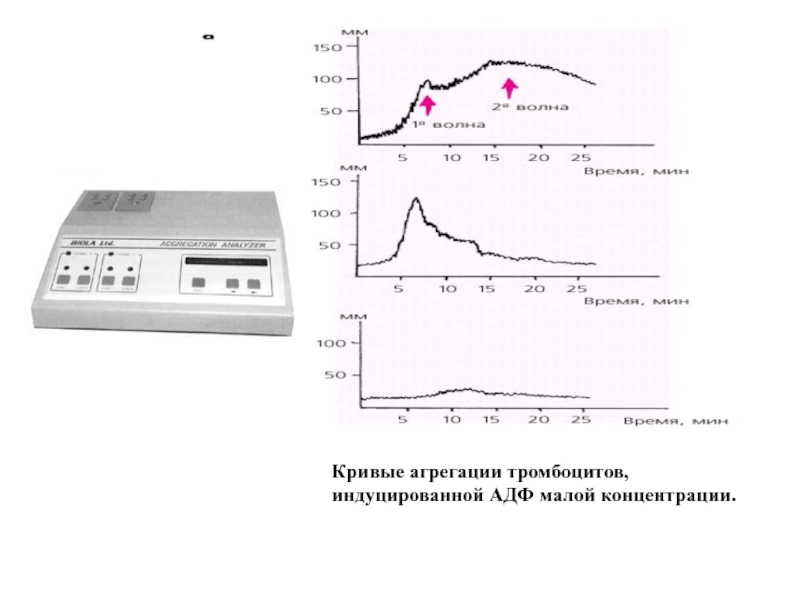
- 30. Кривые агрегации тромбоцитов, индуцированной АДФ малой концентрации.
- 31. III – тромбопластин (тканевой, кровяной, эритроцитарный,
- 32. Современная схема свертывания крови тканевая протромбиназа XIIa+Ca2++XIa+III (ФЛ) Кровяная протромбиназа
- 33. СВЕРТЫВАНИЕ КРОВИ IN VITRO - МЕТОДЫ
- 34. Протромбиновое время (ПВ), А. Квик, 1935г. ПВ
- 35. ПВ оценивает внешний механизм свертывания укорачивается при
- 36. АЧТВ – оценивает внутренний механизм свертывания Норма
- 37. D-димер - продукт деградации фибрина при
- 38. Программа по профилактике и лечению лиц ГПР
- 39. Период беременности: Назначение пероральных препаратов Fe при
- 40. Группы особого риска по ЖДА беременных и
- 41. Fe -содержащие белки и их функции в
- 42. 28-31 мг/кг – в составе Hg;
- 43. Содержание Fe в различных органах
- 44. Трансферрин – транспортный белок (88 кДа), синтезируется
- 45. БАЛАНС Fe в организме определяется:
- 46. Выделение (потери) Fe из организма из ЖКТ
- 47. Лабораторные показатели, характеризующие обмен Fe Сывороточное Fe;
- 48. Снижение уровня сывороточного Fe При железодефицитной анемии
- 49. Критерии ВОЗ для диагностики анемии Эритроциты
- 50. Железодефицитная анемия (ЖДА) – это анемии, обусловленные
- 51. Причины железодефицитной анемии Кровопотери (различного происхождения)
- 52. Группы особого риска по ЖДА беременных и
- 53. Стадии формирования ЖДА стадия - скрытый (латентный)
- 54. I стадия ЖДА. Лабораторные показатели на стадии
- 55. II стадия ЖДА. Лабораторные показатели на стадии
- 56. Диагностика ЖДА по эритроцитарным индексам RDW MCV-
- 57. ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА (БИОХИМИЧЕСКИЕ) Уровень сывороточного Fe
Слайд 1 Иммуноферментный анализ (ИФА) - относится к современным методам ИА и используется
Слайд 2ELISE (enzyme-linked immunosorbent assay) – разновидность ИФА - твердофазный ИФА,
Е.
Слайд 3Антиген (Аг) в ИФА - любой патоген (бактерия) или его фрагмент,
Эпитоп (антигенная детерминанта) – участок Аг, который узнается и связывается Ат.
Антитела:
1. Поликлональные (for example кроличьи антитела против всех Ig человека);
2. Моноклональные (к определенному классу Ig)
Основные характеристики антител:
Аффинность – степень специфического сродства активного центра АТ к АГ-детерминанте. При низкой афинности антител распад комплекса Аг-Ат приводит к удалению связанного Аг из системы.
Авидность – степень прочности связывания АТ с АГ.
Чем выше аффинность (степень сродства), тем лучше авидность (прочность связывания)
Слайд 4Диагностика инфекционных и вирусных заболеваний (все инфекции, ВИЧ, гепатиты) - выявление
Кардиомаркеры (hs СРБ, тропонин, миоглобин, NTproBNP);
Определение уровня гормонов (щитовидной железы, надпочечников, половые и т.д.);
Выявление и определение уровня ксенобиотиков (лекарственных препаратов, токсикантов, наркотических веществ);
Определение уровня иммуноглобулинов (Ig A, М,G, Е, подклассы IgG 1-4);
Определение уровня цитокинов (все IL,интерфероны, ФНО, КСФ и т.д.);
Выявление иммунных комплексов;
Определение уровня опухолевых маркеров (ОМ);
Определение уровня специфических белков крови (ферритин, TRF, фибронектин , эритропоэтин и др.);
Определение концентрации ферментов (СОД, глутатионпероксидаза, каталаза и т.д.);
Скрининг моноклональных антител;
Определение компонентов костного метаболизма (маркеров остеосинтеза и резорбции – (ДПД, С-концевые телопептиды, остеокальцин и т.д.)
Определение факторов свертывания крови (Д-димер)
Области применения ИФА
Слайд 5Области применения ИФА
Иммунология;
Инфекционные и вирусные заболевания;
Кардиология;
Патология гемостаза;
Онкология;
Фертильность и репродукция;
Гормоны;
Ветеринария
Слайд 61. По условиям в которых проводится реакция ИФА:
Гомогенный – нет стадии
Гетерогенный - реакция проводится с реагентами, фиксированными на поверхности (твердой фазе) с иммобилизованными на нее АТ (или АГ).
Варианты ИФА
Слайд 72. По количеству этапов в постановке реакций ИФА:
прямой;
непрямой
3. По количеству реагентов
конкурентный
неконкурентный
Слайд 11Конкурентный ИФА первом этапе анализа два реагента (for example биологическая проба
Слайд 12АНАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
ИФА
Чувствительность (нижний предел обнаружения) – минимальная достоверно определяемая концентрация исследуемого
Измеряется в единицах концентрации.
Зависит от концентрации, активности и специфичности используемых Ат.
Специфичность – характеристика избирательности тест-системы.
Она показывает насколько вероятно, что реакция будет протекать с искомым веществом, а не с другими компонентами исследуемого образца.
Измеряется в %.
Чувствительность и специфичность ИФА повышается при применении моноклональных Ат.
Слайд 13ПРОТОКОЛ ИФА
Внесение биологического образца (сыворотка, плазма и др.) в лунки планшета
2. Инкубация при определенных условиях
происходит узнавание тестируемого соединения специфическим к нему Ат/Аг, что ведет к образованию иммунного комплекса;
3. Промывка лунок - удаление несвязавшихся компонентов реакции;
4. Внесение коньюгата – Ат/Аг меченые ферментом;
5. Инкубация
формируется связь коньюгата с ранее сформировавшимся иммунным комплексом;
Коньюгат - фермент-Аг (или фермент- Ат)
6. Промывка лунок - удаление несвязавшихся компонентов реакции;
Слайд 147. Внесение субстрат-хромогенной смеси;
8. Инкубация (в темноте);
«ферментная метка превращается в регистрируемый
9. Внесение стоп-раствора;
10. Учет результатов с помощью спектрофотометра или ИФА-ридера.
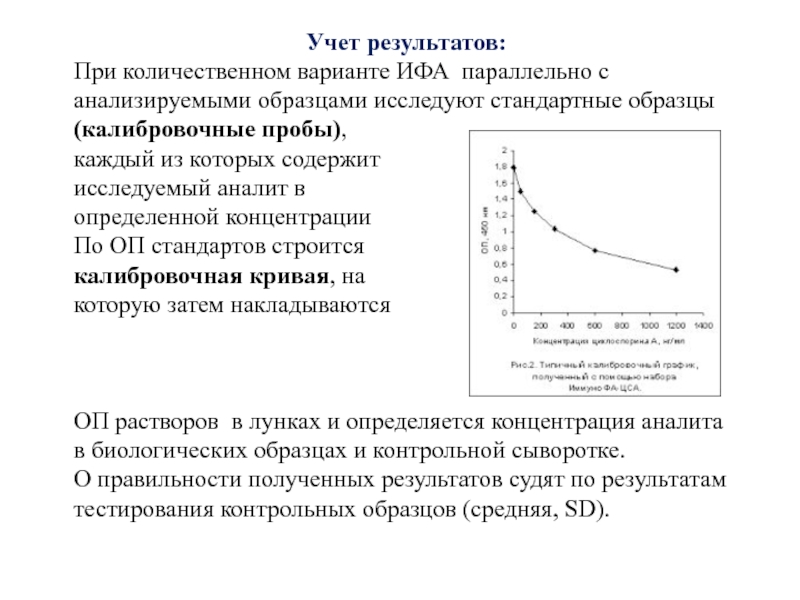
Слайд 15Учет результатов:
При количественном варианте ИФА параллельно с анализируемыми образцами исследуют
каждый из которых содержит
исследуемый аналит в
определенной концентрации
По ОП стандартов строится
калибровочная кривая, на
которую затем накладываются
ОП растворов в лунках и определяется концентрация аналита в биологических образцах и контрольной сыворотке.
О правильности полученных результатов судят по результатам тестирования контрольных образцов (средняя, SD).
Слайд 16Гемостаз - биологическая система, функция которой заключается в сохранении жидкого состояния
Свертывание крови – сложная цепь реакций, в которых участвуют сосудистая стенка, тромбоциты и факторы свертывания.
ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ О ГЕМОСТАЗЕ
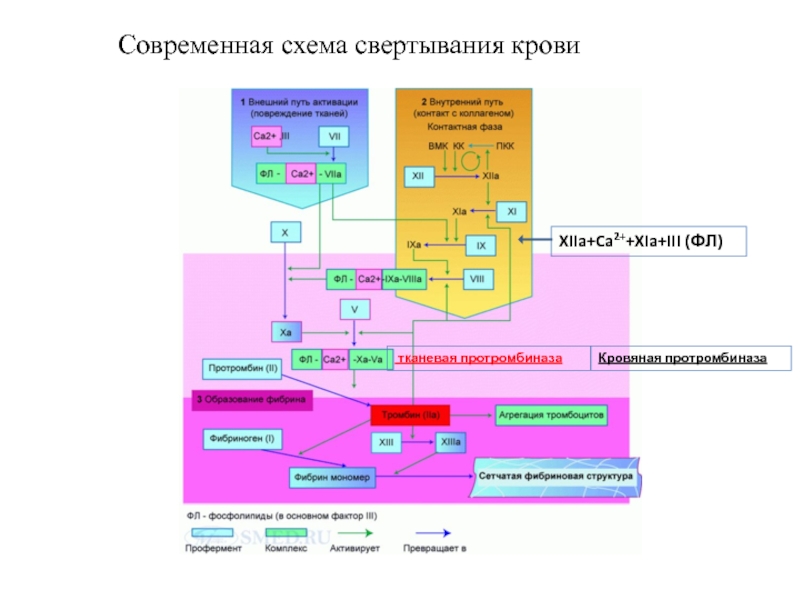
Слайд 18Современная схема свертывания крови (5 фаз) – 5-6 мин
1. Образование
2. Образование тромбина;
3. Образование фибрина;
4. Полимеризация фибрина и организация сгустка;
5. Фибринолиз - лизис фибринового сгустка, который приводит к растворению тромба после репарации поврежденной стенки сосуда.
.
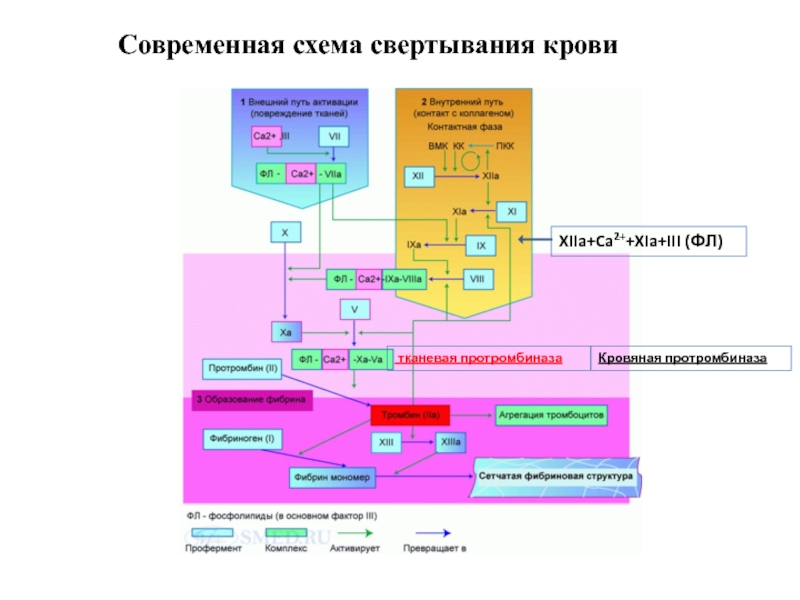
Слайд 19Современная схема свертывания крови
тканевая протромбиназа
XIIa+Ca2++XIa+III (ФЛ)
Кровяная протромбиназа
Слайд 20
III – тромбопластин (тканевой, кровяной, эритроцитарный, тромбоцитарный;
IV – Ca2+
Xa –
Va – активированный проакцелерин – ускоритель ферментативных реакций свертывания
Протромбиназа (комплекс факторов)
Тромбопластин (III) – Ca2+ (IV) - Xa – Va
Слайд 21Факторы свертывания крови
Факторы свёртывания крови — группа веществ, содержащихся в плазме крови
Плазменные (17 ф.) - I - XIII;
Тромбоцитарные (14-22 ф.);
Тканевые факторы;
Клеточные (эритроциты, лейкоциты)
Плазменные факторы свертывания преимущественно синтезируются в печени. Ф. VIII – в клетках эндотелия
Большинство факторов свёртывания — белки (ферменты, кофакторы ферментов, ингибиторы ферментов). Ca 2+ и др. низкомолекулярные органические вещества.
В норме белковые факторы свёртывания крови находятся в плазме в неактивном состоянии. В процессе свертывания крови предшественники факторов свертывания превращаются в их активные формы.
Слайд 22Классификация факторов свертывания
I:
Субстраты (фибриноген (I);
Ферменты – большинство
Кофакторы ферментов (тканевой фактор,
II:
Группа ф/г (I, V, VIII, XIII);
Группа протромбина (II, VII, IX, X);
Контактные факторы (XI, XII, прекалликреин, кининоген)
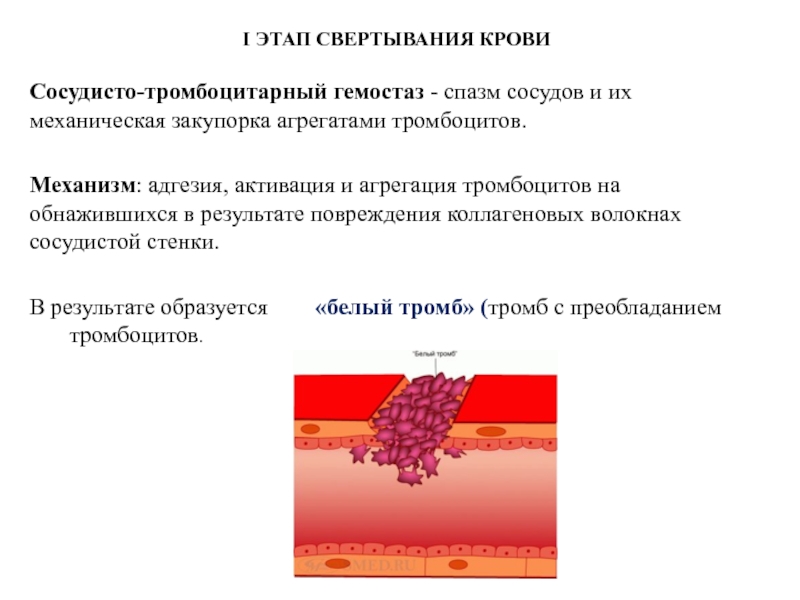
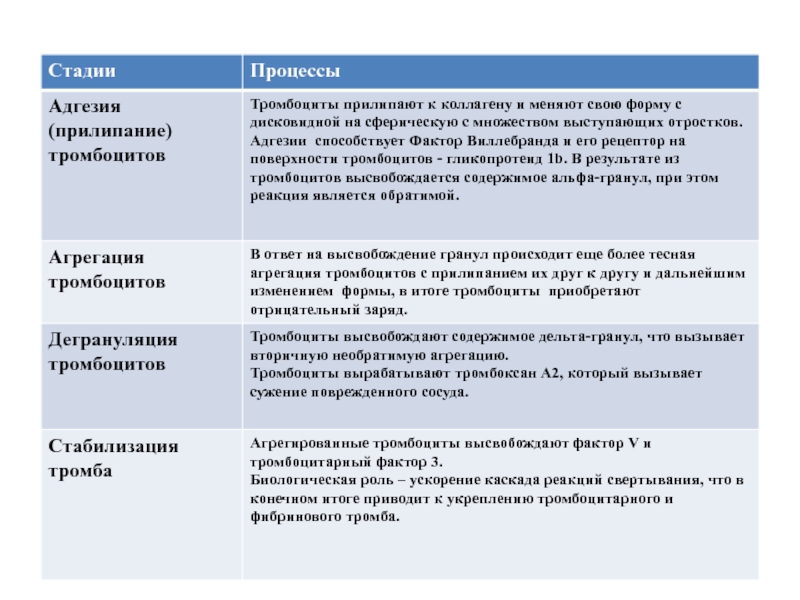
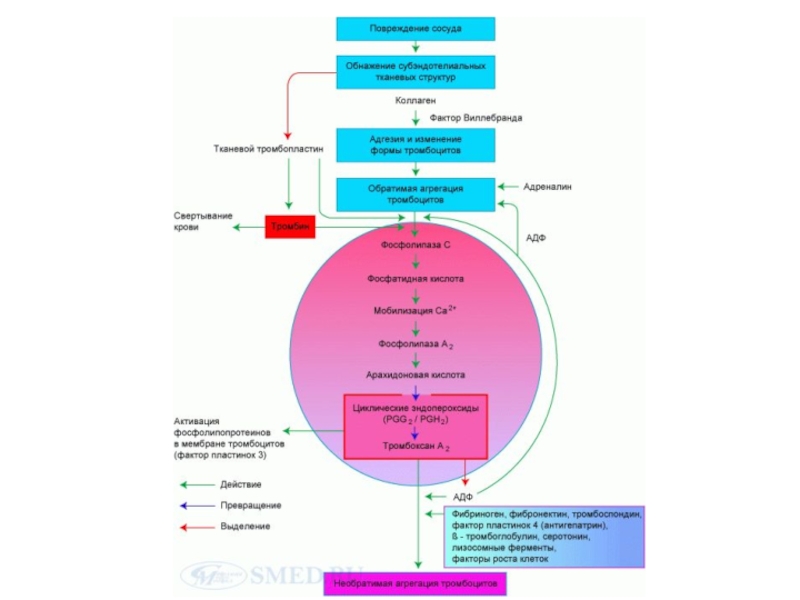
Слайд 23Сосудисто-тромбоцитарный гемостаз - спазм сосудов и их механическая закупорка агрегатами тромбоцитов.
Механизм: адгезия, активация и агрегация тромбоцитов на обнажившихся в результате повреждения коллагеновых волокнах сосудистой стенки.
В результате образуется «белый тромб» (тромб с преобладанием тромбоцитов.
I ЭТАП СВЕРТЫВАНИЯ КРОВИ
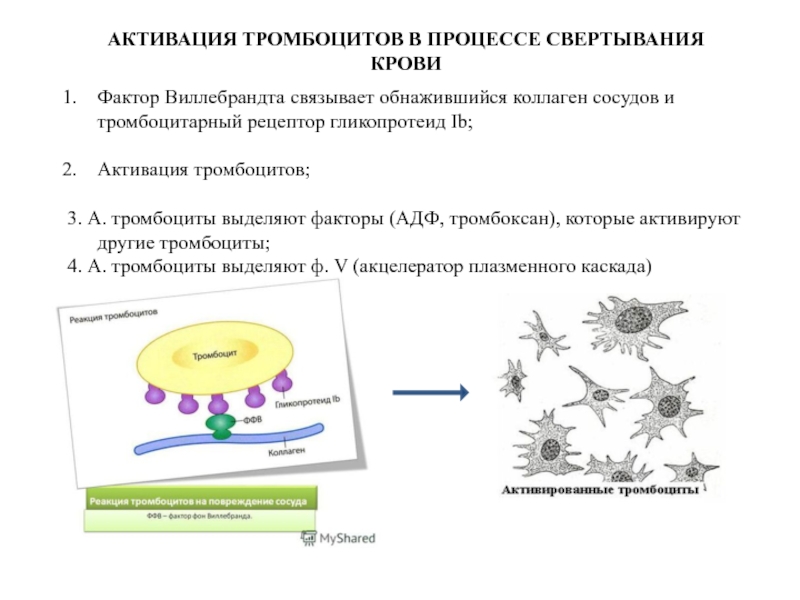
Слайд 25АКТИВАЦИЯ ТРОМБОЦИТОВ В ПРОЦЕССЕ СВЕРТЫВАНИЯ КРОВИ
Фактор Виллебрандта связывает обнажившийся коллаген сосудов
Активация тромбоцитов;
3. А. тромбоциты выделяют факторы (АДФ, тромбоксан), которые активируют другие тромбоциты;
4. А. тромбоциты выделяют ф. V (акцелератор плазменного каскада)
Слайд 26Роль сосудов в остановке кровотечения
Вазоконстрикция (сужение просвета сосуда) осуществляется под влиянием
приводит к:
- сокращению кровотока через поврежденный участок;
- стимуляции агрегации тромбоцитов;
- контактной активации свертывания с дальнейшим запуском ферментативных реакций вторичного гемостаза (плазменного)
Слайд 28Лабораторные методы для оценки состояния первичного гемостаза
Время кровотечения (по Дюке);
Определение количества,
Определение агрегационной функции тромбоцитов;
Определение ф. Виллебранда;
Определение ретракции кровяного сгустка.
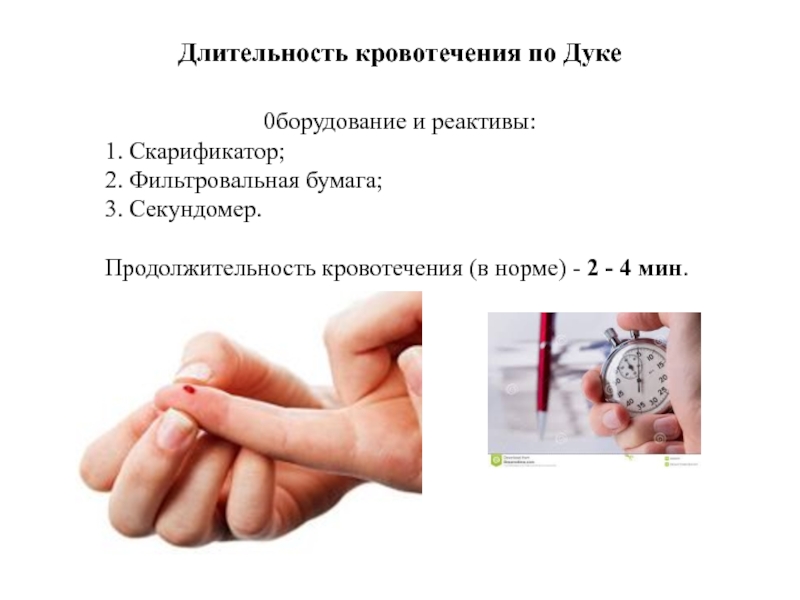
Слайд 29Длительность кровотечения по Дуке
0борудование и реактивы:
1. Скарификатор;
2. Фильтровальная бумага;
3.
Продолжительность кровотечения (в норме) - 2 - 4 мин.
Слайд 31
III – тромбопластин (тканевой, кровяной, эритроцитарный, тромбоцитарный;
IV – Ca2+
Xa –
Va – активированный проакцелерин – ускоритель ферментативных реакций свертывания
Протромбиназа (комплекс факторов)
Тромбопластин (III) – Ca2+ (IV) - Xa – Va
Слайд 32Современная схема свертывания крови
тканевая протромбиназа
XIIa+Ca2++XIa+III (ФЛ)
Кровяная протромбиназа
Слайд 33СВЕРТЫВАНИЕ КРОВИ IN VITRO -
МЕТОДЫ ИЗУЧЕНИЯ ПОКАЗАТЕЛЕЙ ГЕМОСТАЗА
Протромбиновое время (ПВ)
Активированное
Тромбиновое время
Фибриноген
Продукты деградации фибрина (ПДФ)
Д-димер
Слайд 34Протромбиновое время (ПВ), А. Квик, 1935г.
ПВ в норме 12-17 сек;
2) Протромбиновое
ПО = ПВ пациента/ПВ контрольной плазмы
(в норме 0,9-1,3);
3) Протромбин (по Квику) – определяется по калибровочному графику, построенному на нормальной плазме;
4) Международное нормализированное отношение (МНО) = (ПВ пациента/ПВ контроля x МИЧ*
Референсное значение 0,9-1,3
*МИЧ – международный индекс чувствительности
Слайд 35ПВ оценивает внешний механизм свертывания
укорачивается при активации внешнего механизма свертывания (травмы,
удлиняется:
– дефицит или аномалия факторов протромбинового комплекса (VII, X, V, II);
- прием непрямых антикоагулянтов (варфарин);
- болезни печени;
- дефицит витамина К;
- ДВС в фазе гипокоагуляции
Слайд 36АЧТВ – оценивает внутренний механизм свертывания
Норма АЧТВ от 28 до 38
Укорочение АЧТВ:
- при активации внутреннего механизма свертывания (тромбозы)
- ДВС (фаза гиперкоагуляции).
Удлинение:
– дефицит факторов внутреннего пути свертывания (VIII, IX, XI, XII) если результаты ПВ являются нормальными;
дефицит II, V, X при гипокоагуляции по результатам ПВ;
дефицит фактора Виллебранда;
ДВС (фаза гипокоагуляции)
заболевания печени
дефицит витамина К
Слайд 37D-димер - продукт деградации фибрина при воздействии на него плазмина. Концентрация D-димера
Методы определения:
Одностадийный ИФА.
Специфичность анализа обеспечивается использованием моноклональных антител, обладающих высокой специфичностью к D-димеру.
Нормальная концентрация D-димера в крови 0 - 250 нг/мл.
Слайд 38Программа по профилактике и лечению лиц ГПР по ЖДА (из рекомендаций
Дети грудного (0-12 мес.) и младшего (1-5 лет) возраста:
Грудное вскармливание или питательные смеси обогащенные Fe;
прикорм в виде фруктов, овощей и соков по достижению 6-месячного возраста;
Обследование для выявление анемии каждые 6 месяцев.
Дети младшего школьного возраста (5-12 лет) и мальчики-подростки (12-18 лет):
Обследование детей с ЖДА или недостаточным потреблением Fe в анамнезе;
Девочки-подростки (12-18 лет) и женщины детородного возраста вне периода беременности:
Потребление богатой Fe пищи и продуктов, усиливающих его всасывание;
Обследование каждые 5-10 лет на протяжении всего детородного периода;
Слайд 39Период беременности:
Назначение пероральных препаратов Fe при первом посещении женской консультации;
Обследование на
При уровне Hg < 90 г/л обеспечить последующее наблюдение;
Послеродовой период:
Факторы риска включают длительную анемию, большую кровопотерю и многоплодную беременность;
Мужчины старше 18 лет и женщины в постменопаузе:
Плановое обследование не показано.
Слайд 40Группы особого риска по ЖДА
беременных и кормящих грудью - до 70-80%;
дети в возрасте до 1 года - до 45%.
Слайд 41Fe -содержащие белки и их функции в организме
транспорт O2 и СО2-
окислительно-восстановительные реакции (цитохромы, пероксидаза, каталаза);
транспорт и депонирование железа (трансферрин, ферритин, гемосидерин)
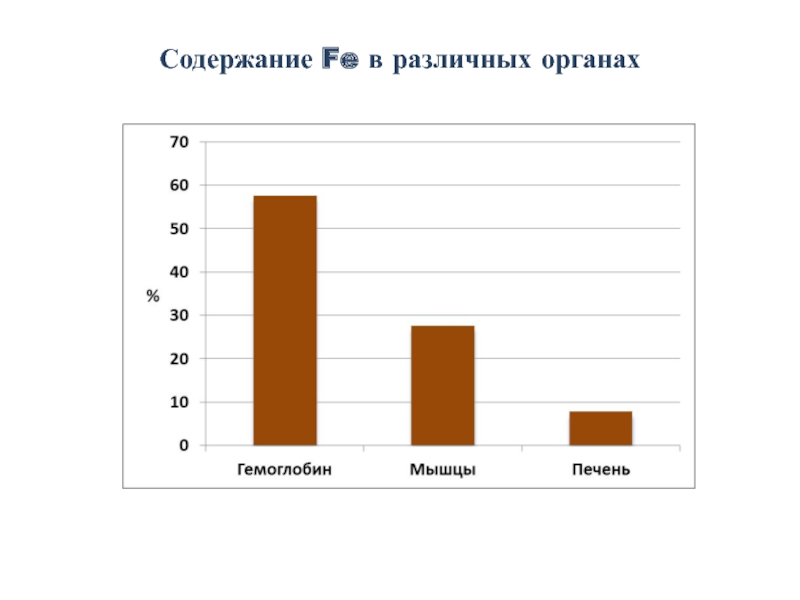
Слайд 4228-31 мг/кг – в составе Hg;
4-5 мг/кг – в составе миоглобина;
12
Остальное – в составе гемсодержащих и др. ферментов.
Содержание Fe в белках организма
Слайд 44Трансферрин – транспортный белок (88 кДа), синтезируется в печени, молекула содержит
Биологическая роль – связывает и переносит Fe в эритрокариоциты костного мозга или в органы-депо Fe (печень и т.д.)
Ферритин – высокомолекулярный водорастворимый белок (500 кДа), содержит 20% Fe3+. Содержится практически во всех клетках организма, в большей степени - в селезенке, печени, костном мозге.
Биологическая роль – депо Fe.
Гемосидерин - небелковый комплекс нерастворимым в H2O и очень богатый Fe (37%). Содержится главным образом в макрофагах РЭС печени и селезенки.
Биологическая роль – изучена недостаточно.
Слайд 45
БАЛАНС Fe в организме
определяется:
Поступлением железа в организм с продуктами питания;
Всасыванием железа
Эритропоэзом;
Депонированием железа;
Потерями железа.
Слайд 46Выделение (потери) Fe из организма
из ЖКТ (кал, желчь, слущивающийся эпителий кишки)
через почки - до 0,1 мг/сутки;
менструации у женщин - от 0,6-1,2 мг до 2,5 мг железа /сутки. Всего за цикл 2 - 79 мг;
выделение через кожу (пот) - 0,2-0,3 мг/сутки
Нерегулярные потери - беременность и лактация.
Слайд 47Лабораторные показатели, характеризующие обмен Fe
Сывороточное Fe;
ОЖСС (общая Fe-связывающая способность сыворотки) -
коэффициент насыщения TRF = сыв. Fe/ ОЖСС;
Концентрация ферритина;
Концентрация трансферрина.
Слайд 48Снижение уровня сывороточного Fe
При железодефицитной анемии (ЖДА);
при анемиях, связанных с воспалением,
при заболеваниях органов ЖКТ;
Опухолях;
Инфаркте миокарда
Слайд 49Критерии ВОЗ для диагностики анемии
Эритроциты
Эритроциты <3,8 x109/л,
Hg <120,0 г/л,
гематокрит <36%.
Слайд 50Железодефицитная анемия (ЖДА)
– это анемии, обусловленные нарушением синтеза Hb и соответственно
Непосредственной причиной является дефицит Fe в организме.
Слайд 51Причины железодефицитной анемии
Кровопотери (различного происхождения)
Врожденный дефицит белка трансферрина;
Анемия у детей
Донорство
Нарушение
Слайд 52Группы особого риска по ЖДА
беременных и кормящих грудью - до 70-80%;
дети в возрасте до 1 года - до 45%.
Слайд 53Стадии формирования ЖДА
стадия - скрытый (латентный) дефицит железа;
стадия проявлений ЖДА
Слайд 54I стадия ЖДА. Лабораторные показатели на стадии латентного дефицита Fe 1.Общий анализ
Hb>120 г/л
RBC, MCV, MCH, MCHC, RDW – НОРМА
2. Обмен железа:
СЫВОРОТОЧНОЕ ЖЕЛЕЗО - НОРМА ИЛИ СНИЖЕНО,
ТРАНСФЕРРИН - НОРМА
ФЕРРИТИН – СНИЖЕН
Слайд 55II стадия ЖДА. Лабораторные показатели на стадии клинических проявлений ЖДА
ОАК:
Hb
RBC (эритроциты) - норма или снижены;
MCV (средний объем эритроцитов) - менее 80 fl;
MCH - менее 26 пг;
MCHC - менее 320 г/л;
RDW - > нормы. Норма 11,5-14,5%.
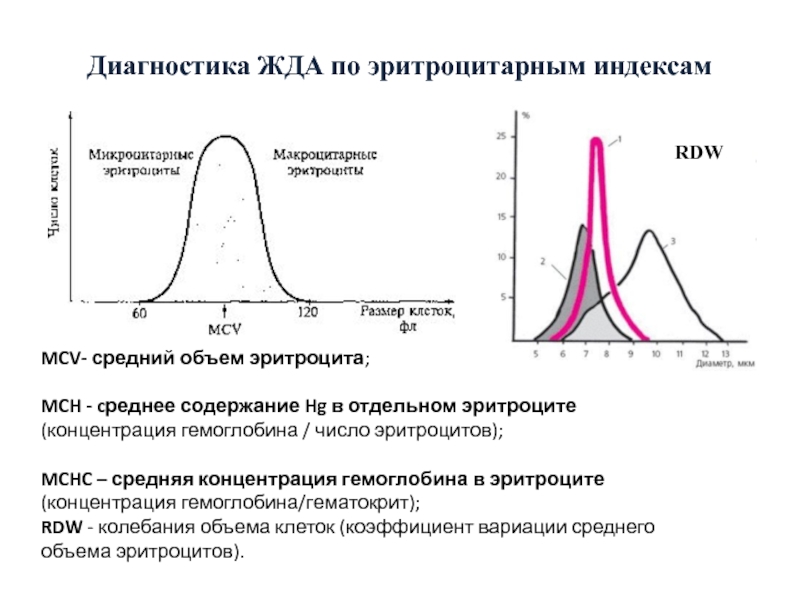
Слайд 56Диагностика ЖДА по эритроцитарным индексам
RDW
MCV- средний объем эритроцита;
MCH - cреднее содержание
MCHC – средняя концентрация гемоглобина в эритроците (концентрация гемоглобина/гематокрит);
RDW - колебания объема клеток (коэффициент вариации среднего объема эритроцитов).
Слайд 57ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА (БИОХИМИЧЕСКИЕ)
Уровень сывороточного Fe - снижен;
Уровень ферритина – резко
ОЖСС - повышена;
Коэффициент насыщения трансферрина - снижен