- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гентика в неврологии и психиатрии презентация
Содержание
- 1. Гентика в неврологии и психиатрии
- 2. Понимание ведущей роли генетических факторов в этиологии
- 3. Конец XX века и начало нового тысячелетия
- 4. В
- 5. Введены сотни новых генетических вариантов наследственных заболеваний нервной системы
- 6. Среди нервно-мышечных заболеваний появились такие группы болезней
- 7. Введено новое понятие болезней экспансии, в
- 8. В настоящее время описаны около 30 болезней
- 9. Это самая частая форма Х-сцепленной умственной отсталости
- 10. Причиной заболевания является экспансия CGG-повтора, расположенного
- 11. В дальнейшем было показано, что в основе
- 12. Ведущим проявлением заболевания является миотонический синдром. Миотонические
- 13. Один из симптомов – механический валик: длительное
- 14. В норме количество CTG-триплетов не превышает 50.
- 15. Наиболее вероятным патогенетическим механизмом миотонической дистрофии является
- 16. К болезням экспансии относится наиболее частая аутосомно-рецессивная
- 17. Первые признаки болезни отмечаются в 4-10 лет
- 18. Относительно небольшие экспансии нестабильных CAG-повторов, расположенных в
- 19. Это целая серия спиноцеребеллярных атаксий, хорея Гентингтона,
- 20. Нейродегенеративным процессам при этих болезнях предшествует накопление
- 21. Сходный патогенетический механизм наблюдается при болезнях, вызванных
- 22. К подобным заболеваниям относятся Х-сцепленный синдром Веста,
- 23. Таким образом, патогенетический механизм этих болезней экспансии
- 24. К конформационным болезням относятся болезни Альцгеймера и
- 25. Было доказано, что развитие факоматозов обусловлено
- 26. При наследственных заболеваниях с пароксизмами, гипер- или
- 27. К каналопатиям относятся наследственные миотонии, периодические параличи, многие формы идиопатической эпилепсии и мигрени
- 28. Феномен миотонии заключается во внезапном тоническом спазме
- 29. Известны две клинические формы: аутосомно-доминантная врождённая миотония
- 30. Обе формы миотонии обусловлены мутациями в гене
- 31. Наследственная пароксизмальная миоплегия характеризуется приступами резкой слабости,
- 32. Наиболее распространенной является аутосомно-доминантная гипокалиемическая форма, или
- 33. Краниальная мускулатура, как правило, не страдает, сознание
- 34. Гиперкалиемическая форма пароксизмальной миоплегии, или болезнь Гармстропа
- 35. При гипокалиемическом параличе, обусловленном мутациями в гене
- 36. Мутации в гене SCN4 (17q23.1), кодирующем альфа-4-субъединицу
- 37. В результате дефекта натриевого канала происходит генерация
- 38. Большинство наследственных абсанс-эпилепсий обусловлены повреждением нейрональных каналов, имеющих непосредственное отношение к механизмам поляризации мембраны
- 39. Большинство идиопатических эпилепсий относятся к многофакторным заболеваниям с выраженной генетической компонентой
- 40. В настоящее время найдено сцепление различных форм
- 41. Среди них гены, участвующие в поддержании в
- 42. Значительно более редкими являются моногенные формы эпилепсии,
- 43. Наследственные формы идиопатической эпилепсии обусловлены спецефическими дефектами
- 44. Примерами являются гены нейрональных потенциал-зависимых калиевых каналов
- 45. 4 моногенных формы гемиплегической мигрени обусловлены мутациями
- 46. Таким образом, в конце прошлого века были
- 47. Обсудим преимущества подобной патогенетической системы классификации болезней нервной системы на примере наследственных миопатий
- 48. Клиническая классификация прогрессирующих мышечных дистрофий (ПМД) основана
- 49. Морфологически в мышечных волокнах при миопатиях выявляются
- 50. В сыворотке крови больных увеличено содержание саркоплазматических
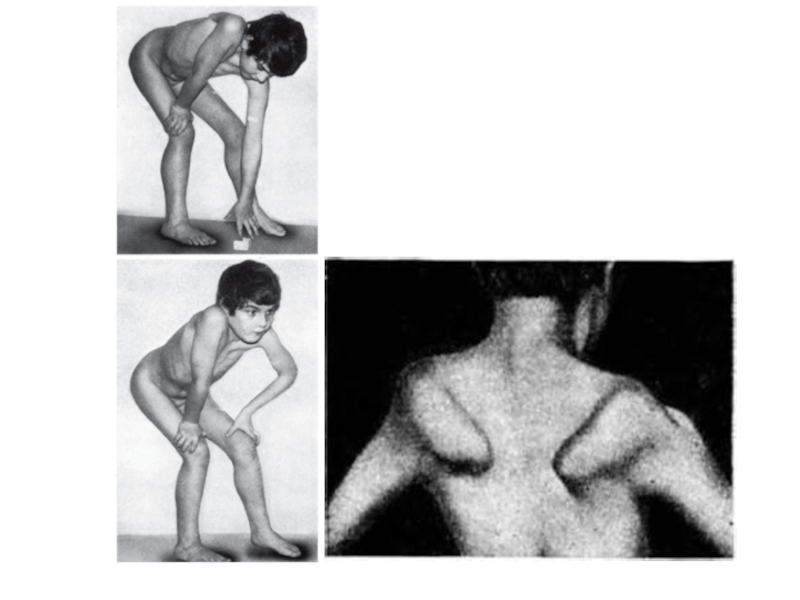
- 51. Наиболее распространенной и злокачественной формой нервно-мышечной патологии детского возраста является Х-сцепленная псевдогипертрофическая миодистрофия Дюшенна/Беккера
- 52. Первые признаки миодистрофии Дюшенна появляются в возрасте
- 54. В некоторых случаях дюшенно-подобные миодистрофии наследуются по
- 55. Конечностно-поясные миодистрофии – это гетерогенная группа
- 56. Больные начинают испытывать затруднения при беге и
- 57. Генетическое разнообразие наследственных конечностно-поясных миодистрофий очень велико.
- 58. При некоторых формах конечностно-поясная миодистрофия сочетается с
- 59. В самостоятельную клиническую группу традиционно выделяют врожденные
- 60. Патологические процессы при некоторых врожденных непрогрессирующих миопатиях обусловлены отложением в миофибриллах гистологически идентифицируемых аномальных образований
- 61. При немалиновой миопатии в мышечных клетках пациентов
- 62. Определенные гистологические аномалии выявляются также у больных миотубулярной миопатией и болезнью центрального стержня
- 63. Нерастворимые включения в мышечных клетках характерны и
- 64. В особую группу выделяют медленно прогрессирующие митохондриальные
- 65. Наследственные дефекты различных мышечных ферментов являются причиной
- 66. Белковые продукты многих генов, связанных с наследственными
- 67. Основными функциями подобных белков являются: стабилизация
- 68. К подобным белкам относится дистрофин –
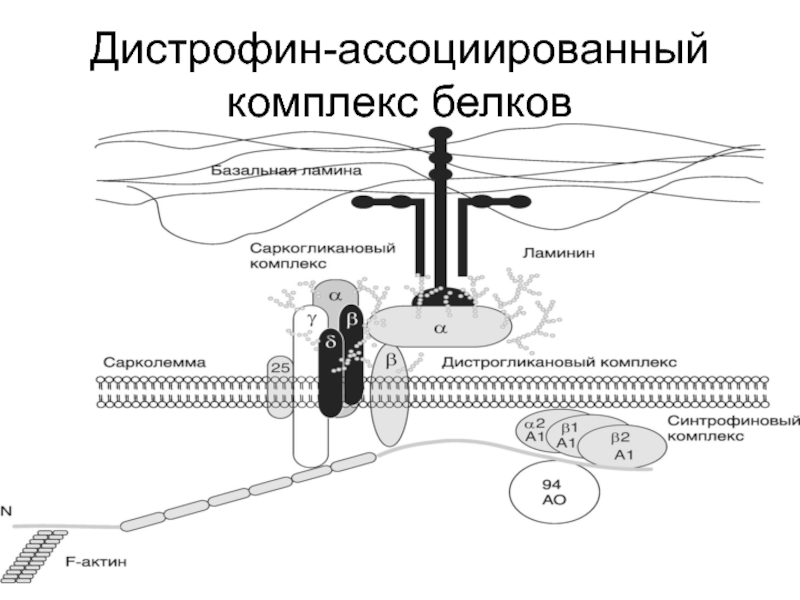
- 69. Дистрофин-ассоциированный комплекс белков
- 70. При миодистрофии Дюшенна/Беккера, также как при аутосомно-рецессивных
- 71. При миодистрофии Дюшенна/Беккера разрушение дистрофин-ассоциированного комплекса
- 72. В 65-70% случаев у больных миодистрофией Дюшенна/Беккера
- 73. Различия заключаются в том, что при миодистрофии
- 74. В гене DMD идентифицированы также относительно небольшие
- 75. Молекулярная диагностика делеций в гене DMD проводится
- 77. Разрушение дистрофин-ассоциированного комплекса белков при
- 78. Мутации в генах дистрогликанов не обнаружены.
- 79. Дистрогликанопатии (5 нозологических форм) Миодистрофия
- 80. Некоторые формы дистальных миопатий обусловлены мутациями в
- 81. Кавеолинопатии (7нозологических форм) Миодистрофия конечностно-поясная,
- 82. Инактивирующие мутации в гене плектина, участвующего в
- 83. Сарколеммные миопатии (20 нозологических форм) Дистрофинопатии (миодистофия
- 84. Матриксные миопатии (4 нозологические формы) Миодистрофия
- 85. Нарушения структуры белков ядерной ламины миофибрилл –
- 86. Мутации в гене ламина A/C, приводят к
- 87. Миопатия немалиновая небулин – интегральный компонент
- 88. Миотилиновые, титиновые и телетониновые конечностно-поясные миопатии 1А:
- 89. Саркомерные миопатии (15 нозологических форм)
- 90. При целом ряде миопатий причиной дистрофических процессов
- 91. Определенные гистологические аномалии характерны для пациентов с
- 92. В первом случае – это рецептор 1
- 93. Конформационные болезни мышц десминовые миопатии, обусловленные
- 94. Биохимическая классификация миодистрофий и миопатий (60 нозологических
- 95. Миодистрофии конечностно-поясные Доминантные 1А
- 96. Лице-лопаточно-плечевая мышечная дистрофия Ландузи-Дежерина – третье по
- 97. Преимущественно поражается мускулатура лица, плечевого пояса и
- 98. В области локализации мутантного локуса FSHD1 (4q35-qter),
- 99. В норме количество копий этого повтора варьирует
- 100. Предполагается, что мутации, вызывающие лице-лопаточно-плечевую миодистрофию, нарушают
- 101. Сложные эпигенетические механизмы вовлечены в реализацию этого
- 102. Спинальные амиотрофии – это гетерогенная группа наследственных
- 103. Наиболее распространенной аутосомно-рецессивной формой поражения периферического двигательного
- 104. Основными клиническими проявлениями СМА являются слабость и
- 105. СМА делят на 3 формы: болезнь Верднига-Гоффмана,
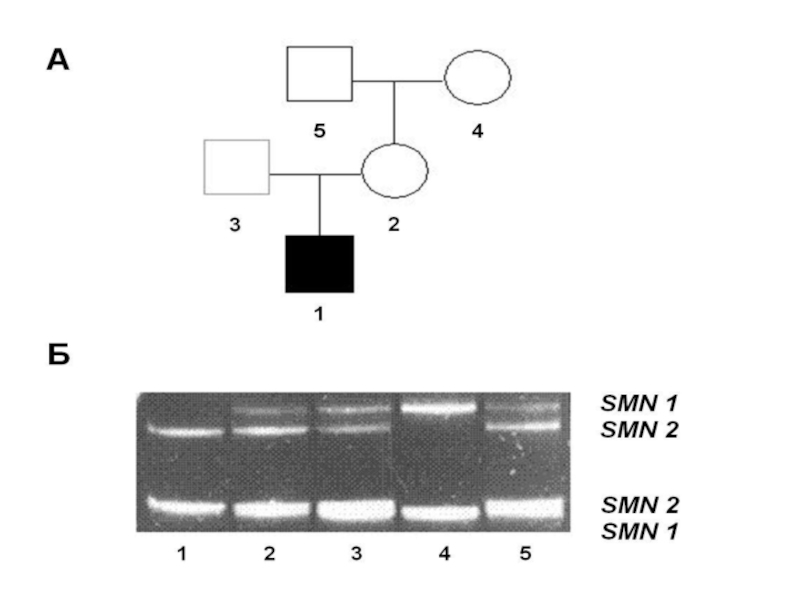
- 106. Все клинические типы СМА обусловлены мутациями в
- 107. При инактивации Smn-белка периферические двигательные нейроны теряют
- 108. В непосредственной близости от гена SMN1 идентифицирован
- 109. Ген SMN2 отличается от гена SMN1 всего
- 110. Таким образом, характер экспрессии двух гомологичных генов
- 111. Поэтому присутствие у больных СМА трех и
- 112. От 95% до 98% больных СМА имеют
- 114. Одна из главных стратегий лечения СМА направлена
- 115. Боковой амиотрофический склероз (БАС) характеризуется своеобразным сочетанием
- 116. БАС начинается в среднем возрасте и в
- 117. Для наследственных форм БАС характерна большая генетическая
- 118. Наследственные полиневропатии составляют до 60-70% всех
- 119. Клинически характеризуются прогрессирующей слабостью и атрофией дистальной
- 120. Патогенетически моторно-сенсорная невропатия делится на 2 основных
- 121. Для второго типа характерно первичное поражение аксонов, нормальная скорость проведения импульса, морфологически сохранность структуры миелина
- 122. Из сравнительно редких синдромов, отличающихся от классического
- 123. Для моторно-сенсорных полинейропатий характерна огромная генетическая гетерогенность.
- 124. Наиболее частыми являются аутосомно-доминантные демиелинизирующие полинейропатии, связанные с нарушением синтеза миелина периферических нервов
- 125. Тип 1А, обусловлен гиперпродукцией интегрального белка компактного
- 126. При типе 1B дефектным оказывается структурный белок
- 127. Относительно редкие аксональные формы аутосомно-доминантной болезни Шарко-Мари-Тута,
- 128. Синдром Дежерина-Сотта также генетически гетерогенен, но не
- 129. В настоящее время описаны около 130 Х-сцепленных
- 130. При синдромальных формах умственная отсталость может сочетаться
- 131. Кроме того, в Х-хромосоме идентифицированы 23 гена.
- 132. Описаны также более редкие аутосомные формы заболевания.
- 133. Болезнь Альцгеймера (БА) относится к большой группе
- 134. Семейные случаи БА составляют лишь небольшую часть
- 135. В настоящее время идентифицированы четыре области локализации
- 136. Наследственные формы БА вызваны мутациями в генах
- 137. В локусе AD1 идентифицирован ген АРР, кодирующий
- 138. Основной компонент старческих бляшек Аβ образуется в
- 139. Большинство идентифицированных у больных мутаций в
- 140. Более 50% всех семейных случаев БА с
- 141. Третий ген, ответственный за семейные формы БА
- 142. Гены PS1 и PS2 имеют сходную структуру
- 143. Согласно гипотезе «амилоидного каскада» мутации
- 144. Благодарю за внимание
Слайд 1ГЕНТИКА В НЕВРОЛОГИИ И ПСИХИАТРИИ
В. Н. Горбунова
Санкт-Петербургский государственный педиатрический медицинский
Слайд 2Понимание ведущей роли генетических факторов в этиологии и патогенезе многих болезней
Слайд 3Конец XX века и начало нового тысячелетия ознаменовался бурным развитием молекулярной
Слайд 4 В 1990-2000 годы, получившие название «Десятилетие
Слайд 6Среди нервно-мышечных заболеваний появились такие группы болезней как дистрофинопатии, саркогликанопатии и
Слайд 7Введено новое понятие болезней экспансии, в основе которых лежат динамические мутации,
Слайд 8В настоящее время описаны около 30 болезней экспансии, большинство из них
Слайд 9Это самая частая форма Х-сцепленной умственной отсталости у мальчиков. Психопатические и
Слайд 10Причиной заболевания является экспансия CGG-повтора, расположенного в промоторной области гена
Слайд 11В дальнейшем было показано, что в основе миотонической дистрофии лежит экспансия
Слайд 12Ведущим проявлением заболевания является миотонический синдром. Миотонические спазмы появляются в начале
Слайд 13Один из симптомов – механический валик: длительное сокращение мышцы в ответ
Слайд 14В норме количество CTG-триплетов не превышает 50. У больных это число
Слайд 15Наиболее вероятным патогенетическим механизмом миотонической дистрофии является локальное нарушение структуры хроматина
Слайд 16К болезням экспансии относится наиболее частая аутосомно-рецессивная спинальная атаксия Фридрейха, обусловленная
Слайд 17Первые признаки болезни отмечаются в 4-10 лет неуверенностью в ходьбе, шаткостью,
Слайд 18Относительно небольшие экспансии нестабильных CAG-повторов, расположенных в кодирующих областях генов, связаны
Слайд 19Это целая серия спиноцеребеллярных атаксий, хорея Гентингтона, спинально-бульбарная амиотрофия Кеннеди CAG-повторы транслируются
Слайд 20Нейродегенеративным процессам при этих болезнях предшествует накопление в ядрах клеток определенных
Слайд 21Сходный патогенетический механизм наблюдается при болезнях, вызванных экспансией GCG-триплетов, кодирующих аланин.
Слайд 22К подобным заболеваниям относятся Х-сцепленный синдром Веста, при котором тяжелая умственная
Слайд 23Таким образом, патогенетический механизм этих болезней экспансии связан с изменением конформации
Слайд 24К конформационным болезням относятся болезни Альцгеймера и Паркинсона, прионные болезни,
Слайд 25Было доказано, что развитие факоматозов обусловлено присутствием мутаций в специфической группе
Слайд 26При наследственных заболеваниях с пароксизмами, гипер- или гипо-возбудимостью вовлеченных в патологический
Слайд 27К каналопатиям относятся наследственные миотонии, периодические параличи, многие формы идиопатической эпилепсии
Слайд 28Феномен миотонии заключается во внезапном тоническом спазме мышцы, возникающем вслед за
Слайд 29Известны две клинические формы: аутосомно-доминантная врождённая миотония Томсона, характеризующаяся атлетическим телосложением,
Слайд 30Обе формы миотонии обусловлены мутациями в гене CLC1 хлорного канала скелетных
Слайд 31Наследственная пароксизмальная миоплегия характеризуется приступами резкой слабости, вплоть до полного паралича
Слайд 32Наиболее распространенной является аутосомно-доминантная гипокалиемическая форма, или болезнь Шахновича-Вестфаля. Приступы появляются с
Слайд 33Краниальная мускулатура, как правило, не страдает, сознание сохранено. Длительность приступа от
Слайд 34Гиперкалиемическая форма пароксизмальной миоплегии, или болезнь Гармстропа отличается слабостью мимической и
Слайд 35При гипокалиемическом параличе, обусловленном мутациями в гене CACNA1S (1q31-32), дефектным оказывается
Слайд 36Мутации в гене SCN4 (17q23.1), кодирующем альфа-4-субъединицу потенциал-зависимого натриевого канала, обнаруживаются
Слайд 37В результате дефекта натриевого канала происходит генерация потенциала действия и деполяризация
Слайд 38Большинство наследственных абсанс-эпилепсий обусловлены повреждением нейрональных каналов, имеющих непосредственное отношение к
Слайд 39Большинство идиопатических эпилепсий относятся к многофакторным заболеваниям с выраженной генетической компонентой
Слайд 40В настоящее время найдено сцепление различных форм идиопатической генерализованной эпилепсии со
Слайд 41Среди них гены, участвующие в поддержании в ЦНС гомеостаза кальция (CACNA1H,
Слайд 42Значительно более редкими являются моногенные формы эпилепсии, которые могут входить в
Слайд 43Наследственные формы идиопатической эпилепсии обусловлены спецефическими дефектами генов, контролирующих возбудимость мембран,
Слайд 44Примерами являются гены нейрональных потенциал-зависимых калиевых каналов — KCNQ2 и KCNQ3
Слайд 454 моногенных формы гемиплегической мигрени обусловлены мутациями в генах нейрональных
Слайд 46Таким образом, в конце прошлого века были созданы предпосылки для перехода
Слайд 47Обсудим преимущества подобной патогенетической системы классификации болезней нервной системы на примере
Слайд 48Клиническая классификация прогрессирующих мышечных дистрофий (ПМД) основана на характере распространения мышечных
Слайд 49Морфологически в мышечных волокнах при миопатиях выявляются дистрофические и некротические изменения,
Слайд 50В сыворотке крови больных увеличено содержание саркоплазматических ферментов – креатинфосфокиназы, альдолазы,
Слайд 51Наиболее распространенной и злокачественной формой нервно-мышечной патологии детского возраста является Х-сцепленная
Слайд 52Первые признаки миодистрофии Дюшенна появляются в возрасте 2-7 лет. При начале
Слайд 54В некоторых случаях дюшенно-подобные миодистрофии наследуются по аутосомно-рецессивному типу. К подобным
Слайд 55Конечностно-поясные миодистрофии – это гетерогенная группа заболеваний с преимущественной локализацией дистрофического
Слайд 56Больные начинают испытывать затруднения при беге и ходьбе в 15-20 лет,
Слайд 57Генетическое разнообразие наследственных конечностно-поясных миодистрофий очень велико. Идентифицированы мутантные гены для
Слайд 58При некоторых формах конечностно-поясная миодистрофия сочетается с выраженной патологией других систем,
Слайд 59В самостоятельную клиническую группу традиционно выделяют врожденные непрогрессирующие миопатии. Наиболее частой
Слайд 60Патологические процессы при некоторых врожденных непрогрессирующих миопатиях обусловлены отложением в миофибриллах
Слайд 61При немалиновой миопатии в мышечных клетках пациентов присутствуют нитеобразные патологические фибриллярные
Слайд 62Определенные гистологические аномалии выявляются также у больных миотубулярной миопатией и болезнью
Слайд 63Нерастворимые включения в мышечных клетках характерны и для других миопатий, дебютирующих
Слайд 64В особую группу выделяют медленно прогрессирующие митохондриальные миопатии, клиническая картина которых
Слайд 65Наследственные дефекты различных мышечных ферментов являются причиной развития относительно доброкачественных метаболических
Слайд 66Белковые продукты многих генов, связанных с наследственными болезнями мышц, ассоциированы с
Слайд 67Основными функциями подобных белков являются:
стабилизация сарколеммы мышечного волокна за счет
обеспечение трансмембранного информационного потока
формирование нейромышечного синапса
Слайд 68К подобным белкам относится дистрофин – стержневидный белок, принадлежащий к спектрин/α-актининовому
Слайд 70При миодистрофии Дюшенна/Беккера, также как при аутосомно-рецессивных дюшенно-подобных и некоторых конечностно-поясных
Слайд 71При миодистрофии Дюшенна/Беккера разрушение дистрофин-ассоциированного комплекса белков происходит за счет мутаций
Таким образом эти заболевания относятся к
дистрофинопатиям
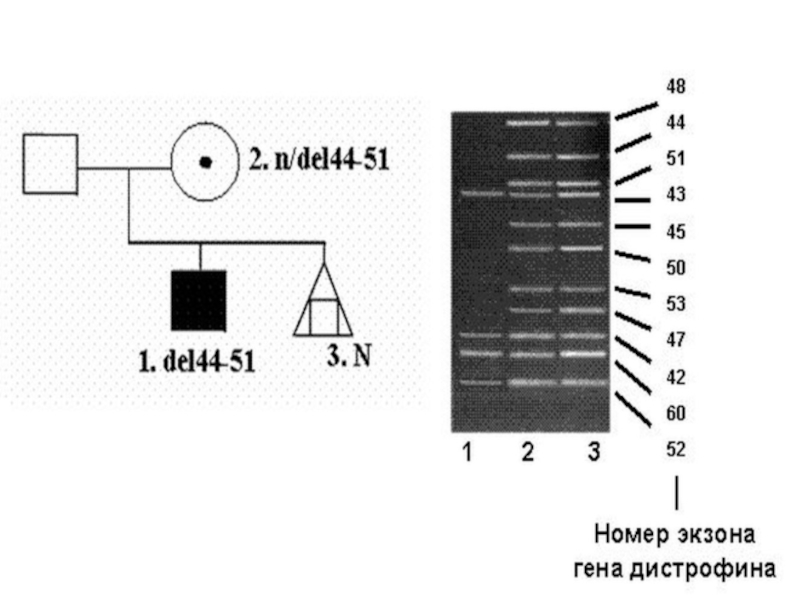
Слайд 72В 65-70% случаев у больных миодистрофией Дюшенна/Беккера диагностируются протяженные внутригенные делеции,
Слайд 73Различия заключаются в том, что при миодистрофии Дюшенна делеции сопровождаются сдвигом
Слайд 74В гене DMD идентифицированы также относительно небольшие перестройки и нонсенс-мутации, в
Слайд 75Молекулярная диагностика делеций в гене DMD проводится с использованием мультиплексной ПЦР,
Слайд 77Разрушение дистрофин-ассоциированного комплекса белков при аутосомно-рецессивных дюшенно-подобных и некоторых конечностно-поясных
Слайд 78Мутации в генах дистрогликанов не обнаружены. Но при врожденных миодистрофиях, сопровождающихся
Слайд 79Дистрогликанопатии
(5 нозологических форм)
Миодистрофия врожденная, прогрессирующая с умственной отсталостью, тип
Уолкера-Варбурга синдром
Миодистрофия конечностно-поясная, аутосомно-рецессивная, 2I
Миодистрофии врожденные 1С и 1D,
с неврологическими аномалиями
Слайд 80Некоторые формы дистальных миопатий обусловлены мутациями в гене кавеолина – основного
Эти миодистрофии получили название кавеолинопатии
Слайд 81Кавеолинопатии
(7нозологических форм)
Миодистрофия конечностно-поясная, аутосомно-доминантная, 1C
миопатия дистальная
болезнь волнистых
Миодистрофия конечностно-поясная, аутосомно-рецессивная, 2B
Миопатия дистальная, Миоши
Слайд 82Инактивирующие мутации в гене плектина, участвующего в связи цитоскелета мышечного волокна
Слайд 83Сарколеммные миопатии
(20 нозологических форм)
Дистрофинопатии (миодистофия Дюшенна/Беккера)
Саркогликанопатии (4 формы конечностно-поясных миодистофий)
Дистрогликанопатии (5
Кавеолинопатии (7 форм конечностно-поясных и дистальных миодистофий)
Плектинопатия (миодистофия с буллезным эпидермолизом)
Слайд 84Матриксные миопатии
(4 нозологические формы)
Миодистрофия врожденная, мерозин-дефицитная, аутосомно-рецессивная
Миопатия врожденная, интегрин
Миопатия Бетлема, доброкачественная, врожденная с контрактурами
Миодистрофия Ульриха, врожденная, склероатоническая
Слайд 85Нарушения структуры белков ядерной ламины миофибрилл – ламинопатии (3 нозологические формы)
миодистрофия с контрактурами Эмери-Дрейфуса, Х-сцепленная
миодистрофия с контрактурами Эмери-Дрейфуса, аутосомно-рецессивная, аутосомно-доминантная
Слайд 86Мутации в гене ламина A/C, приводят к 13 заболеваниям, включающим наряду
Слайд 87Миопатия немалиновая
небулин – интегральный компонент тонких (актиновых) и толстых (миозиновых)
тропомиозин 2 – основной белковый компонент толстых филамент саркомера
тропомиозин 3 – главный белковый компонент латеральных Z-дисков
тропонин T1 - член Ca+-зависимого тропонинового комплекса, взаимодействующего с тропомиозиновым димером саркомера
α-актин – основной белковый компонент тонких филамент саркомера
Слайд 88Миотилиновые, титиновые и телетониновые конечностно-поясные миопатии
1А: миотилин – гигантский саркомерный белок,
2J: титин или коннектин – гигантский
белок, занимающий половину саркомера между Z- и M-слоями
2А: калпаин-3 – мышечная протеаза, лиганд титина
2G: телетонин – саркомерный 19-кД белок, располагающийся в Z-дисках, субстрат титина
Слайд 89Саркомерные миопатии
(15 нозологических форм)
Немалиновая миопатия
(6 нозологических
Миотилиновые, титиновые и телетониновые конечностно-поясные миопатии
(9 нозологических форм)
Слайд 90При целом ряде миопатий причиной дистрофических процессов является накопление в цитоплазме
Слайд 91Определенные гистологические аномалии характерны для пациентов с болезнью центрального стержня и
Слайд 92В первом случае – это рецептор 1 рионадина – кальций высвобождающего
Слайд 93Конформационные болезни мышц
десминовые миопатии, обусловленные накоплением цитоплазматических филаментных включений
миопатии
конечностно-поясная миодистрофия с ранним началом костной болезни Пагета и деменцией, обусловленная дефектом системы убиквитин-зависимой деградации белков
окулофарингеальная миопатия, при которой
тубулофиламентные включения образуются за счет увеличения длины полиаланиновой цепочки в поли(А)-связывающим белке 2
Слайд 94Биохимическая классификация миодистрофий и миопатий
(60 нозологических форм)
Сарколеммные миопатии (20)
Матриксные миопатии (4)
Ламинопатии (3)
Саркомерные миопатии (15)
Дефекты дифференцировки (2)
Конформационные болезни мышц (6)
Митохондриальные миопатии
Метаболические миопатии
Слайд 95Миодистрофии конечностно-поясные
Доминантные
1А - миотилин
1B - ламин A/C
1C - кавеолин-3
Рецессивные
2A - калпаин-3
2B - дисферлин
C,D,E,F – саркогликаны
2G - телетонин
2H -убиквитин лигаза
2I – гликозил-трансфераза
2J - титин