- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физиология микроорганизмов. Антибиотики и ХТП презентация
Содержание
- 1. Физиология микроорганизмов. Антибиотики и ХТП
- 2. История 1891 г. – Д.А. Романовский
- 3. Зинаида Виссарионовна Ермольева – создатель отечественного пенициллина
- 4. История стрептомицин (1944 г.),
- 5. В результате применения антибиотиков: сокращены случаи
- 6. Антибиотики Термин «антибиотик» произошел от греческих
- 7. Классификация антибиотиков По источникам выделения; По способу
- 8. Способы получения антибиотиков Биологический синтез – антибиотики,
- 9. Классификация антибиотиков по химическому строению β-Лактамы
- 10. Классификация антибиотиков по источникам выделения Антибиотики вырабатываемые:
- 11. Классификация антибиотиков по спектру биологического действия
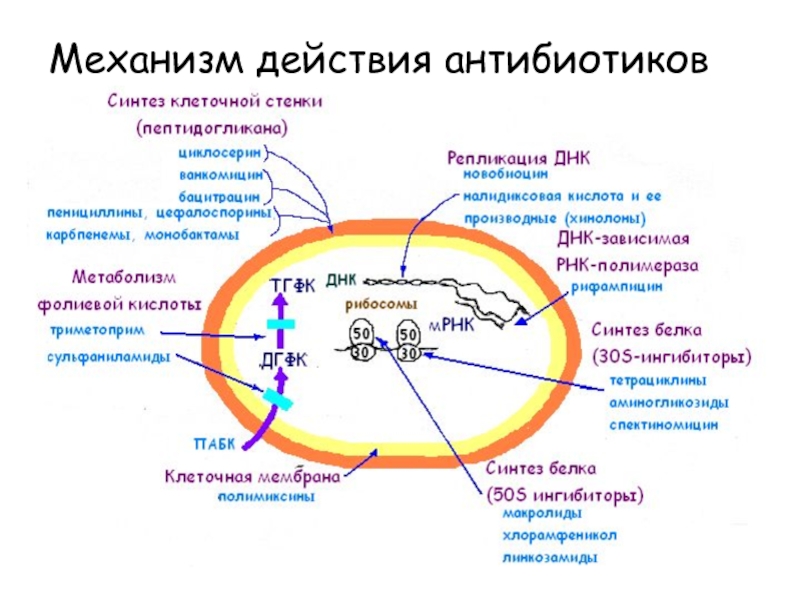
- 12. Механизм действия антибиотиков
- 13. Общие принципы реализации антимикробного эффекта: антибиотик
- 14. Побочное действие антибиотиков На макроорганизм Токсические
- 15. Лекарственная устойчивость микроорганизмов и пути ее преодоления
- 16. Устойчивость бактерий к антибиотикам
- 17. Генетические модификации Наследуемый признак. Детерминируется внехромасомным
- 18. Множественная лекарственная устойчивость С высокой частотой
- 19. Механизмы резистентности Нарушение проницаемости
- 20. Механизмы резистентности Инактивация антибиотика β-лактамазы
- 21. ИНАКТИВАЦИЯ ПЕНИЦИЛЛИНА БАКТЕРИЯМИ H.INFLUENZAE, ПРОДУЦИРУЮЩИМИ β-ЛАКТОМАЗУ
- 22. Механизмы резистентности Активное выведение
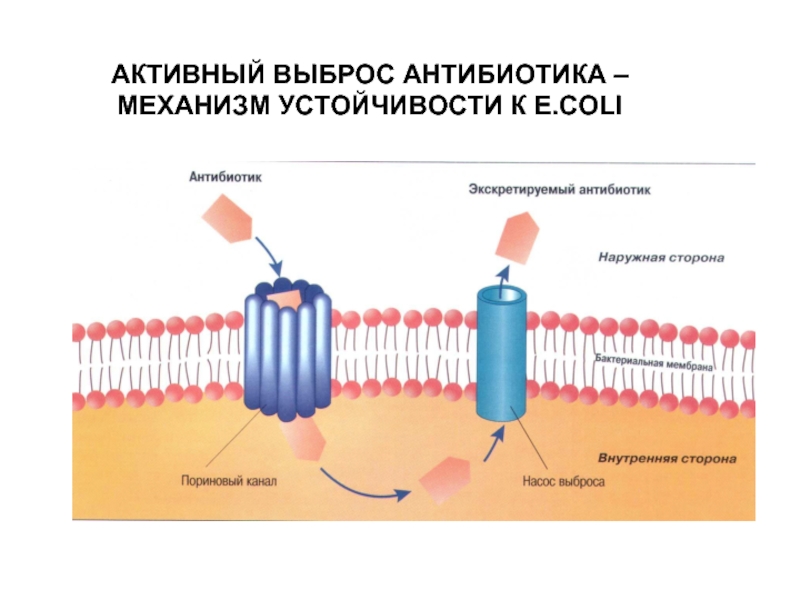
- 23. АКТИВНЫЙ ВЫБРОС АНТИБИОТИКА – МЕХАНИЗМ УСТОЙЧИВОСТИ К E.COLI
- 24. В ответ на применение антибиотиков микроорганизмы ответили
- 25. Пути преодоления антибиотикорезистентности Получение и введение в
- 26. Методы определения чувствительности бактерий к антибиотикам Серийных
- 27. Метод серийных разведений ЛД – минимальная концентрация антибиотика, подавляющая видимый рост исследуемого микроорганизма
- 28. Диско-диффузионный метод
- 29. Метод Е - тестов МПК
- 30. Метод Е-тестов Е тест – пластиковая полоска
Слайд 1 микробиология Раздел 2 Физиология микроорганизмов Антибиотики и ХТП доцент кафедры микробиологии и вирусологии, к.б.н. Муштоватова
Слайд 2История
1891 г. – Д.А. Романовский доказал возможность воздействия лекарственного средства
1929 г. – А. Флеминг получил пенициллин.
1932 г. – Г. Домагк синтезировал стрептоцид, который явился родоначальником сульфаниламидных препаратов.
1935 г. – Ваксман предположил, что микроорганизмы , продуценты антибиотиков, находятся в почве.
1935 г. – Дюбо из B. вrevis, выделил антибиотическое вещество – грамицидин.
1940 г. – в Англии начаты интенсивные исследования пенициллина.
Слайд 3Зинаида Виссарионовна Ермольева – создатель отечественного пенициллина
З.В. Ермольева и сэр
Говард
В.А. Каверин на кафедре у
З.В. Ермольевой. 1960-е годы
Слайд 4История
стрептомицин (1944 г.),
полимиксин (1947 г.),
хлортетрациклин (1948 г.)
бензилпенициллин,
нистатин (1950 г.),
эритромицин (1952 г.),
новобиоцин (1953 г.),
олеандомицин (1954 г.) и др.
Слайд 5В результате применения антибиотиков:
сокращены случаи летальных исходов от инфекционных заболеваний;
смягчена тяжесть
уменьшено количество постинфекционных осложнений;
существенно увеличена продолжительность жизни человека.
Слайд 6Антибиотики
Термин «антибиотик» произошел от греческих слов:
Anti - против
Bios –
или от латинского antibiotica – средство против жизни.
Это группа активных метаболических продуктов, избирательно подавляющих рост и размножение бактерий, а также приводящая к их гибели.
Слайд 7Классификация антибиотиков
По источникам выделения;
По способу получения;
По спектру действия;
По химическому составу;
По механизму
Слайд 8Способы получения антибиотиков
Биологический синтез – антибиотики, полученные из природных источников (пенициллин,
Химический синтез – антибиотики, полученные путем химического синтеза (хинолоны, фторхинолоны).
Комбинированный способ – антибиотики полусинтетические, получены комбинированием первых двух методов (метициллин, оксациллин).
Слайд 9Классификация антибиотиков по химическому строению
β-Лактамы (пенициллины, цефалоспорины, карбапенемы).
Аминогликозиды (стрептомицин, гентамицин).
Тетрациклины
Макролиды (эритромицин, олеандомицин).
Линкозамиды (линкомицин).
Гликопептиды (ванкомицин).
Рифампицины (рифампицин).
Полимиксины.
Полиены (нистатин, леварин, амфотерицин В).
Сульфаниламиды.
Ингибиторы ДНК-гиразы (хинолоны, фторхинолоны).
Нитрофураны (фуразолидон).
Дополнительная группа (хлорамфеникол, фузидиевая кислота).
Слайд 10Классификация антибиотиков по источникам выделения
Антибиотики вырабатываемые:
микроорганизмами (грамицидины, полимиксины), в том
плесневыми грибками: (пенициллин, гризиофульвин).
лишайниками, водорослями и низшими растениями (усниновая кислота).
высшими растениями - фитонциды (аллицин, рафанин, фазеолин).
Антибиотики животного происхождения (лизоцим, экмолин, интерферон).
Слайд 11Классификация антибиотиков по спектру биологического действия
Противобактериальные антибиотики узкого спектра действия:
Противобактериальные антибиотики широкого спектра действия: тетрациклины, хлорамфеникол, аминогликозиды, полимиксины, полусинтетические пенициллины (ампициллин, карбенициллин).
Противотуберкулезные антибиотики: стрептомицин, канамицин, циклосерин.
Противогрибковые антибиотики: нистатин, гризеофульвин, амфотерицин В и др.
Противоопухолевые антибиотики: актиномицин С, митомицин С, адриамицин (доксорубицин), рубомицины и др.
Слайд 13Общие принципы реализации антимикробного эффекта:
антибиотик должен:
связаться с бактерией и
быть доставлен к месту действия;
вступить во взаимодействие с внутриклеточными мишенями.
Слайд 14Побочное действие антибиотиков
На макроорганизм
Токсические реакции: гепатотоксическое действие (тетрациклины, эритромицин), нефротоксическое
Дисбиозы.
Воздействие на иммунитет: аллергические реакции, иммунодепрессия (хлорамфеникол угнетает антителообразование, тетрациклины – фагоцитоз).
На микроорганизм
Появление атипичных форм микроорганизмов (образование L-форм).
Формирование антибиотико-резистентности.
Слайд 15Лекарственная устойчивость микроорганизмов и пути ее преодоления
При изучении действия трепанового
По мере увеличения ХТП увеличивалось число сообщений о таких наблюдениях.
Т.о. антибиотикорезистентные штаммы стали распространяться сразу после внедрения антибиотиков в практику.
В настоящее время эта проблема является одной из важнейших в медицине.
Слайд 17Генетические модификации
Наследуемый признак.
Детерминируется внехромасомным R фактором - или геном резистентности.
Ген
Слайд 18Множественная лекарственная устойчивость
С высокой частотой R- гены передаются плазмидами и транспозонами.
Один
Плазмида несет несколько транспозонов, контролирующих резистентность к разным ХТП. В результате формируется множественная лекарственная устойчивость.
Слайд 19Механизмы резистентности
Нарушение проницаемости клеточных оболочек. Причина – полная или частичная
Модификация мишеней – изменение структуры чувствительной к действию антибиотиков мишени.
Изменение:
белков рибосом 70 S приводит к устойчивости к стрептомицину, макролидам.
структуры бактериальных гираз в результате мутации придает устойчивость к хинолонам.
РНК- полимеразы – к рифамицину.
Пенициллинсвязывающих белков – к бета-лактамам.
Слайд 20Механизмы резистентности
Инактивация антибиотика
β-лактамазы → гидролиз β-лактамного кольца (бета-лактамазы –
Ингибиторы β-лактамаз: клавулановая кислота, (амоксиклав,). Эти препараты в своем составе имеют бета-лактамное кольцо и связываются с бета-лактамазами, предотвращая разрушение антибиотика
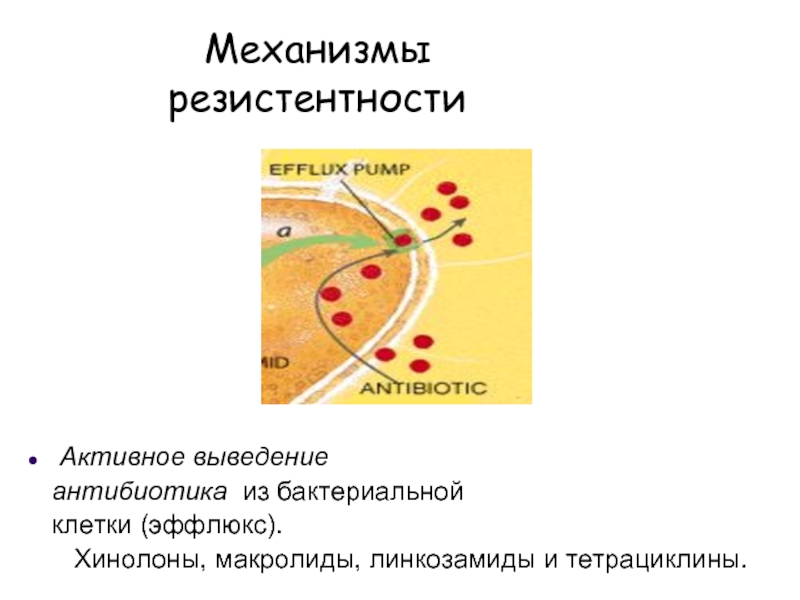
Слайд 22Механизмы
резистентности
Активное выведение
антибиотика из бактериальной
клетки (эффлюкс).
Хинолоны, макролиды, линкозамиды и тетрациклины.
Слайд 24В ответ на применение антибиотиков микроорганизмы ответили биологическими реакциями, сила которых
На каждый новый антибиотик появляются резистентные к нему штаммы.
Появляются новые возбудители резистентные к антибиотикам (энтерококки, Acinetobacter и Xanthomonas).
Необходимо постоянно искать пути преодоления антибиотикорезистентности.
Слайд 25Пути преодоления антибиотикорезистентности
Получение и введение в практику новых антибиотиков.
Полиантибиотикотерапия.
Применение антибиотиков только
Выявление антибиотикорезистентных штаммов и определение препаратов для их уничтожения.
Применение в животноводстве антибиотиков, не применяющихся в медицине.
Запрещение применения в качестве консервантов пищевых продуктов антибиотиков, применяемых в мед. практике.
Определение чувствительности микроорганизмов к антибиотикам.
Слайд 26Методы определения чувствительности бактерий к антибиотикам
Серийных разведений
В агаре, в бульоне
(макровариант,
Диффузионные
Диско-диффузионный
Эпсилометрический (Е-тест)
Слайд 27Метод серийных разведений
ЛД – минимальная концентрация антибиотика, подавляющая видимый рост исследуемого
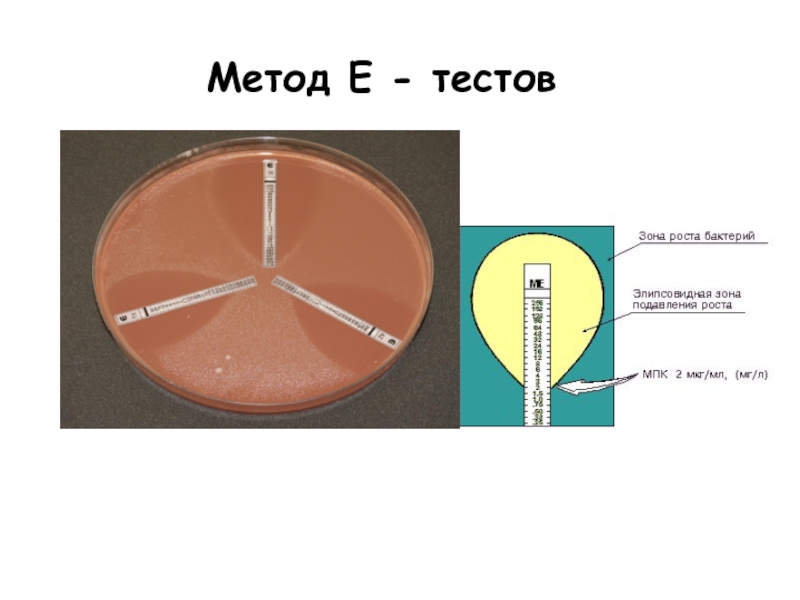
Слайд 30Метод Е-тестов
Е тест – пластиковая полоска с нанесенным градиентом концентрации антибиотика.
Метод
Зона задержки роста имеет форму эллипса, размеры которого увеличиваются от меньшей концентрации антибиотика к большей.