- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физико-химические свойства лекарственных препаратов железа презентация
Содержание
- 1. Физико-химические свойства лекарственных препаратов железа
- 2. Объект исследования: Сорбифер Состав: Железа (II) сульфат
- 3. Методы исследования: -Трилонометрический
- 4. Приготовление водных растворов железа (III) и определение
- 5. Приготовление водных растворов железа и определение физико-химических
- 6. График зависимости величины светопропускания растворов от их
- 7. Приготовление водных растворов железа (II) и
- 8. Выводы Взаимодействие соли Мора с перманганатом калия:
- 9. СПАСИБО ЗА ВНИМАНИЕ
Слайд 1ГБОУ ВПО Уральский Государственный Медицинский Университет
Министерства здравоохранения Российской Федерации
Кафедра общей химии
Учебная
«ИССЛЕДОВАНИЕ ФИЗИКО – ХИМИЧЕСКИХ СВОЙСТВ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ЖЕЛЕЗА.
СОРБИФЕР ДУРУЛЕС»
Состав группы: Боровикова И. А., Аввакумова А. М.,
Беззубенко С.В.
ОЛД-212
Научный руководитель: доцент, доктор технических наук,
кандидат химических наук Белоконова Н. А.
Екатеринбург
2016
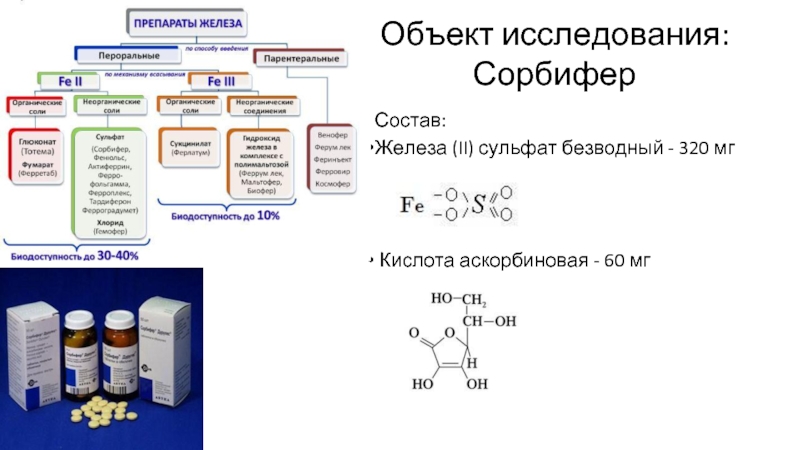
Слайд 2Объект исследования:
Сорбифер
Состав:
Железа (II) сульфат безводный - 320 мг
Кислота аскорбиновая -
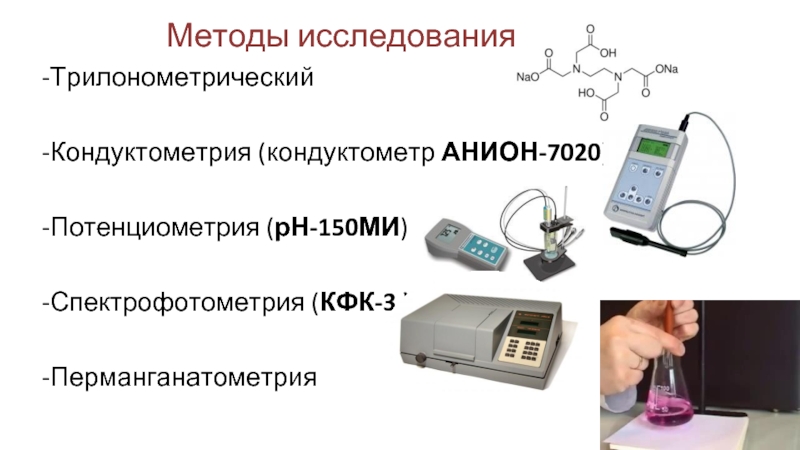
Слайд 3Методы исследования:
-Трилонометрический
-Кондуктометрия (кондуктометр
-Потенциометрия (рН-150МИ)
-Спектрофотометрия (КФК-3 )
-Перманганатометрия
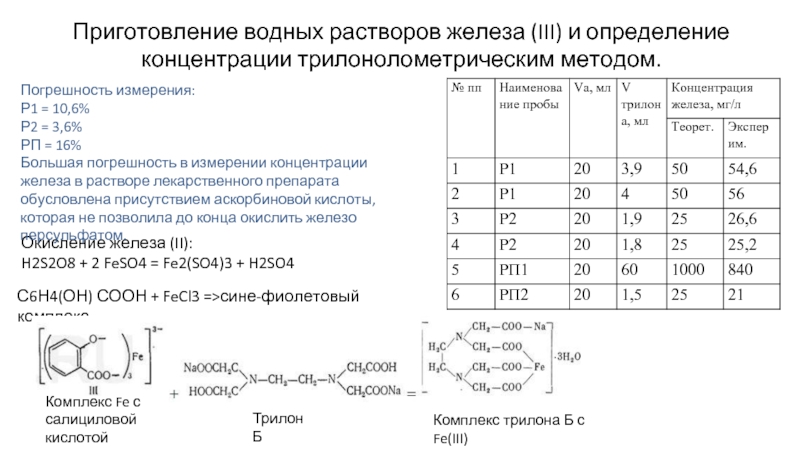
Слайд 4Приготовление водных растворов железа (III) и определение концентрации трилонолометрическим методом.
Окисление железа
H2S2O8 + 2 FeSO4 = Fe2(SO4)3 + H2SO4
С6Н4(ОН) СООН + FeCl3 =>сине-фиолетовый комплекс
Трилон Б
Комплекс трилона Б с Fe(III)
Погрешность измерения:
Р1 = 10,6%
Р2 = 3,6%
РП = 16%
Большая погрешность в измерении концентрации железа в растворе лекарственного препарата обусловлена присутствием аскорбиновой кислоты, которая не позволила до конца окислить железо персульфатом.
Комплекс Fe с салициловой кислотой
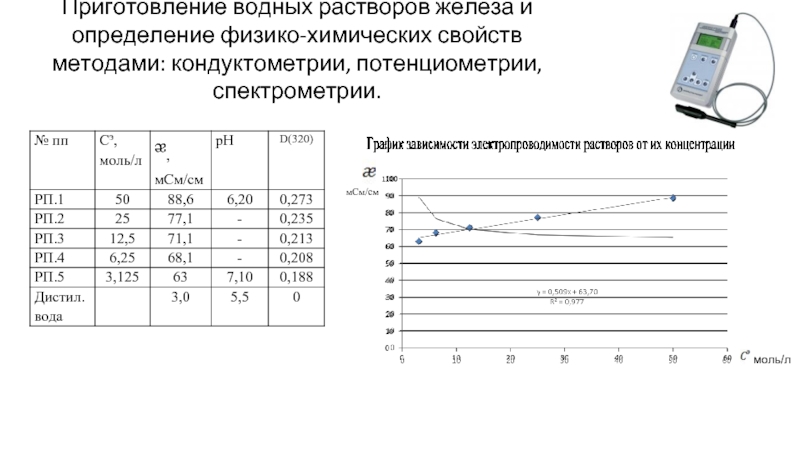
Слайд 5Приготовление водных растворов железа и определение физико-химических свойств методами: кондуктометрии, потенциометрии,
моль/л
мСм/см
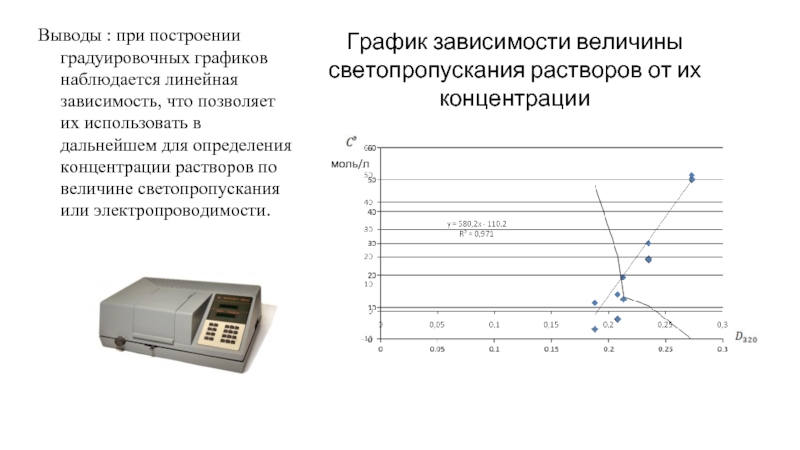
Слайд 6График зависимости величины светопропускания растворов от их концентрации
Выводы : при построении
моль/л
Слайд 7
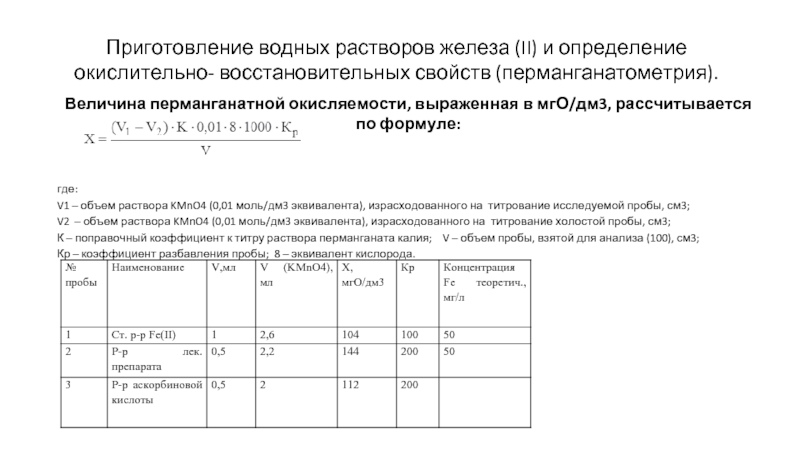
Приготовление водных растворов железа (II) и определение окислительно- восстановительных свойств (перманганатометрия).
Величина
где:
V1 – объем раствора KMnO4 (0,01 моль/дм3 эквивалента), израсходованного на титрование исследуемой пробы, см3;
V2 – объем раствора KMnO4 (0,01 моль/дм3 эквивалента), израсходованного на титрование холостой пробы, см3;
К – поправочный коэффициент к титру раствора перманганата калия; V – объем пробы, взятой для анализа (100), см3;
Кр – коэффициент разбавления пробы; 8 – эквивалент кислорода.
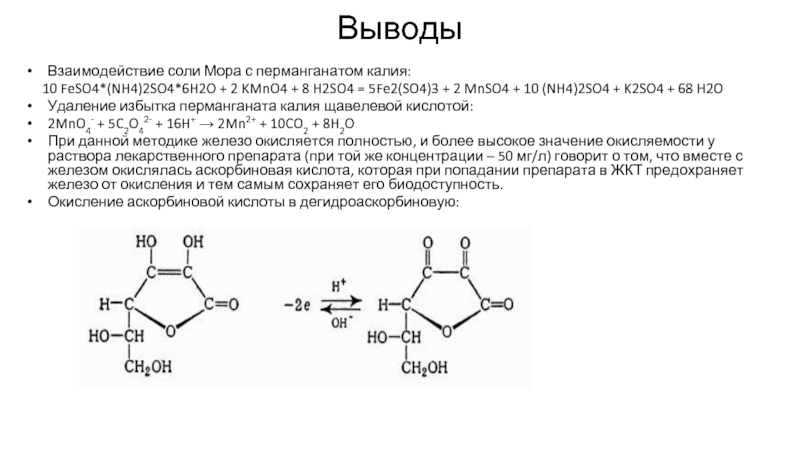
Слайд 8Выводы
Взаимодействие соли Мора с перманганатом калия:
10 FeSO4*(NH4)2SO4*6H2O +
Удаление избытка перманганата калия щавелевой кислотой:
2MnO4- + 5C2O42- + 16H+ → 2Mn2+ + 10CO2 + 8H2O
При данной методике железо окисляется полностью, и более высокое значение окисляемости у раствора лекарственного препарата (при той же концентрации – 50 мг/л) говорит о том, что вместе с железом окислялась аскорбиновая кислота, которая при попадании препарата в ЖКТ предохраняет железо от окисления и тем самым сохраняет его биодоступность.
Окисление аскорбиновой кислоты в дегидроаскорбиновую: