- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Броматометрия. (Лекция 10) презентация
Содержание
- 1. Броматометрия. (Лекция 10)
- 2. План Сущность броматометрии Индикаторы метода броматометрии Применение
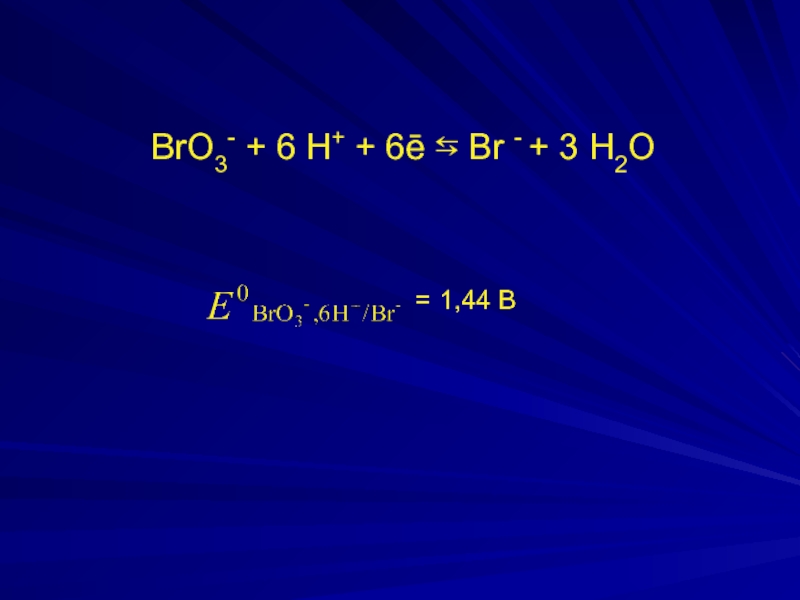
- 3. BrO3- + 6 H+ + 6ē
- 4. Стандартизацию раствора КBrO3 проводят по As2O3, Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, [H2N-NH2]∙H2SO4
- 5. После ТЭ BrO3- + 5 Br
- 6. Применение броматометрии восстановители способом прямого
- 7. Определение оксида мышьяка(III) As2O3 +
- 8. Определение сурьмы(III) 3 H2[SbCl5] + Cl- –
- 11. Определение натрия салицилата BrO3- + 5
- 12. Определение фенола и резорцина
- 13. Определение катионов металлов,
- 14. Нитритометрия
- 15. Как окислитель нитрит натрия используют для
- 16. Реакция диазотирования протекает с первичными ароматическими аминами
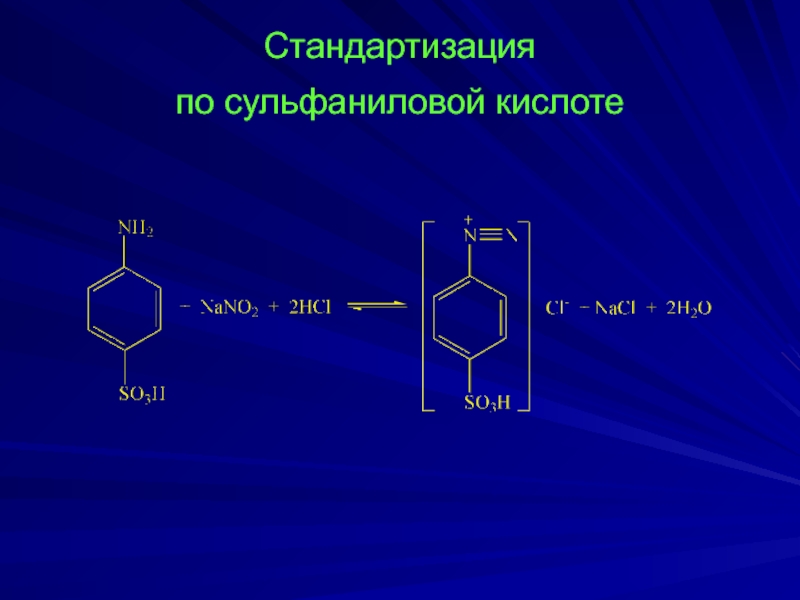
- 17. Стандартизация по сульфаниловой кислоте
- 18. После ТЭ 2 I- +
Слайд 2План
Сущность броматометрии
Индикаторы метода броматометрии
Применение броматометрии
Бромометрия
Нитритометрия
Условия реакции диазотирования
Определение КТТ в нитритометрии
Применение нитритометрии
Слайд 4Стандартизацию раствора КBrO3
проводят по
As2O3, Na2C2O4, H2C2О4·2H2О,
(NH4)2C2O4, [H2N-NH2]∙H2SO4
Слайд 6Применение броматометрии
восстановители способом прямого титрования: As(III), Sb(III), Fe(II), H2O2, N2H4,
окислители (перманганат, гипохлориты и др.) способом обратного титрования.
Слайд 7 Определение оксида мышьяка(III)
As2O3 + 6 OH- ⇆ 2 AsO33- +
AsO33- + 3 H+ ⇆ Н3AsO3
3 Н3AsO3 + H2O – 2ē ⇆ H3AsO4 + 2 H+
1 BrO3- + 6 H+ + 6ē ⇆ Br - + 3 H2O
3 Н3AsO3 + BrO3- ⇆ 3 H3AsO4 + Br -
fэ(As2O3 ) = ¼
Слайд 8Определение сурьмы(III)
3 H2[SbCl5] + Cl- – 2ē ⇆ H[SbCl6] + H+
1 BrO3- +
Фактор эквивалентности As2O3 равен 1/4.
3 H2[SbCl5] + 3 Cl- + BrO3- + 3 H+ ⇆ 3 H[SbCl6] + Br - + 3 H2O
fэ(Sb) = 1/2
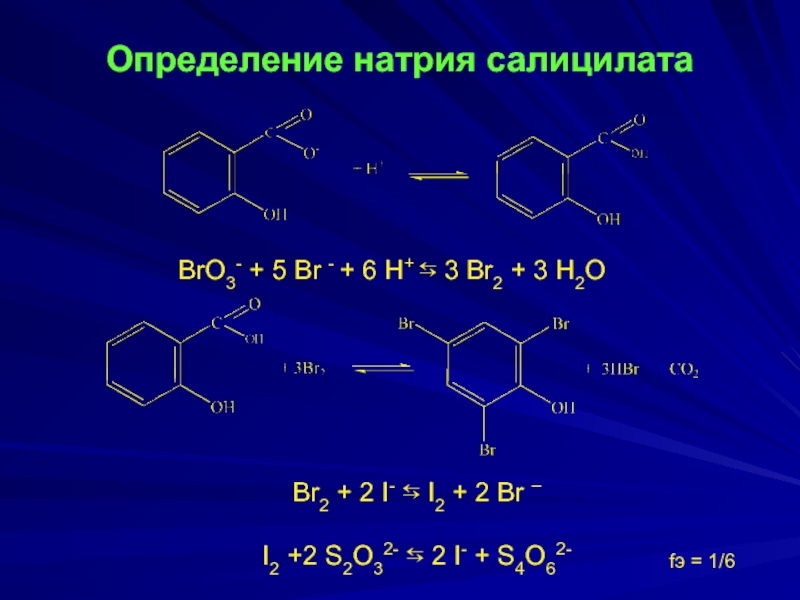
Слайд 11
Определение натрия салицилата
BrO3- + 5 Br - + 6 H+ ⇆
Br2 + 2 I- ⇆ I2 + 2 Br –
I2 +2 S2O32- ⇆ 2 I- + S4O62-
fэ = 1/6
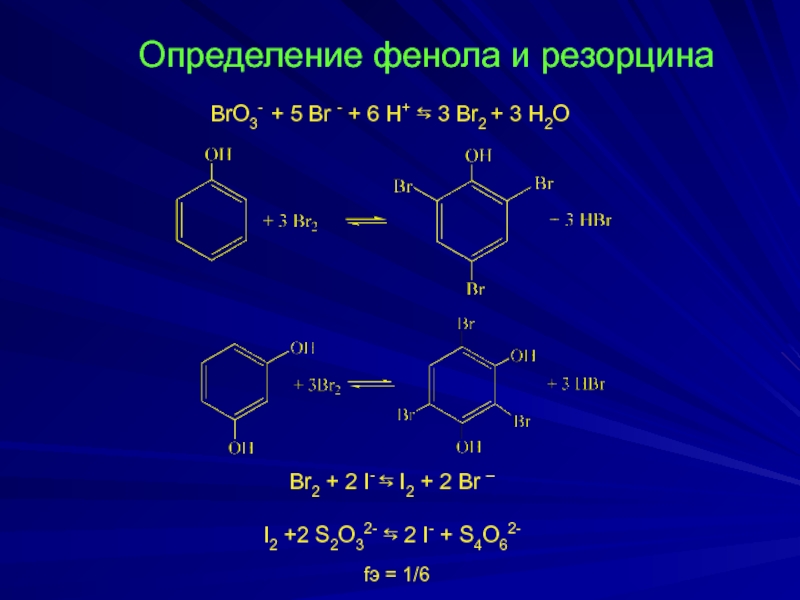
Слайд 12
Определение фенола и резорцина
BrO3- + 5 Br - + 6
Br2 + 2 I- ⇆ I2 + 2 Br –
I2 +2 S2O32- ⇆ 2 I- + S4O62-
fэ = 1/6
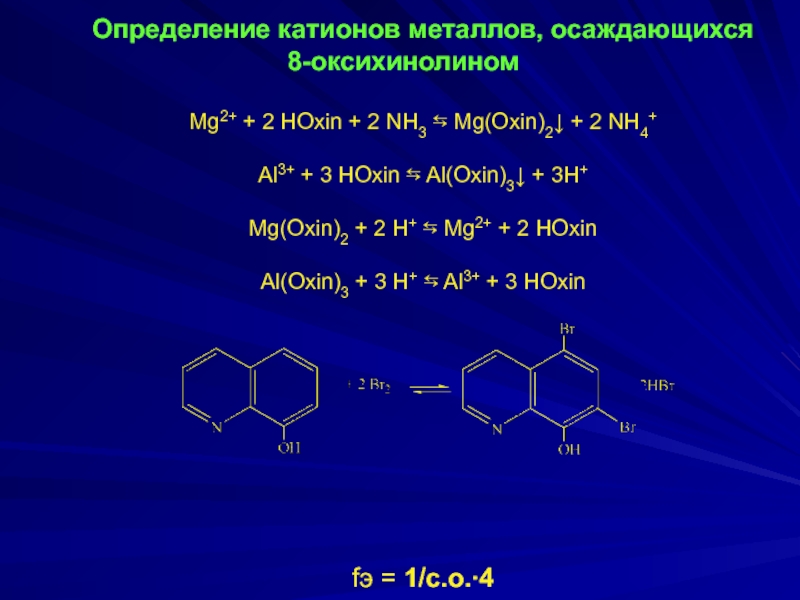
Слайд 13
Определение катионов металлов, осаждающихся 8-оксихинолином
Mg2+ + 2 HOxin + 2
Al3+ + 3 HOxin ⇆ Al(Oxin)3↓ + 3H+
Mg(Oxin)2 + 2 H+ ⇆ Mg2+ + 2 HOxin
Al(Oxin)3 + 3 H+ ⇆ Al3+ + 3 HОxin
fэ = 1/с.о.∙4
Слайд 15
Как окислитель нитрит натрия используют для определения восстановителей Sn2+, Fe2+, As2O3,
HNO2 + H+ + ē ⇆ NO + H2O
= +0,98 B
= +0,94 B
f э (NaNO2) = 1
Как восстановитель нитрит натрия используют для определения перманганата, хлора, йодата и др.
HNO2 + H2O – 2ē ⇆ NO3- + 3 H+
f э (NaNO2) = 1/2
Слайд 16Реакция диазотирования протекает с первичными ароматическими аминами в кислой среде Ar


![Стандартизацию раствора КBrO3проводят по As2O3, Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, [H2N-NH2]∙H2SO4](/img/tmb/4/362003/345c54ff95b80a42060964075e3fe262-800x.jpg)



![Определение сурьмы(III) 3 H2[SbCl5] + Cl- – 2ē ⇆ H[SbCl6] + H+ 1 BrO3- + 6 H+ +](/img/tmb/4/362003/213570cb18180eba51d8c798f66cf3dc-800x.jpg)