- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биохимические механизмы нарушения обмена углеводов и липидов презентация
Содержание
- 1. Биохимические механизмы нарушения обмена углеводов и липидов
- 2. Функции углеводов энергообеспечения органов и тканей.
- 3. Глюкоза играет главную роль в метаболизме, так
- 4. Гликолиз - это серия реакций, в результате
- 5. Гликоген - основная форма депонирования глюкозы в
- 6. В результате сложного взаимодействия углеводного обмена в
- 7. Референтные значения глюкозы (ВОЗ, 1999г.) Цельная кровь
- 8. Факторы, влияющие на уровень гликемии: 1. Вид
- 9. Распределение употребляемой глюкозы в органах Скелетные
- 10. Эффекты инсулина в органах-мишенях
- 13. Инсулин обладает целым спектром свойств, направленных на
- 14. Глюкагон также обладает несколькими важными функциями, направленными
- 15. NH2 H
- 16. NH
- 17. *AGE повышают жесткость белков. Уменьшают скорость удаления
- 18. Основной компонент HbA1 - это HbA1c –
- 19. Общий гемоглобин = Hb+ HbO2 +
- 20. По данным таблицы, можно получить ориентировочное представление
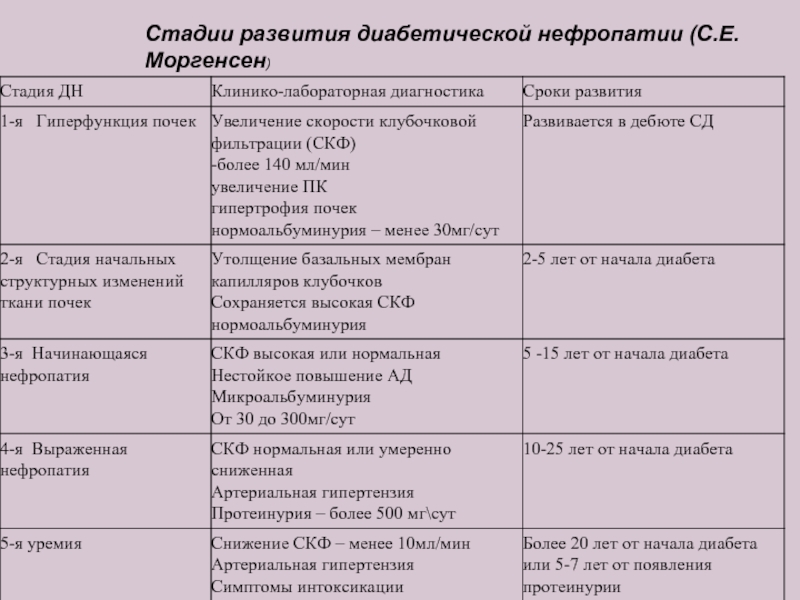
- 22. Стадии развития диабетической нефропатии (С.Е. Моргенсен)
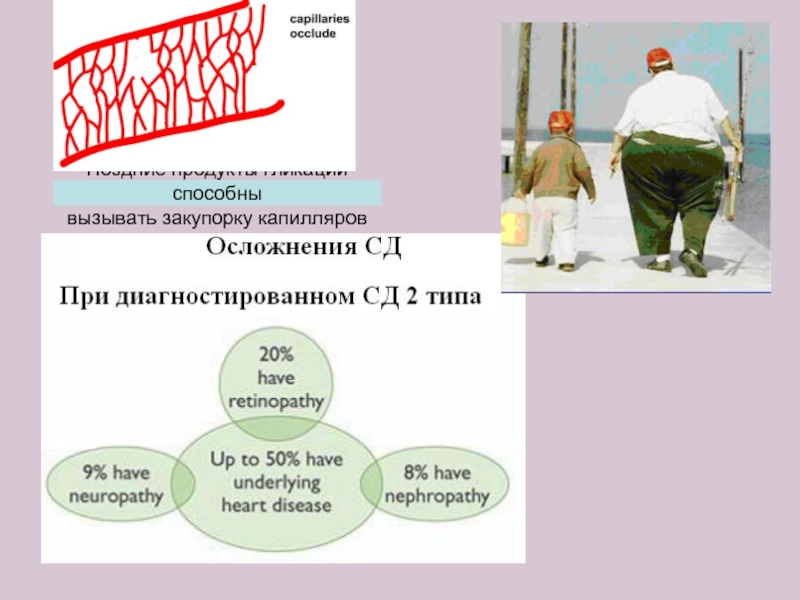
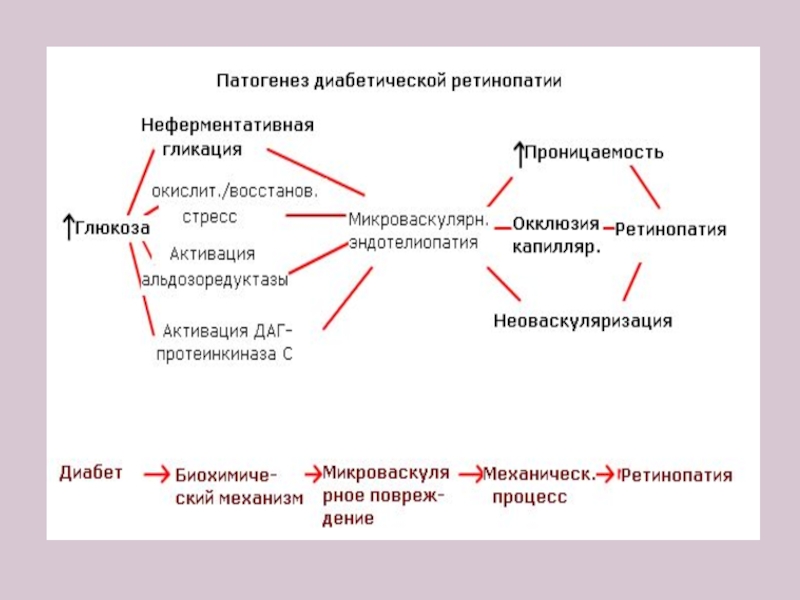
- 23. Поздние продукты гликации способны вызывать закупорку капилляров
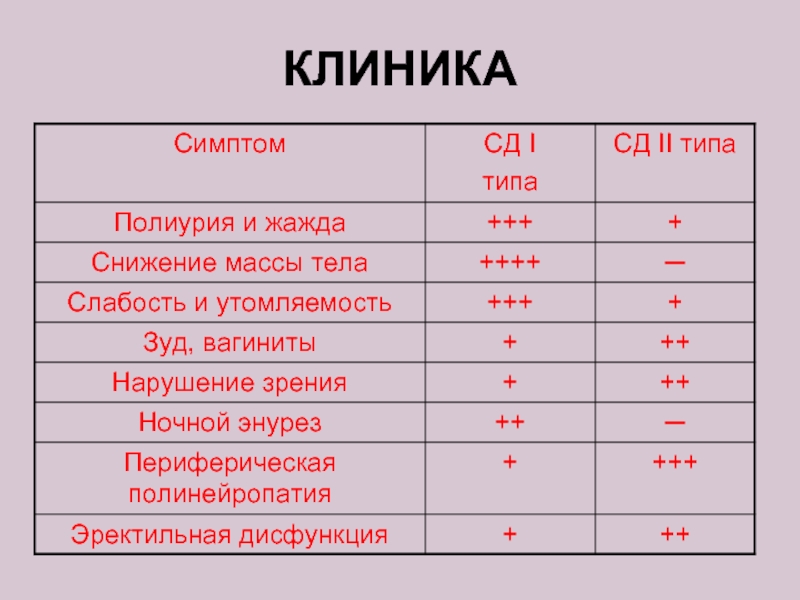
- 24. КЛИНИКА
- 26. Кетоновые тела - это кислоты, они диссоциируют
- 31. При более длительном голодании активизируется гипоталамо-гипофизарно-надпочечниковая система,
- 32. Причины гипогликемий
- 33. Диагностика гипогликемий
- 34. Виды гипергликемии и причины ее возникновения
- 35. Исторически сложилось так, что человек, поев сегодня,
- 36. Одним из ведущих звеньев патогенеза ожирения является
- 37. У здоровых людей четыре фактора
- 38. Согласно рекомендациям экспертов ВОЗ, определение CД:
- 39. Выявлен полигенный характер наследования, следствием чего могут
- 40. Экзогенные факторы, провоцирующие развитие СД диетические погрешности
- 41. Взаимодействие экзогенных и генетических факторов в
- 42. Типы сахарного диабета
- 43. Выделяют две формы данной эндокринной патологии: 1.
- 44. Отличия СД I и II типа
- 45. Лабораторные критерии постановки диагноза СД (ВОЗ, 1999)
- 46. КЛИНИЧЕСКАЯ КАРТИНА (СИМПТОМЫ) Сахарный диабет
- 47. Сахарный диабет II типа (инсулиннезависимый) возникает
- 48. Клиническая картина СД у детей. Ранним признаком
- 49. Пероральный глюкозотолерантный тест (ПГТТ) Проводится в случае
- 50. Нарушенная толерантность к глюкозе (ВОЗ, 1999г.) Через
- 51. Понятия и определения, используемые при оценке гликемии
- 52. Мониторинг СД
- 53. Сахарный диабет 1 типа Подавляющее большинство случаев
- 54. Маркёры иммунного повреждения включают аутоантитела к
- 55. Идиопатический диабет представляет собой некоторые формы СД
- 56. Актуальной задачей клинической лабораторной медицины является диагностика
- 57. Сахарный диабет 2 типа - преобладающая инсулинорезистентность
- 58. Патогенез СД 2 типа до конца неясен.
- 59. Полисимптомная клиника СД объясняется многоликими нарушениями в
- 60. Патохимия сахарного диабета Гипергликемия. Американская диабетическая ассоциация
- 61. Механизм развития гипергликемии можно представить следующим образом.
- 62. Гиперлактацидемия. В норме величины молочной кислоты в
- 63. Гликозилирование биополимеров (белков, полисахаридов) При хронической гипергликемии
- 64. Установлено, что моносахариды могут находиться как в
- 65. Гликолизированный гемоглобин (гликолизированный Hb) — это гемоглобин,
- 66. У пациентов с диабетом количественное определение фруктозаминов
- 67. Взаимодействие глюкозы с апопротеинами ЛПОНП замедляет скорость
- 68. Увеличение уровня высших жирных кислот в крови.
- 69. Гиперхолестеринемия - у больных СД уровень холестерина
- 70. Гипертриацилглицеролемия - Наблюдающаяся у больных СД повышенная
- 71. Гиперазотемия, гипераминоацидемия при СД обусловлена: угнетением
- 72. Снижение защитных сил. Вследствие дефицита инсулина замедлена
- 73. Различные -урии. Глюкозурия, кетонурия, аминоацидурия, лактацидурия и
- 74. Клиника СД Полиурия Полидипсия Полифагия
- 75. Показания для исследования уровня гликемии: пожилой возраст
- 76. Алгоритм диагностики СД Глюкоза крови натощак, ммоль/л
- 77. Исследование гликемии для диагностики СД не
- 78. Кетоновые тела – ацетон, ацетоацетат и α-гидроксибутират
- 79. Пероральный глюкозотолерантный тест
- 81. Понижение толерантности к глюкозе характеризуется необычно
- 82. Патогенез СД 1 типа – генетические факторы и факторы окружающей среды.
- 83. Патогенез СД Генетические факторы Факторы окружающей среды
- 84. Недостаточность инсулина ведет к значительному увеличению выброса
- 85. Отсутствие инсулина ускоряет темпы липолиза. Избыток СЖК,
- 86. Осложнения диабета Декомпенсированные коматозные
- 87. Патогенез кетоацидоза Недостаток инсулина Относительный избыток глюкагона
- 88. Лабораторная диагностика ДКА Гипергликемия выше
- 89. Лабораторная диагностика ГОНК Гипергликемия до 50-60
- 90. Лабораторная диагностика лактоацидоза (встречается редко, ацидоз вызван
- 91. Хронические осложнения диабета Fonseca V.A. Clinical diabetes^translating research into practice. 2006
- 92. Общая теория осложнений диабета (Brownlee M.) Хроническое
- 93. Хронические осложнения сахарного диабета Макроваскулярные: Кардиоваскулярные заболевания
- 95. Характеристика гликемических кривых у детей раннего возраста
- 96. Методы исследования и интерпретация результатов Глюкоза
- 97. В отличие от разнообразных патологических типов гипергликемии
- 98. Причины гипогликемии: 1. Передозировка инсулина или
- 99. Биохимическое обследование пациента с гипогликемией включает Определение
- 100. Липидный обмен
- 101. Термин липиды объединяет ряд структурно и функционально
- 102. Существуют четыре основных класса ЛП.
- 103. Транспорт липидов Экзогенный путь. В стенке
- 104. Эндогенный путь. Печень синтезирует триглицериды и выделяет
- 105. Нарушения липидного обмена связаны в первую
- 106. Гиперлипопротеинемии обусловлены замедленным распадом липопротеидного комплекса (недостаточность
- 107. Функции липопротеинов
- 108. Виды гиперлипопротеидемий
- 109. Общие липиды норма – 4,0-8,0г/л. Гиперлипидемия (гиперлипемия)
- 110. Программы и алгоритмы лабораторной диагностики ДЛП Скрининговое
- 111. Коэффициент Климова (ИА) = ХС общ.
- 112. Снижение уровня холестерина плазмы наблюдаются у больных
- 113. Все гормоны, влияющие на мобилизацию жира, можно
- 114. Соматотропный гормон - стимулирует липолиз, воздействуя через
- 115. Половые гормоны: точный механизм их воздействия на
- 116. Лептин (от лат. Leptos - тонкий, худой).
Слайд 2 Функции углеводов
энергообеспечения органов и тканей.
структурная
защитная (участие в иммунологических
Слайд 3Глюкоза играет главную роль в метаболизме, так как именно она является
катаболизм глюкозы - гликолиз;
синтез глюкозы - глюконеогенез;
депонирование и распад гликогена;
синтез пентоз - пентозофосфатные пути.
Слайд 4Гликолиз - это серия реакций, в результате которых глюкоза распадается на
Анаэробный гликолиз дает значительно меньший энергетический эффект, но является основным источником энергии для скелетных мышц в начальном периоде интенсивной работы, т. е. в условиях, когда снабжение кислородом ограничено. Кроме того, зрелые эритроциты извлекают энергию за счет анаэробного окисления глюкозы, потому что не имеют митохондрий.
Таким образом, аэробный распад глюкозы - это предельное ее окисление до СО2 и Н2 О, а анаэробный гликолиз - это специфический путь катаболизма, т. е. часть аэробного распада глюкозы.
Слайд 5Гликоген - основная форма депонирования глюкозы в клетках животных. У растений
Включение глюкозы в метаболизм начинается с образования фосфоэфира - глюкозо-6-фосфата. В клетках мышц и других органах эту реакцию катализирует фермент гексокиназа. В клетках печени эту же реакцию катализирует глюкокиназа, Насыщение глюкокиназы происходит только при высокой концентрации глюкозы. Различия в свойствах ферментов объясняют, почему в период пищеварения глюкоза задерживается в основном в печени. При высокой концентрации глюкозы глюкокиназа максимально активна. Напротив, гексокиназа, обладая большим сродством к глюкозе, способна выхватывать ее из общего кровотока, где концентрация глюкозы ниже.
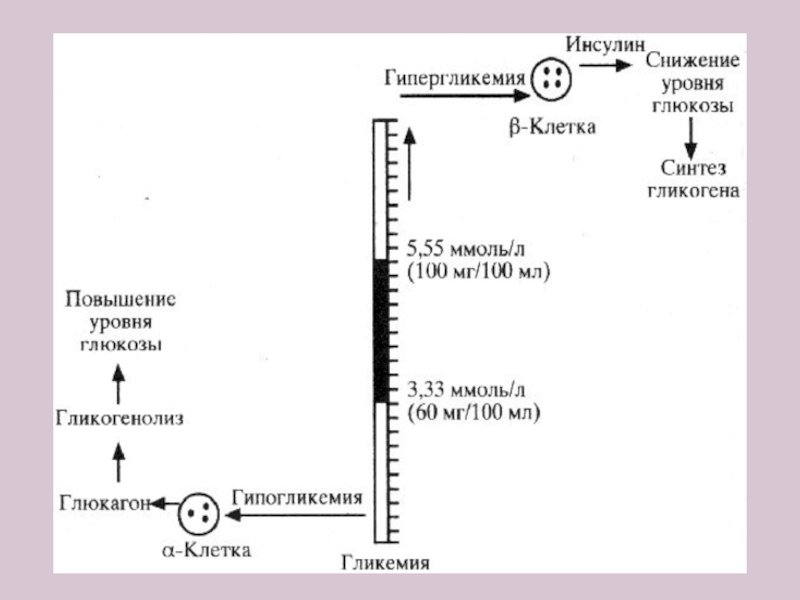
Слайд 6В результате сложного взаимодействия углеводного обмена в организме поддерживается относительно постоянный
Слайд 7Референтные значения глюкозы (ВОЗ, 1999г.)
Цельная кровь – 3,3-5,5 ммоль/л
Плазма (сыворотка) –
Ликвор – 60 % от уровня плазмы
Моча – не определяется распространенными методами
Слайд 8Факторы, влияющие на уровень гликемии:
1. Вид крови, используемый для исследования (цельная
2. При определении уровня глюкозы в цельной крови необходимо учитывать величину гематокрита (Ht).
При Ht < 35% уровень гликемии - несколько завышен,
а при Ht > 55% – занижен.
3. У лиц старше 60-летнего возраста каждые 10 лет уровень глюкозы в крови растет на 0,56 ммоль/л.
4. Прием ЛC (гормональных) оказывает влияние как на метаболизм глюкозы в организме, так и на ее уровень в крови.
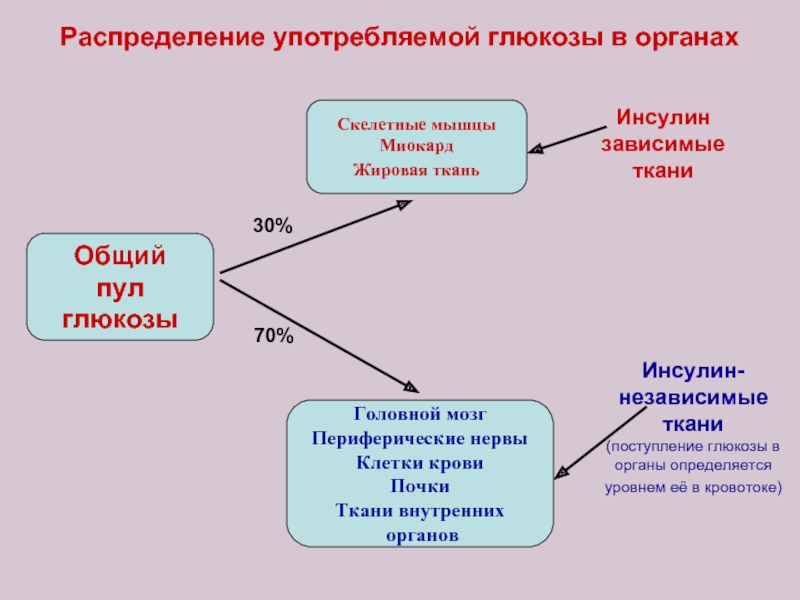
Слайд 9Распределение употребляемой глюкозы в органах
Скелетные мышцы
Миокард
Жировая ткань
Общий
пул глюкозы
Головной мозг
Периферические нервы
Клетки крови
Почки
Ткани внутренних
органов
30%
70%
Инсулин
зависимые
ткани
Инсулин-
независимые
ткани
(поступление глюкозы в
органы определяется
уровнем её в кровотоке)
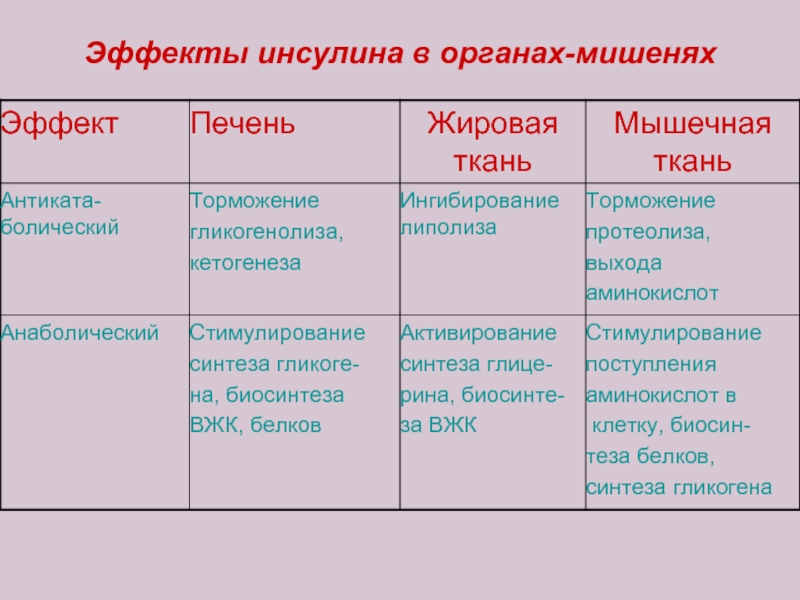
Слайд 13Инсулин обладает целым спектром свойств, направленных на снижение концентрации глюкозы в
Активирует поступление глюкозы в клетку.
Ускоряет ее катаболизм (распад) для целей энергообеспечения.
Ускоряет синтез гликогена в печени и мышечной ткани.
Ускоряет синтез жирных кислот и аминокислот из промежуточных продуктов распада углеводов.
Тормозит липолиз (распад липидов).
Тормозит гликогенолиз (распад гликогена с образованием глюкозы).
Тормозит глюконеогенез (образование глюкозы из аминокислот и жирных кислот).
Слайд 14Глюкагон также обладает несколькими важными функциями, направленными на восстановление уровня глюкозы
ускоряет распад гликогена в печени (гликогенолиз).
ускоряет глюконеогенез.
тормозит синтез белка и ускоряет протеолиз (с использованием продуктов распада белков для глюконеогенеза).
Этих эффектов глюкагона обычно бывает достаточно, чтобы в течение относительно длительного времени (до 24 часов) поддерживать достаточный уровень глюкозы в крови.
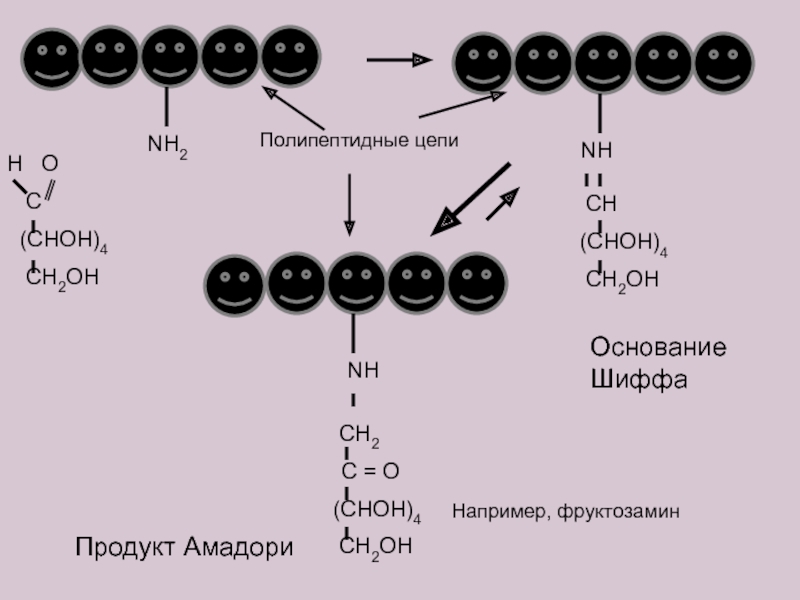
Слайд 15
NH2
H O
C
(CHOH)4
CH2OH
NH
CH
(CHOH)4
NH
CH2
C = O
(CHOH)4
CH2OH
Продукт Амадори
Основание Шиффа
Полипептидные цепи
Например, фруктозамин
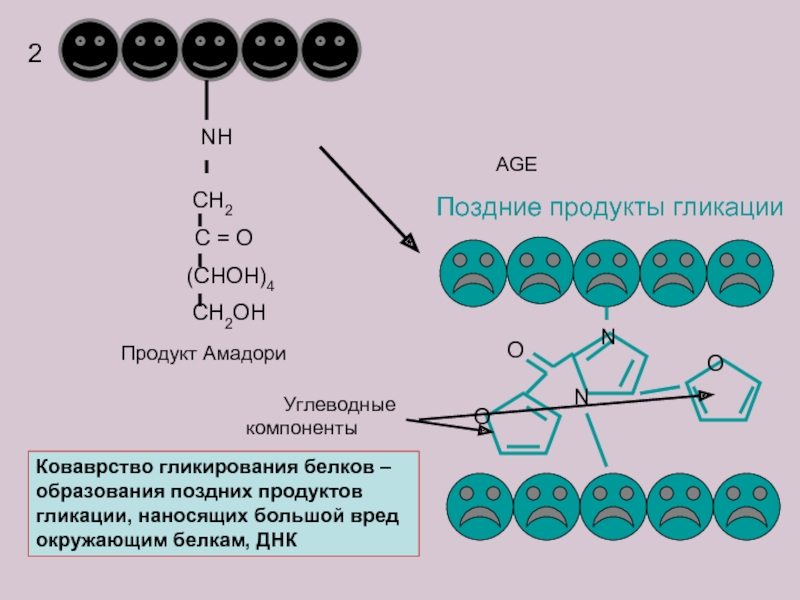
Слайд 16
NH
CH2
C = O
(CHOH)4
CH2OH
2
N
N
O
O
O
Поздние
Продукт Амадори
Углеводные компоненты
AGE
Коваврство гликирования белков – образования поздних продуктов гликации, наносящих большой вред окружающим белкам, ДНК
Слайд 17*AGE повышают жесткость белков. Уменьшают скорость удаления ЛПВП от стенки сосудов
*Стимулируют
*Ускоряют образование свободных радикалов
*Понижают отрицательный заряд мембран, связывающих гепарансульфат
Последствия ППГ
Изменяются тонус и функции сосудов,-- это следствие недостатка NO
Взаимодействуют с клеточными рецепторами
Повышается выделение факторов роста:
- Повышаются число и размеры клеток ( ГМК)
- Повышается формирование матрикса
Повышаются поперечные сшивки в НК
Возникают трудности при разделении ДНК, мутации и неспособность к экспрессии некоторых генов
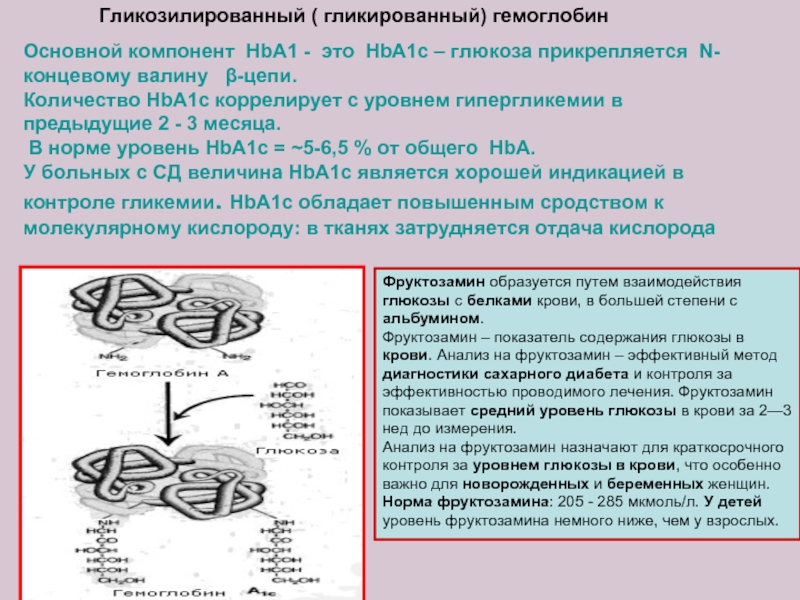
Слайд 18Основной компонент HbA1 - это HbA1c – глюкоза прикрепляется N-концевому валину
Количество HbA1c коррелирует с уровнем гипергликемии в предыдущие 2 - 3 месяца.
В норме уровень HbA1c = ~5-6,5 % от общего HbA.
У больных с СД величина HbA1c является хорошей индикацией в контроле гликемии. HbA1c обладает повышенным сродством к молекулярному кислороду: в тканях затрудняется отдача кислорода
Гликозилированный ( гликированный) гемоглобин
Фруктозамин образуется путем взаимодействия глюкозы с белками крови, в большей степени с альбумином.
Фруктозамин – показатель содержания глюкозы в крови. Анализ на фруктозамин – эффективный метод диагностики сахарного диабета и контроля за эффективностью проводимого лечения. Фруктозамин показывает средний уровень глюкозы в крови за 2—3 нед до измерения.
Анализ на фруктозамин назначают для краткосрочного контроля за уровнем глюкозы в крови, что особенно важно для новорожденных и беременных женщин.
Норма фруктозамина: 205 - 285 мкмоль/л. У детей уровень фруктозамина немного ниже, чем у взрослых.
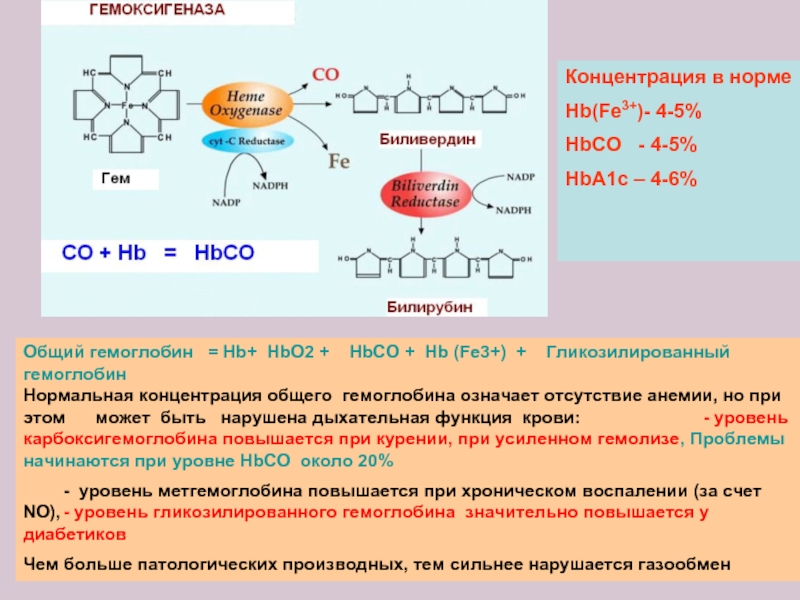
Слайд 19Общий гемоглобин = Hb+ HbO2 + HbCO + Hb
- уровень метгемоглобина повышается при хроническом воспалении (за счет NO), - уровень гликозилированного гемоглобина значительно повышается у диабетиков
Чем больше патологических производных, тем сильнее нарушается газообмен
Концентрация в норме
Hb(Fe3+)- 4-5%
HbCO - 4-5%
НbА1c – 4-6%
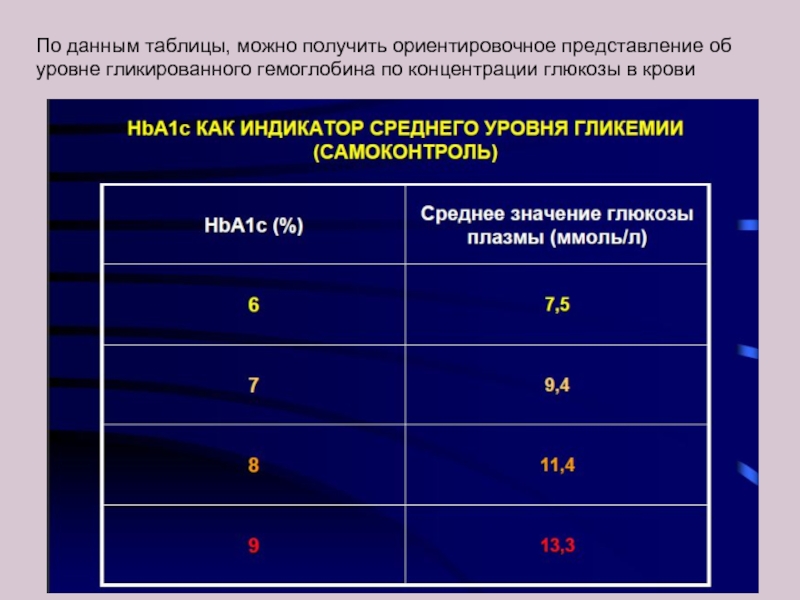
Слайд 20По данным таблицы, можно получить ориентировочное представление об уровне гликированного гемоглобина
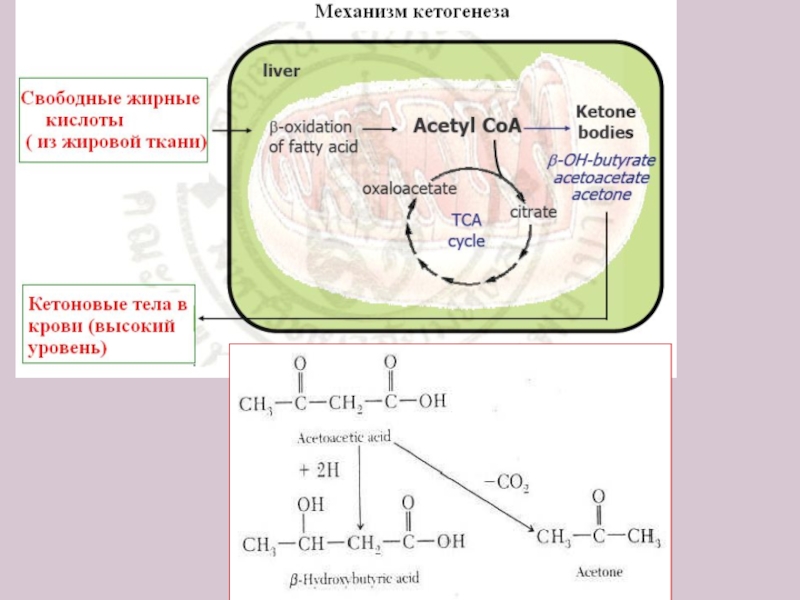
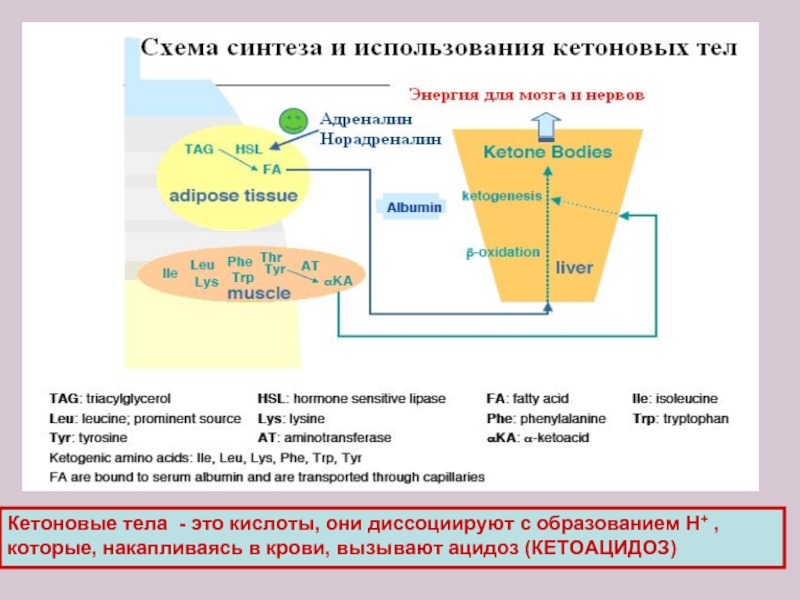
Слайд 26Кетоновые тела - это кислоты, они диссоциируют с образованием Н+ ,
Слайд 31При более длительном голодании активизируется гипоталамо-гипофизарно-надпочечниковая система, что ведет к усилению
усиленному распаду гликогена в печени,
стимулируют использование жиров (β-окисление жирных кислот) в качестве основного субстрата энергообразования в клетке, тем самым способствуют уменьшению использования глюкозы для этих целей.
Слайд 34Виды гипергликемии и причины ее возникновения
Физиологическая гипергликемия (прием пищи, богатой
Сахарный диабет I или II типа (недостаточная продукция инсулина или повышенная толерантность тканей к этому гормону).
Заболевания гипофиза, сопровождающиеся повышенной секрецией соматотропного гормона и АКТГ (опухоль гипофиза, болезнь Иценко-Кушинга, акромегалия).
Заболевания надпочечников, сочетающиеся с усиленной продукцией катехоламинов или глюкокортикостероидов (феохромоцитома и др.).
Тиреотоксикоз.
Заболевания поджелудочной железы (острый и хронический панкреатит, опухоли поджелудочной железы).
Побочное действие некоторых лекарственных препаратов (кортикостероиды, тироксин, АКТГ, адреналин, эстрогены, индометацин, большие дозы никотиновой кислоты, тиазидные диуретики, фуросемид и др.).
Слайд 35Исторически сложилось так, что человек, поев сегодня, не знал, когда он
Научно-технический прогресс вмешался в равновесные отношения: физические нагрузки уменьшились, а аппетит сохранился. Развивающийся после еды подъём глюкозы провоцирует гиперинсулинизм, который не находя применения в миофибриллах, основной упор делает на мембраны липоцитов. Поступая в эти клетки, избыточный моносахарид преобразуется в конечном итоге в нейтральные жиры. Подобный механизм их депонирования способствует ожирению.
Слайд 36Одним из ведущих звеньев патогенеза ожирения является дисбаланс липопротеидов; считают, что
Хотя причинами последнего явления ряд исследователей называет:
снижение числа рецепторов к инсулину при акромегалии, болезни и синдроме Иценко- Кушинга,
изменение структуры данных белков,
выработку антител или к рецепторам, или к их гормону.
Слайд 37 У здоровых людей четыре фактора определяют чувствительность к инсулину:
количество
их распределение в тканях,
общая масса тела,
уровень физической нагрузки.
Особую роль в возникновении инсулинорезистентности приписывают возрастающей массе тела и низкой физической активности, которых считают главными провокаторами развития так называемого «смертельного квартета» (ожирение + сахарный диабет 2 типа + артериальная гипертензия + атеросклероз), известного ещё под термином «метаболический синдром».
Ключевую роль в патогенезе МС играют нарушения в обмене инсулина, которые и приводят к развитию сахарного диабета.
Слайд 38Согласно рекомендациям экспертов ВОЗ,
определение CД:
«Сахарный диабет – это группа метаболических
Иными словами, среди его причин следует
выделить действие экзогенных и генетических
факторов.
Слайд 39Выявлен полигенный характер наследования, следствием чего могут быть:
синтез биологически неактивного инсулина
замедление конверсии препроинсулина в активный гормон;
снижение количества рецепторов к инсулину;
уменьшение их сродства (аффинности) к гормону;
аутоиммунные процессы (выработка аутоантител к инсулину или рецепторам);
замедление освобождения инсулина из комплекса с транспортными белками.
Слайд 40Экзогенные факторы, провоцирующие развитие СД
диетические погрешности – нарушение баланса между уровнем
деструкция поджелудочной железы (вследствие травмы, гемохроматоза, кистозного фиброза, рака, калькулёзного, алкогольного панкреатита и др.), провоцируемая избыточным синтезом NO, простагландинов, накоплением свободных радикалов;
стрессовые ситуации;
хроническая гиперсекреция контринсулярных гормонов (АКТГ, ГКС, СТГ, глюкагона, катехоламинов, тироидных гормонов), генерирующая эндокринную патологию, такую, как болезнь и синдром Иценко-Кушинга, акромегалию, глюкагоному, феохромацитому, синдром Конна, тиротоксикоз;
действие вирусов (краснухи, ветряной оспы, аденовируса, Коксаки), запускающих аутоиммунные реакции;
беременность;
длительная терапия лекарствами: оральными контрацептивами, тиазидовыми диуретиками, никотиновой кислотой, глюкокортикоидами и другими препаратами, токсически действующими на поджелудочную железу.
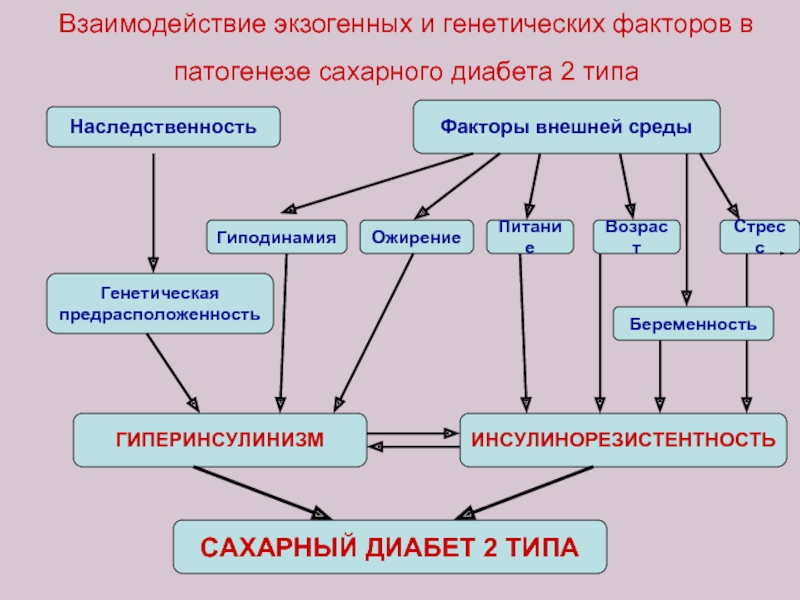
Слайд 41Взаимодействие экзогенных и генетических факторов в патогенезе сахарного диабета 2 типа
Наследственность
Генетическая
предрасположенность
Факторы внешней среды
Ожирение
Гиподинамия
Возраст
Питание
Стресс
Беременность
ГИПЕРИНСУЛИНИЗМ
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ
САХАРНЫЙ ДИАБЕТ 2 ТИПА
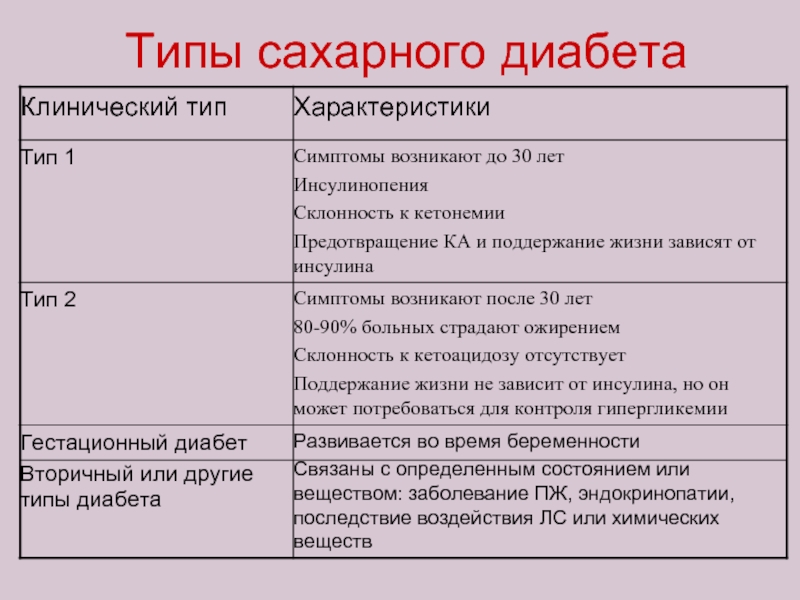
Слайд 43Выделяют две формы данной эндокринной патологии:
1. Сахарный диабет 1 типа –
В настоящее время известны 3 типа аутоантител:
к протеину островковых клеток – ICA
к инсулину – IAA
к ферменту глутаматдекарбоксилазе – GAD
2. Сахарный диабет 2 типа развивается у лиц старше 40-45 лет вследствие возникшей резистентности тканей к инсулину или из-за его относительной недостаточности. На долю этой формы недуга приходится 90-95% больных.
Слайд 45Лабораторные критерии постановки диагноза СД (ВОЗ, 1999)
Гипергликемия натощак:
Цельная кровь - ≥
Плазма (сыворотка) - ≥ 7,0 ммоль/л
Через два часа после нагрузки глюкозой (ПГТТ):
Цельная венозная кровь - ≥ 10,0 ммоль/л
Цельная капилляр кровь - ≥ 11,1 ммоль/л
Плазма (сыворотка) - ≥ 11,1 ммоль/л
Слайд 46КЛИНИЧЕСКАЯ КАРТИНА (СИМПТОМЫ)
Сахарный диабет I типа (инсулинзависимый) возникает у лиц
▪ повышенная утомляемость
▪ слабость
▪ жажда, чувство сухости во рту
▪ повышенное потребление жидкости
▪ обезвоживание организма
▪ учащенное мочеиспускание
▪ снижение массы тела
▪ зуд кожных покровов
▪ запах "ацетона" изо рта (кетоз)
▪ боли в животе
▪ рвота
Слайд 47Сахарный диабет II типа
(инсулиннезависимый) возникает у лиц старшего возраста (от
▪ повышенная утомляемость
▪ слабость
▪ жажда, чувство сухости во рту
▪ повышенное потребление жидкости
▪ учащенное мочеиспускание
▪ зуд кожных покровов
Слайд 48Клиническая картина СД у детей.
Ранним признаком сахарного диабета у детей является
Моча выделяется в большом количестве (3-6 л в сутки), ее относительная плотность высокая (более 1020), моча содержит сахар и в большинстве случаев ацетон.
Слайд 49Пероральный глюкозотолерантный тест (ПГТТ)
Проводится в случае сомнительных значений гликемии для уточнения
Методика выполнения ПГТТ:
Нагрузка глюкозой соответствует:
для взрослых – 75 г глюкозы в 300 мл воды, выпить за 3-5 мин.
для детей – глюкозы1,75 г/кг, но не > 75г, выпить за 3-5 мин.
Слайд 50Нарушенная толерантность к глюкозе (ВОЗ, 1999г.)
Через два часа после нагрузки глюкозой
Цельная венозная кровь – 6,7-10,0 ммоль/л
Цельная капилл. кровь – 7,8-11,1 ммоль/л
Плазма (сыворотка) – 7,8-11,1 ммоль/л
Нарушенная гликемия натощак (ВОЗ, 1999г.)
Цельная венозная кровь – 5,6-6,1 ммоль/л
Цельная капилл. кровь – 5,6-6,1 ммоль/л
Плазма (сыворотка) – 6,1-7,0 ммоль/л
Слайд 51Понятия и определения, используемые при оценке гликемии
Гликемия натощак – уровень глюкозы
Постпрандиальная гликемия – уровень глюкозы крови через 2 часа после приема пищи
Гликемический профиль – исследование уровня глюкозы в течение суток через 3-4 ч
Случайно выявленная гипергликемия – гипергликемия, выявленная в любое время дня вне зависимости от приема пищи
Слайд 53Сахарный диабет 1 типа
Подавляющее большинство случаев СД 1типа обусловлено двумя этиопатогенетическими
Этот тип СД условно подразделяют на иммуноопосредованный и идиопатический.
Иммуноопосредованный диабет – обозначается терминами диабет 1 типа, инсулинзависимый диабет (ИЗСД), диабет с ювенильным началом. В качестве причины выступает клеточно-опосредованная аутоиммунная деструкция β-клеток pancreas, обычно ведущая к абсолютному дефициту инсулина.
При данной форме диабета больные редко имеют ожирение, но его наличие не означает несовместимость с этим диагнозом. Кроме того, у пациентов отмечается склонность к другим аутоиммунным заболеваниям, таким как болезнь Грейвса, тиреоидит Хашимото, болезнь Аддисона, витилиго, пернициозная анемия
Слайд 54Маркёры иммунного повреждения включают
аутоантитела к островковым клеткам (ICAs),
аутоантитела к
аутоантитела к декарбоксилазе глютаминовой кислоты (GAD65) и
аутоантитела к тирозин-фосфатазам (IA-2 и IA-2b).
У 85-90% пациентов присутствует не один, а обычно несколько видов аутоантител. Страдание имеет чёткую ассоциацию с HLA, связанную как с генами DQA и B, так и DRB. Установлено, что после перенесенной вирусной инфекции (особенно вирус коксаки В4) резко возрастает частота проявления диабета, кроме того инсулиты – воспаление островков pancreas - повреждают β-клетки и нарушают генез гормона..
Ведущая роль в развитии иммунологического каскада принадлежит макрофагам. Под влиянием вирусов, химических факторов на поверхности β-клеток экспрессируется антиген, который опознаётся макрофагами как чужеродный. Нейтрофилы вместе с Т-хелперами выбрасывают интерлейкины и лимфокины (IL-1, γ-интерферон, TNF), активирующие иммунокомпетентные клетки. Исходом этих реакций является образование аутоантител к поверхностным и цитоплазматическим антигенам островков поджелудочной железы, причём некоторые из них используются в качестве маркёров СД 1 типа (JCA, GAD-65, GAD-67). Аутоиммунная деструкция протекает скрыто, с момента её запуска до возникновения клиники (гибель 80-90% β-клеток) проходит определённый период, а выраженные симптомы этого страдания являются конечным этапом данного процесса.
Слайд 55Идиопатический диабет представляет собой некоторые формы СД 1 типа с неустановленной
Слайд 56Актуальной задачей клинической лабораторной медицины является диагностика предклинического периода развития деструкции
Слайд 57Сахарный диабет 2 типа - преобладающая инсулинорезистентность и относительный инсулинодефицит
Вероятность
с возрастом,
недостаточной физической активностью
ожирением.
Он чаще возникает у женщин с предшествовавшим СД беременных, у пациентов с гипертонией, дислипидемией, сердечно-сосудистой патологией, после перенесенной инфекции, а также в результате побочных эффектов терапии, при курении.
Кетоацидоз редко развивается спонтанно и чаще связан со стрессом в результате другого заболевания, например, инфекции. В бессимптомный период у пациентов можно диагностировать нарушения углеводного обмена путём определения уровня глюкозы крови натощак или используя глюкозотолерантный тест. Данный вид патологии часто остаётся недиагностированным многие годы, так как гипергликемия развивается постепенно, классические симптомы диабета на начальных стадиях отсутствуют, но данные больные включены в группу риска по макро- и микрососудистым осложнениям.
Слайд 58Патогенез СД 2 типа до конца неясен.
Ряд учёных считает, что
Ранняя диагностика инсулинорезистентности может помочь в профилактике и лечении СД 2 типа и его осложнений. Проводить обследование на наличие этого синдрома необходимо при установлении факторов риска у пациентов (гипертоническая болезнь, ИБС, ожирение, индекс массы тела более 30 кг/м2 поверхности тела, увеличение цифр триглицеридов, снижение уровня ЛПВП). Это исследование заключается не только в проведении глюкозотолерантного (ГТТ), но и определение содержания инсулина и С-пептида натощак и через 2 часа после дачи 75 г глюкозы. Даже при нормальном ответе со стороны моносахарида и ГТТ существенный рост величин гормона и С-пептида свидетельствует о наличии инсулинорезистентности.
Слайд 59Полисимптомная клиника СД объясняется многоликими нарушениями в метаболизме, возникающими вследствие абсолютного
Ведущим этапом является активация транспорта глюкозы, ВЖК, аминокислот, нуклеозидов, фосфатов через цитолемму, что и обеспечивает их использование в тканях-мишенях. Хронический дефект действия инсулина приводит к повреждению данного механизма.
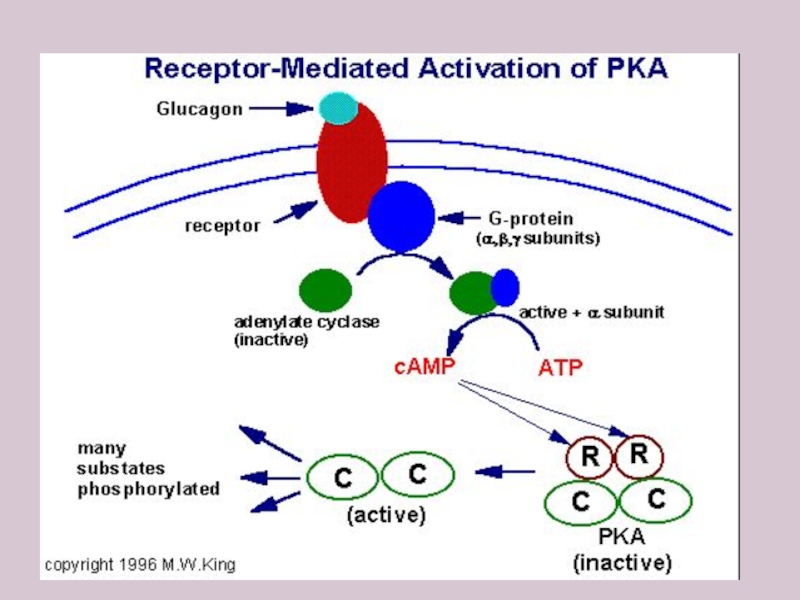
Чтобы пополнить в клетке-мишени энергоисточники, в первую очередь, глюкозу, увеличивается выброс контринсулярных гормонов, усиливающих или гликогенолиз, или глюконеогенез – оба процесса стремятся нормализовать гомеостаз вышеуказанного углевода. Но часть из них воздействуя через цАМФ и фосфорилируя ферменты или активирует или ингибирует их.
Слайд 60Патохимия сахарного диабета
Гипергликемия.
Американская диабетическая ассоциация предложила следующие цифры глюкозы крови натощак:
а)
б) нарушенная гликемия от 6,1 до < 7,0 ммоль/л;
в) предварительная верификация СД = или > 7,0 ммоль/л, которая должна быть подтверждена при последующем клиническом наблюдении.
Некоторые эндокринологи предлагают ставить диагноз данного заболевания при значениях, равных или превышающих 6,7 ммоль/л, если они регистрировались при повторном анализе.
Слайд 61Механизм развития гипергликемии можно представить следующим образом. Источником эндогенной глюкозы служат
Слайд 62Гиперлактацидемия. В норме величины молочной кислоты в крови не превышают 2,2
Гликозилированный гемоглобин (Нb) приводит к развитию гипоксии, что провоцирует подавление аэробных процессов (ЦТК, окислительного декарбоксилирования ПВК). Указанные моменты сопровождаются накоплением восстановленного НАД, который используется в лактатдегидрогеназной реакции с получением молочной кислоты
Слайд 63Гликозилирование биополимеров (белков, полисахаридов)
При хронической гипергликемии уровень глюкозы в клетках, не
Часть избыточной глюкозы восстанавливается в сорбитол, который во фруктозу. Появление и накопление этих веществ (глюкозы, сорбитола, фруктозы) в необычных количествах внутри клеток хрусталика и в нейронах грозит патологическим ростом осмотического давления (гипергидратацией). Эти реакции стимулируют истощение запасов НАДФН, снижение окислительно-восстановительного потенциала и уменьшение способности клеток синтезировать АТФ в процессе окислительного фосфорилирования.
Слайд 64Установлено, что моносахариды могут находиться как в открытой (формула Фишера), так
Слайд 65Гликолизированный гемоглобин (гликолизированный Hb) — это гемоглобин, вступивший в реакцию с
В эритроцитах здорового человека может находиться до 6% гликозилированного Нb (HbA1с), у больных СД его содержание резко увеличено. Он обладает повышенным сродством к кислороду, что обусловливает развитие гипоксии в различных тканях. В норме содержание гликолизированного Hb составляет 4,5–6,1%. Определение содержания гликолизированного Hb используют при подборе лечения у больных сахарным диабетом и оценке степени его компенсации.
Слайд 66У пациентов с диабетом количественное определение фруктозаминов (гликозилированного альбумина) служит маркёром
Установлено, что в физиологических условиях около 6-15% альбуминов сыворотки крови присутствует в гликированной форме. Однако превышение этого уровня приводит к повреждению выполняемой альбуминами и глобулинами транспортной функции (переноса Fe, Cu, билирубина). Подобная модификация коллагена, тубулина, эластина нарушает деятельность всех видов соединительных тканей (мелких и крупных сосудов, вызывая ретинопатию, ангиопатии сосудистых клубочков почек – нефропатии, хрящевой ткани – пародонтоз, артриты, артрозы).
Ускоряет развитие данных патологий и гликирование ГАГов (гепаринсульфата, дерматансульфата).
Слайд 67Взаимодействие глюкозы с апопротеинами ЛПОНП замедляет скорость гидролиза содержащихся в них
Гликозилирование ЛПНП снижает их аффинность к рецепторам фибробластов, отвечающих за их катаболизм. Накопление ЛПНП грозит не только развитием атеросклероза. Их мицеллы, агрегируя на эритроциты, увеличивают толщину плазмолеммы последних, уменьшают тем самым скорость диффузии кислорода, способствуют гипоксии. Гликирование кристаллина и гликозамингликанов хрусталика повреждают его прозрачность (провоцирование катаракты). Подобная реакция с белками миелиновой оболочки усиливает их деградацию макрофагами, вызывая демиелинизацию нервных волокон (нейропатии). При взаимодействии фибриногена с глюкозой замедляется скорость его гидролиза, развивается гиперкоагуляция (повышенное свёртывание крови). Даже сам инсулин тоже гликозилируется, естественно, также меняются его свойства.
Слайд 68Увеличение уровня высших жирных кислот в крови. Данный симптом обусловлен дефицитом
Изменение массы тела. Когда инсулинопения носит первичный характер, следовательно, тормозится синтез липидов, угнетается диффузия ВЖК в липоциты, снижается скорость окислительного декарбоксилирования ПВК и ПФП. Если при этом регистрируется гиперсекреция контринсулярных гормонов, то последнее явление ещё и усиливает липолиз. Такой вариант диабета встречается чаще у детей и юношества (диабет худых).
Сахарный диабет 2 типа развивается обычно в зрелом возрасте, его провоцирует переедание, панкреатит, усиленная выработка контринсулярных гормонов, стрессы, результатом чего служит хроническая гипергликемия, индуцирующая повышенную секрецию инсулина, который обеспечивает преобразование избыточной глюкозы в нейтральный жир (ожирение). Однако такая работа поджелудочной железы в форсированном режиме быстро истощает её, что и заканчивается развитием СД, но уже на фоне избыточной массы тела.
Слайд 69Гиперхолестеринемия - у больных СД уровень холестерина в крови превышает 6
Слайд 70Гипертриацилглицеролемия - Наблюдающаяся у больных СД повышенная концентрация ВЖК в крови
Дислипопротеидемия - все выше перечисленные сдвиги в липидном метаболизме (усиленный синтез ХС, гликозилирование липопротеинов) способствуют увеличению вклада ЛПОНП, ЛПНП с одновременным понижением значений ЛПВП.
Нарушение перекисного гомеостаза - гипоксия, характерная для СД, служит одним из индукторов перекисного окисления липидов. Из-за угнетения ПФП подавляется восстановление НАДФ+, так необходимого в качестве компонента антирадикальной защиты. Отсюда у больных регистрируются повышенные цифры различных метаболитов ПОЛ и малонового диальдегида.
Слайд 71Гиперазотемия, гипераминоацидемия при СД обусловлена:
угнетением проницаемости мембран для аминокислот;
замедлением
А в избытке многие контринсулярные гормоны обладают катаболическим эффектом, то есть активируют протеолиз, что также обеспечивает гипераминоацидемию.
Кроме того, нарушение использования глюкозы с энергетической целью при СД за счёт действия тех же контринсулярных гормонов вызывает усиление глюконеогенеза, в первую очередь, из аминокислот и ускорение распада их кетогенных аналогов с образованием кетоновых тел – неплохих источников энергии. Одним из конечных продуктов обоих преобразований будет аммиак, обезвреживаемый путём синтеза мочевины.
Следовательно, при СД в крови регистрируется повышенный уровень этого вещества (гиперкарбамидемия), внося свой вклад в гиперосмолярность.
Слайд 72Снижение защитных сил. Вследствие дефицита инсулина замедлена скорость синтеза белков, в
Повышение осмотического давления крови (гиперосмолярность) из-за увеличения концентраций вышеперечисленных низкомолекулярных соединений (глюкозы, амино-, кетокислот, лактата, ПВК и т.д.).
Дегидратация (обезвоживание) тканей - следствие развития гиперосмолярности, а также полиурии.
Ацидоз из-за накопления кислых продуктов (ацетоацетата, β-оксибутирата, лактата, пирувата и т.д.).
Слайд 73Различные -урии. Глюкозурия, кетонурия, аминоацидурия, лактацидурия и т.д. из-за превышения их
Неадекватно высокая удельная плотность мочи как результат развития соответствующих -урий.
Полиурия:
для выведения с мочой разнообразных веществ требуется дополнительное количество воды (осмотический диурез);
естественный итог полидипсии.
Полидипсия. Обусловлена увеличением осмотического давления в плазме крови и ростом потерь воды с мочой.
Полифагия - один из первых и главных симптомов СД. Из-за дефицита инсулина повреждена проницаемость мембран клеток-мишеней для глюкозы, аминокислот, ВЖК, то есть кровь «сытая», а клетки «голодные».
Слайд 75Показания для исследования уровня гликемии:
пожилой возраст
наличие СД у родственников
ожирение
гиперлипидемия
гипертония
клинические симптомы
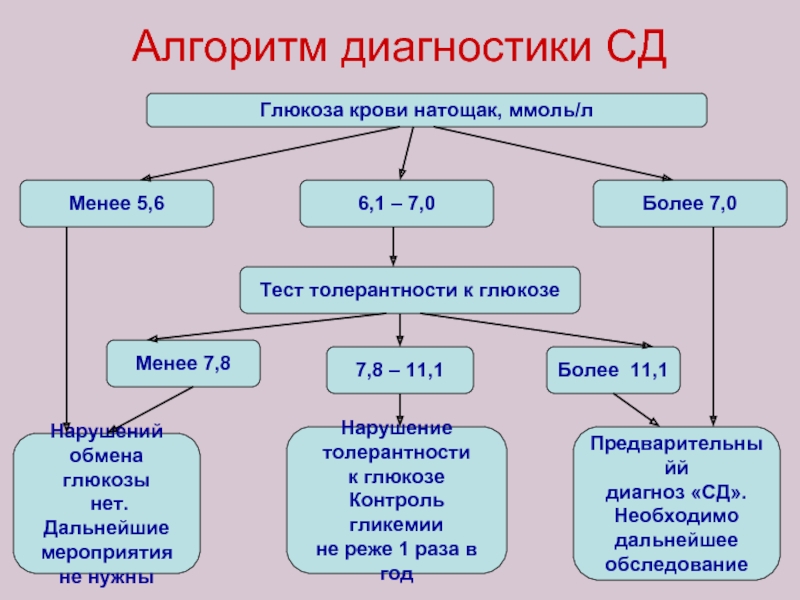
Слайд 76Алгоритм диагностики СД
Глюкоза крови натощак, ммоль/л
Менее 5,6
6,1 – 7,0
Более 7,0
Тест толерантности
Менее 7,8
7,8 – 11,1
Более 11,1
Нарушений
обмена глюкозы
нет. Дальнейшие
мероприятия
не нужны
Нарушение
толерантности
к глюкозе
Контроль гликемии
не реже 1 раза в год
Предварительныйй
диагноз «СД».
Необходимо
дальнейшее
обследование
Слайд 77 Исследование гликемии для диагностики СД не проводится:
на фоне острого заболевания,
на фоне кратковременного приема препаратов, повышающих уровень гликемии (ГКС, тиреоидные гормоны, тиазиды, в том числе β-адреноблокаторы и др);
у больных циррозом печени
Слайд 78Кетоновые тела – ацетон, ацетоацетат и α-гидроксибутират – конечные продукты метаболизма
Гликолизированный гемоглобин (HbA1C) в норме 3,5 - 5,6%;
Микроальбуминурия
Слайд 79Пероральный глюкозотолерантный тест
В течение трех дней пациент
В норме уровень глюкозы сыворотки крови достигает максимума через 60 мин после приема глюкозы и почти возвращается к исходному через 120 мин.
Слайд 80
Нормальная толерантность к глюкозе характеризуется уровнем гликемии через 2 ч после нагрузки глюкозой <7.8 ммоль/л;
Повышение концентрации глюкозы в плазме крови через 2 ч после нагрузки глюкозой до >7.8 ммоль/л, но <11.1 ммоль/л свидетельствует о нарушенной толерантности к глюкозе;
Содержание глюкозы в плазме венозной крови через 2ч после нагрузки глюкозой >11,1ммоль/л может быть основанием для предварительного диагноза СД, который должен быть подтвержден повторными определениями
Слайд 81Понижение толерантности к глюкозе характеризуется необычно
высоким уровнем глюкозы, длительно сохраняющейся
отсутствием необходимого снижения содержания глюкозы через 120 мин.
Причины понижения толерантности к глюкозе:
Снижение способности тканей утилизировать глюкозу — скрытый
СД, стероидный диабет.
2. Повышение скорости абсорбции глюкозы из кишечника (например, при язве двенадцатиперсной кишки, после гастрэктомии, при гипертиреозе и др.).
3. Повышенная интенсивность гликогенолиза (распада гликогена) и глюконеогенеза, которая наблюдается, например, при гиперфункции надпочечников, гипертиреозе, феохромоцитоме, во время беременности и т. д.
4. Поражения печени, ведущие к снижению скорости синтеза гликогена
Повышенная толерантность к глюкозе характеризуется снижением уровня
глюкозы натощак ниже 3,3 ммоль/л и уплощением пика кривой содержания
глюкозы крови во время ГТТ.
Причины повышенной толерантности к глюкозе:
Нарушение переваривания и всасывания сахаров в тонком кишечнике
(энтериты различной этиологии, болезнь Уиппла, гипотиреоз, гипофункция
надпочечников и др.).
2. Избыточная секреция инсулина при гиперплазии, аденоме или раке
островков Лангерганса поджелудочной железы.
Слайд 83Патогенез СД
Генетические факторы
Факторы окружающей среды (коксаки, ЦМВ, краснуха)
Вне зависимости от первичного
лимфоцитарная инфильтрация островков Лангерганса
наличие циркулирующих АТ к цитоплазматическим и поверхностным компонентам В-клеток
антитела против инсулина
Эти реакции приводят к постепенному разрушению В-клеток с сохранением других клеточных компонентов островков Лангерганса. Симптоматический диабет не проявляется до тех пор пока 75-85% В-клеток не будут разрушены.
Слайд 84Недостаточность инсулина ведет к значительному увеличению выброса глюкозы печенью: прекращается торможение
Слайд 85Отсутствие инсулина ускоряет темпы липолиза. Избыток СЖК, образующихся в результате усиленного
Слайд 86
Осложнения диабета
Декомпенсированные коматозные состояния:
- диабетический кетоацидоз ДКА
гиперосмолярная некетотическая кома
лактоацидоз ЛА
гипогликемические состояния
Отдаленные осложнения
(через 2-3 года):
ангиопатия
ретинопатия
нефропатия
нейропатия
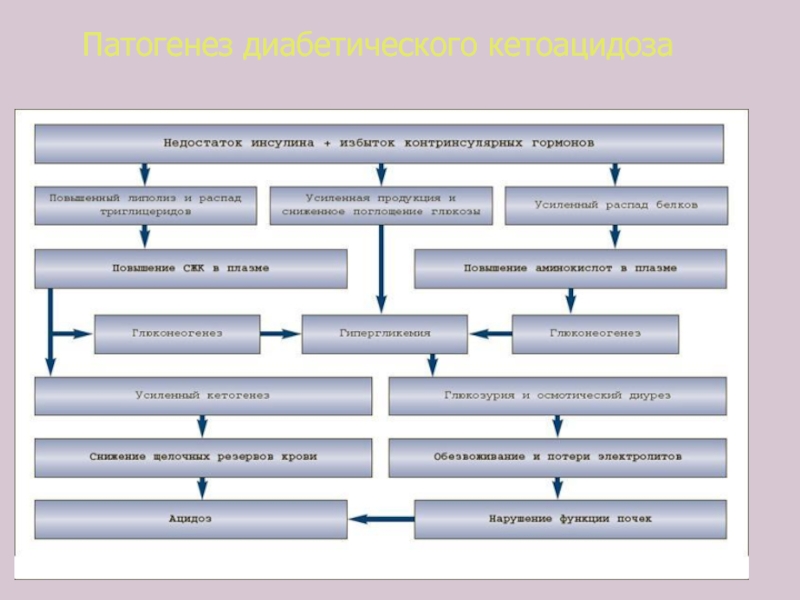
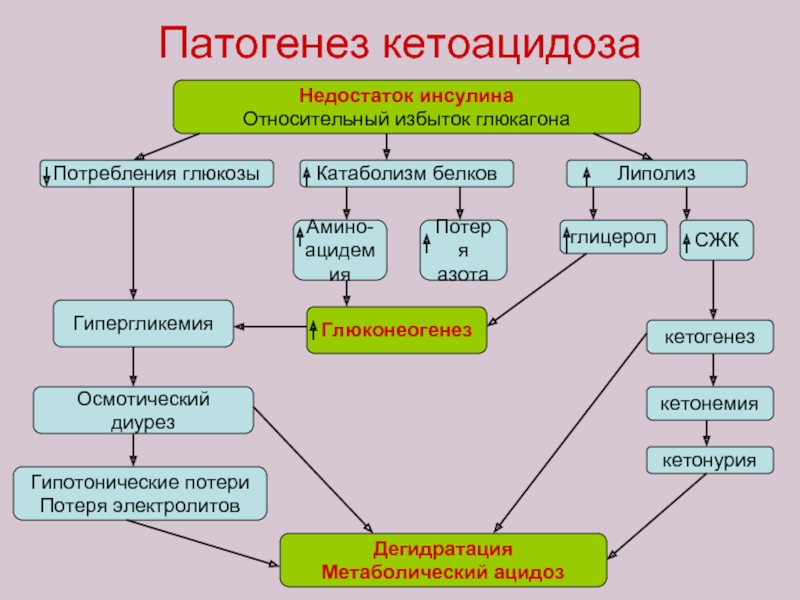
Слайд 87Патогенез кетоацидоза
Недостаток инсулина
Относительный избыток глюкагона
Потребления глюкозы
Катаболизм белков
Липолиз
Амино-
ацидемия
Потеря
азота
глицерол
СЖК
Глюконеогенез
кетогенез
кетонемия
кетонурия
Гипергликемия
Осмотический
Гипотонические потери
Потеря электролитов
Дегидратация
Метаболический ацидоз
Слайд 88 Лабораторная диагностика ДКА
Гипергликемия выше 30-35 ммоль/л
Выраженный кетоз
Неполная кома –
Дегидратирующий диурез
Патологическое дыхание Куссмауля – глубокий вдох и глубокий выдох, одышки нет – ДЦ борется с кетоновыми телами, сигнал мышцам расслабиться – глубокое дыхание
Слайд 89Лабораторная диагностика ГОНК
Гипергликемия до 50-60 ммоль/л
Кетоза нет
Кома глубокая –
Дегидратирующий диурез
Патологического дыхания нет – нет кетоза, нет раздражения ДЦ
Слайд 90Лабораторная диагностика лактоацидоза
(встречается редко, ацидоз вызван лактатом – анаэробный тип гликолиза)
повышен
наблюдается при передозировке сахароснижающих таблеток, особенно у пожилых
Лабораторная диагностика гипогликемии
(при передозировке инсулина)
гипогликемия ниже
потеря сознания
Слайд 91
Хронические осложнения диабета
Fonseca V.A. Clinical diabetes^translating research into practice. 2006
Слайд 92Общая теория осложнений диабета
(Brownlee M.)
Хроническое повышение глюкозы в крови
Fonseca V.A. Clinical
Слайд 93Хронические осложнения сахарного диабета
Макроваскулярные:
Кардиоваскулярные заболевания
Ведущая причина диабетически-зависимых смертей
Микроваскулярные:
Ретинопатия
Ведущая причина слепоты у взрослых
Нефропатия
Составляет около 44% от всех новых случаев ХПН
Нейропатия
60-70% больных имеют поражение периферической нервной системы
National Diabetes Statistics US 2000
Слайд 95Характеристика гликемических кривых у детей раннего возраста при нагрузке различными углеводами
Содержание
У детей нагрузку проводят галактозой, мальтозой, лактозой или комбинируют глюкозу с галактозой.
Слайд 96Методы исследования и интерпретация результатов
Глюкоза - Нормальные величины глюкозы крови,
3,5–5,7 ммоль/л - для лиц в возрасте до 50 лет
4,4–6,2 ммоль/л - для лиц старше 50 лет.
Повышение концентрации глюкозы выше 6,2
ммоль/л - гипергликемия, а уменьшение ниже
3,3 ммоль/л — гипогликемия.
Слайд 97В отличие от разнообразных патологических типов гипергликемии для физиологической гипергликемии наиболее
Относительно достоверным признаком сахарного диабета при однократном определении считают содержание глюкозы натощак выше 7,2 ммоль/л для лиц моложе 50 лет и выше 7,8 ммоль/л — для лиц старше 50 лет.
Слайд 98Причины гипогликемии:
1. Передозировка инсулина или сахароснижающих препаратов у больных сахарным
2. Ульцерогенные аденомы поджелудочной железы, развивающиеся из a-клеток островков Лангерганса (синдром Золлингера-Эллисона).
3. Тяжелые отравления мышьяком, хлороформом, алкогольная интоксикация и др., протекающие с угнетением функции печени, в том числе с нарушением процессов гликогенеза и глюконеогенеза.
4. Заболевания эндокринных органов (Аддисонова болезнь, гипотиреоз, гипопитуитаризм и др.).
5. Опухоли различной локализации (рак надпочечников, рак желудка, фибросаркома, первичный рак печени).
6. Заболевания, сопровождающиеся нарушением всасывания углеводов в кишечнике (энтериты, последствия гастрэктомии, панкреатическая диарея и т. п. ).
7. Алиментарная гипогликемия (длительное голодание).
Слайд 99Биохимическое обследование пациента с гипогликемией включает
Определение уровня глюкозы и инсулина -
Определение уровня С-пептида. Уровни С-пептида в крови подавляются экзогенным введением инсулина, но неадекватно высоки при избыточной эндогенной секреции гормона при инсулиноме.
Слайд 101Термин липиды объединяет ряд структурно и функционально различных соединений, которым присуща
форма депонирования (триацилглицерины, ТГ) и транспорта (свободные жирные кислоты, СЖК) веществ, при распаде которых высвобождается большое количество энергии,
важнейшие структурные компоненты клеточных мембран (свободный холестерол и фосфолипиды)
участие в процессах терморегуляции,
предохранении жизненно важных органов (например, почек) от механических воздействий (травм), потери белка,
в создании эластичности кожных покровов, защите их от избыточного удаления влаги.
Слайд 102 Существуют четыре основных класса ЛП.
Хиломикроны – самые крупные липопротеиновые
ЛПОНП - 10–15% общего ХС и практические все триглицериды крови.
Липопротеины промежуточной плотности Липопротеины промежуточной плотности, содержащие апопротеин Е, так же как и частицы ЛПОНП, имеют два пути метаболизма . Одна их часть удаляется из кровотока печенью с помощью рецепторов к ЛПНП. Другая же часть липопротеинов промежуточной плотности подвергается воздействию печеночной липазы, что ведет к гидролизу оставшихся триглицеридов с образованием ЛПНП
ЛПНП около 3/4 ЛПНП удаляется печенью, а остальная часть – внепеченочными тканями. ЛПОНП и ЛПНП являются атерогенными липопротеинами, т.к. посредством их осуществляется прямой транспорт липидов – от печени к периферическим тканям.
ЛПВП относятся к антиатерогенным липопротеинам, т.к. осуществляют обратный транспорт холестерина. Обратный транспорт холестерина – позитивный процесс, с помощь которого липиды транспортируются из периферических тканей в печень для дальнейшего катаболизма.
Слайд 103Транспорт липидов
Экзогенный путь. В стенке кишечника триглицериды и холестерин, находящиеся
.
Слайд 104Эндогенный путь. Печень синтезирует триглицериды и выделяет их в кровь вместе
Слайд 105 Нарушения липидного обмена связаны в первую очередь с нарушениями их
В зависимости от этиологии различают три группы стеаторей:
панкреатогенная стетаторея обусловлена дефицитом панкреатической липазы. Это приводит к снижению интенсивности процессов гидролитического расщепления в кишечнике триацилглицеридов до глицерина и ЖК. Наблюдается обычно при панкреатинах, гипоплазии поджелудочной железы, наследственном дефиците липазы;
гепатогенная стеаторея связана с нарушением поступления желчи в 12-перстную кишку. В связи с этим жиры не эмульгируются и намного хуже подвергаются гидролизу липазой. Наблюдается при закупорке или сужении желчных путей, гепатитах и циррозе. Помимо стеатореи в кале отсутствуют желчные пигменты;
энтерогенная стеаторея обусловлена снижением метаболической активности слизистой оболочки тонкого отдела, где происходит синтез собственных липидов организма. Наблюдается при наследственном дефиците ферментов синтеза липидов, воспалении слизистой оболочки и обширной резекции тонкого отдела кишечника.
Слайд 106Гиперлипопротеинемии обусловлены замедленным распадом липопротеидного комплекса (недостаточность фермента липопротеинлипазы) или как
Гиперлипопротеинемия в комплексе с гиперхолестеролемией (повышенное содержание в крови холестерола) являются главной причиной атеросклероза.
Слайд 109Общие липиды норма – 4,0-8,0г/л.
Гиперлипидемия (гиперлипемия) – увеличение концентрации общих липидов
Концентрация липидов в крови изменяется при целом ряде патологических состояний. Так, у больных СД наряду с гипергликемией отмечается резко выраженная гиперлипемия (нередко до 10,0-20,0г/л). При нефротическом синдроме, особенно липоидном нефрозе, содержание липидов в крови может достигать еще более высоких цифр – 10,0-50,0г/л.
Гиперлипемия – постоянное состояние у больных с билиарным циррозом печени и у больных с острым гепатитом (особенно в желтушном периоде). Повышенное содержание липидов в крови, как правило, обнаруживается у лиц, страдающих острым или хроническим нефритом, - в случае если заболевание сопровождается отеками (вследствие накопления в плазме ЛПНП и ЛПОНП).
Слайд 110Программы и алгоритмы лабораторной диагностики ДЛП
Скрининговое исследование - содержание общего холестерина.
выраженную ХС - 6,5 ммоль/л (++)
среднюю ХС - 6,5-7,8 ммоль/л (+++)
тяжелую ХС более - 7,8 ммоль/л (++++) гиперхолестеринемию.
Целью следующего этапа диагностического поиска является выявление типа (фенотипирование) ДЛП, включающее в себя:
Оценка внешнего вида плазмы - прозрачная, мутная, молочная: наличие или отсутствие слоя всплывших ХМ при стоянии плазмы: прозрачность или мутность плазмы после всплытия ХМ.
Содержание в плазме общего ХС (ммоль/л)
Содержание в плазме ТГ (ммоль/л)
Содержание в плазме ЛПНП (ммоль/л)
Содержание в плазме ЛПОНП (ммоль/л)
Содержание в плазме ЛПВП (ммоль/л)
Данные электрофореза ЛП плазмы.
Слайд 111Коэффициент Климова (ИА) =
ХС общ. - ХС ЛПВП холестерол ЛПВП
У мужчин 40-60 лет без клинических проявлений атеросклероза величина коэффициента составляет 3,0 -3,5, у лиц с ИБС - более 3,5.
Для дифференциальной диагностики ИБС используют еще один показатель – холестероловый коэффициент атерогенности (ИА):
ХолестеролЛПНП+ХолестеролЛПОНП Холестерол ЛПВП
Слайд 112Снижение уровня холестерина плазмы наблюдаются у больных с недостаточностью питания, при
Гиполипопротеинемии могут быть связаны с
1) нарушением переваривания, всасывания жиров в тонком отделе кишечника, как результат дефицита липазы и нарушениями образования и поступления желчи;
гипертиреозом, который приводит к повышению катаболизма сывороточных липидов;
генетическим нарушением синтеза липопротеинов и хиломикронов.
Слайд 113Все гормоны, влияющие на мобилизацию жира, можно разделить на 2 гр.
Гормоны
Гормоны косвенного действия (глюкокортикостероиды, половые гормоны, лептин).
Адреналин
Мембраны адипоцитов содержат адренорецепторы двух типов. Взаимодействие адреналина с рецепторами обоих типов вызывает изменение концентрации цАМФ. Однако, это влияние разнонаправленное.
адренорецептор связан с ингибирующим G-белком (Gi), связывающим понижение активности аденилатциклазы. Это приводит к уменьшению концентрации цАМФ, и, в конечном счете, торможению липолиза.
адренорецептор связан со стимулирующим G-белком (Gs) - эффектом будет стимуляция липолиза. Соотношение - и -адренорецепторов зависит от индивидуальных особенностей организма. Это касается как организма в целом, так и распределения этих рецепторов в разных частях тела - поэтому в процессе липолиза разные части тела у разных людей "худеют" неодинаково. Однако в целом у человека преобладают -адренорецепторы, поэтому суммарное действие адреналина приводит к активации липолиза.
Слайд 114Соматотропный гормон - стимулирует липолиз, воздействуя через аденилатциклазную систему.
Действие инсулина связано
Глюкокортикостероиды: рецепторы к этим гормонам присутствуют в адипоцитах и содержат в своем составе белки теплового шока. После взаимодействия гормона с рецептором белки теплового шока отделяются, а сам комплекс транспортируется в ядро клетки, где влияет на синтез белков адипоцита. Конкретные механизмы влияния не до конца выяснены и находятся в стадии изучения. В итоге ГКС оказывают двоякое действие: на фоне мышечной работы они стимулируют липолиз, а в состоянии покоя - ингибируют его. Установлено, что при развитии опухоли коры надпочечников или при введении высоких доз препаратов ГКС, наблюдается рост жировых запасов на лице и в верхней части туловища (синдром Иценко-Кушинга).