- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Антибактериальные препараты. Макролиды презентация
Содержание
- 1. Антибактериальные препараты. Макролиды
- 2. Макролиды Макролиды - антибиотики, основу химической структуры
- 3. Классификация В настоящее время класс макролидов
- 4. Механизм действия Макролиды тормозят синтез белка
- 5. Антибактериальная активность Эритромицин, являющийся "золотым стандартом"
- 6. Фармакокинетика Всасывание После приема внутрь макролиды
- 7. Концентрация в крови Пиковые концентрации макролидов
- 8. Распределение Все макролидные антибиотики хорошо распределяются
- 9. Метаболизм и экскреция Макролиды метаболизируются в
- 10. Нежелательные реакции Макролиды рассматриваются как одна
- 11. Лекарственные взаимодействия В процессе биотрансформации 14-членные
Слайд 2Макролиды
Макролиды - антибиотики, основу химической структуры которых составляет макроциклическое лактонное кольцо.
Первый из макролидов - эритромицин, полученный в 1952 г., по сей день широко применяется в клинической практике, наиболее часто - для лечения инфекций дыхательных путей, кожи имягких тканей. Возрастание интереса к макролидам и соответственно расширение сферы их использования произошло в 70 - 80-х годах после открытия таких патогенов, как микоплазмы, хламидии, кампилобактеры и легионеллы. Это послужило одним из стимулов для разработки новых макролидных антибиотиков с улучшенными по сравнению с эритромицином фармакокинетическими и микробиологическими параметрами, а также более благоприятным профилем переносимости.
Слайд 3Классификация
В настоящее время класс макролидов насчитывает более десяти различных препаратов, которые
в зависимости от числа атомов углерода в лактонном кольце делятся на 3 группы:
1) 14-членные макролиды: эритромицин, олеандомицин, рокситромицин, диритромицин, кларитромицин, флуритромицин;
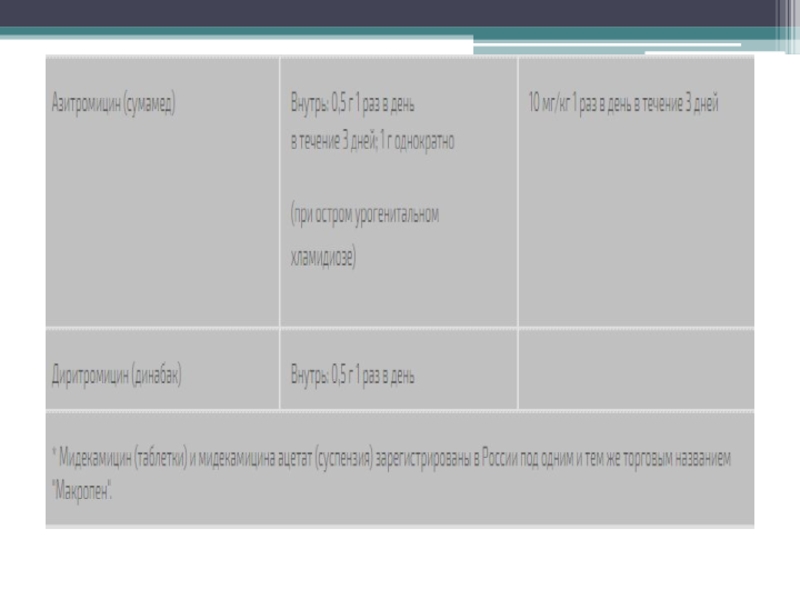
2) 15-членные: азитромицин (является азалидом, так как в кольце имеется атом азота);
3) 16-членные: спирамицин, джосамицин, мидекамицин, миокамицин, рокитамицин.
По происхождению макролиды подразделяются на природные, полусинтетические и пролекарства. Последние, представляя собой эфиры, соли и соли эфиров природных макролидов, характеризуются улучшенным вкусом, большей кислотоустойчивостью и более высокой и стабильной биодоступностью при приеме внутрь по сравнению с исходными продуктами, выпускаемыми в виде оснований.
Структурные особенности предопределяют прежде всего различия в фармакокинетике препаратов. Кроме того, они обусловливают некоторые нюансы их антибактериальной активности, переносимости и лекарственного взаимодействия. В то же время все макролиды обладают одинаковым механизмом действия и имеют в целом близкие антимикробные спектры. Механизмы развития резистентности микрофлоры к ним также являются сходными.
Слайд 4Механизм действия
Макролиды тормозят синтез белка в клетках чувствительных микроорганизмов за счет
связывания с каталитическим пептидилтрансферазным центром рибосомальной 50S-субъединицы. При этом ингибируются реакции транслокации и транспептидации, в результате чего нарушается процесс формирования и наращивания пептидной цепи [2]. Связывание с 50S-субъединицами рибосом характерно также для таких антибиотиков, как линкосамиды, стрептограмины и хлорамфеникол, поэтому при сочетании макролидов с этими препаратами между ними возможны конкуренция и ослабление антимикробного эффекта.
Макролиды являются слабыми основаниями, их активность возрастает в щелочной среде (pH 5,5 - 8,5), так как при этом они меньше ионизируются и лучше проникают внутрь микробной клетки, и резко снижается в кислой среде. Характер антимикробного действия макролидов обычно является бактериостатическим. Однако в высоких концентрациях, при относительно низкой микробной плотности и особенно в отношении тех микроорганизмов, которые находятся в фазе роста, они могут оказывать бактерицидное действие. Такой эффект макролиды проявляют, как правило, против b-гемолитического стрептококка группы А и пневмококка.
Слайд 5Антибактериальная активность
Эритромицин, являющийся "золотым стандартом" макролидов, обладает высокой активностью против грамположительных
кокков, таких как b-гемолитический стрептококк группы А (S. pyogenes), пневмококк (S. pneumoniae), золотистый стафилококк (S. aureus), исключая метициллинрезистентные штаммы последнего. Он хорошо действует на возбудителя коклюша (Bordetella pertussis), палочку дифтерии (Corynebacterium diphtheriae), возбудителя эритразмы (Corynebacterium minutissimum), моракселлу (Moraxella catarrhalis), легионеллы (Legionella spp.), кампилобактеры (Campylobacter spp.), листерии (Listeria monocytogenes), хламидии (Chlamydia trachomatis), микоплазмы (Mycoplasma pneumoniae), уреаплазмы (Ureaplasma urealyticum).
Эритромицин умеренно активен против гемофильной палочки (Haemophilus influenzae), боррелий (Borrelia burgdorferi), возбудителей раневой инфекции при укусах животных (Pasteurella multocida, Eikenella corrodens) и некоторых бактероидов, включая Bacteroides fragilis. Он практически не действует на грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas spp. и Acinetobacter spp., поскольку не проникает через клеточную оболочку данных микроорганизмов [3].
Другие макролиды, имея в целом сходство по спектру и выраженности антимикробного действия с эритромицином, обладают некоторыми особенностями.
Слайд 6Фармакокинетика
Всасывание
После приема внутрь макролиды частично разрушаются под действием соляной кислоты желудка.
В наибольшей степени это касается эритромицина и олеандомицина. Повышенную устойчивость к кислоте имеют кишечнорастворимые лекарственные формы и некоторые эфиры, например эритромицина стеарат. Новые макролиды, особенно кларитромицин, также характеризуются более высокой кислотостабильностью.
Cущественное влияние на биодоступность макролидов может оказывать пища. Всасывание эритромицина при наличии пищи резко снижается, несколько меньшие изменения всасывания характерны для спирамицина, диритромицина и кларитромицина. Пища замедляет скорость абсорбции рокситромицина и азитромицина, не влияя на ее объем .
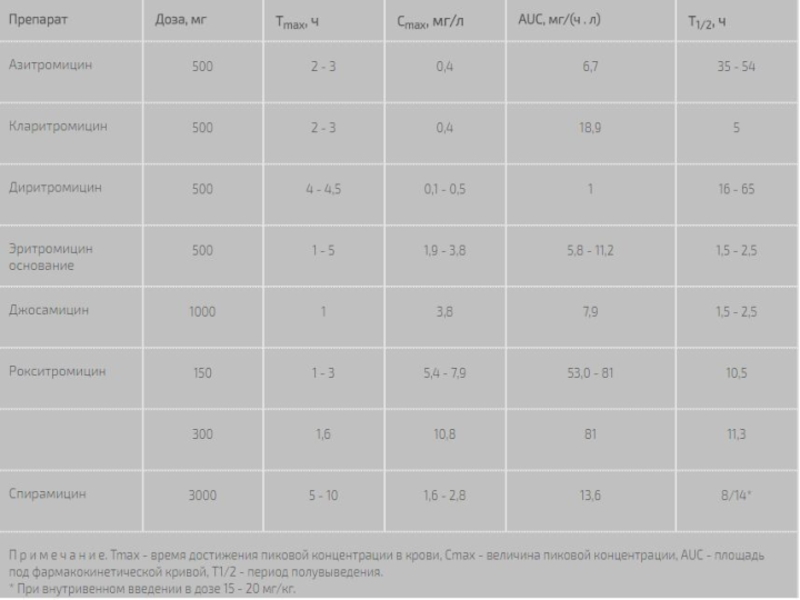
Слайд 7Концентрация в крови
Пиковые концентрации макролидов в сыворотке крови при приеме внутрь
и величины, отражающие площадь под фармакокинетической кривой, зависят от вида препарата и дозы . С повышением дозы антибиотика его биодоступность, как правило, увеличивается. Наиболее высокие сывороточные концентрации отмечаются при приеме рокситромицина, что можно связывать с его относительно низким тканевым аффиннитетом. Самые низкие концентрации в крови характерны для азитромицина, что теоретически может создавать проблемы при инфекциях, сопровождающихся бактериемией.
Важным элементом фармакокинетики макролидов, который отмечается довольно часто, является наличие двух пиков концентрации в крови. Феномен второго пика обусловлен тем, что значительная часть препарата, первично депонированная в желчном пузыре, впоследствии поступает в кишечник и всасывается. У эритромицина величина второго сывороточного пика может превышать уровень первого. При применении азитромицина параллельно второму пику в сыворотке отмечается повторный подъем концентрации в других биологических жидкостях, в частности в лимфе.
При внутривенном введении высокие концентрации макролидов в крови образуются очень быстро. Они превышают уровни, достигаемые при оральном приеме препаратов, так как в данном случае не происходит потерь при всасывании и первичном прохождении антибиотиков через ткани. Как свидетельствуют полученные нами данные, при внутривенном введении эритромицина новорожденным высокие концентрации в крови поддерживаются в течение более длительного периода , чем у детей более старшего возраста [9].
Макролиды в различной степени связываются с белками плазмы, главным образом с a1-гликопротеинами. Наибольшим связыванием характеризуется рокситромицин (92 - 96%), наименьшим - спирамицин (10 - 18%).
Слайд 8Распределение
Все макролидные антибиотики хорошо распределяются в организме, проникая во многие органы,
ткани и среды. По способности проходить через различные гистогематические барьеры (за исключением гематоэнцефалического) макролиды превосходят b-лактамы и аминогликозиды. Достоинством макролидов является способность создавать очень высокие и стабильные концентрации в тканях, превышающие уровень препаратов в сыворотке крови. Так, тканевые концентрации эритромицина в 5 - 10 раз выше, чем сывороточные. Наиболее высокие тканевые уровни, в 10 - 100 раз превышающие концентрации в крови, характерны для азитромицина. Исключение составляет рокситромицин, концентрации которого в тканях меньше, чем в крови, что, по-видимому, обусловлено высокой степенью связывания препарата с белками плазмы.
Макролиды накапливаются в миндалинах, среднем ухе, придаточных пазухах носа, легких, бронхолегочном секрете, плевральной и перитонеальной жидкости, лимфатических узлах, органах малого таза (включая предстательную железу), причем при воспалении проницаемость препаратов в соответствующий очаг увеличивается. Концентрации макролидных антибиотиков, создаваемые в этих органах и средах, превышают их МПК для основных патогенов. В отличие от многих других антибиотиков макролиды хорошо проникают внутрь клеток и создают высокие внутриклеточные концентрации, что имеет важное значение при лечении инфекций, вызванных внутриклеточными патогенами (Mycoplasma spp., Chlamydia spp., Legionella spp. и др.). Существенным является также то, что макролиды (в большей степени азитромицин и кларитромицин) способны проникать внутрь фагоцитарных клеток, таких как макрофаги, фибробласты, полиморфноядерные гранулоциты, и с ними транспортироваться в воспалительный очаг
Макролиды накапливаются в миндалинах, среднем ухе, придаточных пазухах носа, легких, бронхолегочном секрете, плевральной и перитонеальной жидкости, лимфатических узлах, органах малого таза (включая предстательную железу), причем при воспалении проницаемость препаратов в соответствующий очаг увеличивается. Концентрации макролидных антибиотиков, создаваемые в этих органах и средах, превышают их МПК для основных патогенов. В отличие от многих других антибиотиков макролиды хорошо проникают внутрь клеток и создают высокие внутриклеточные концентрации, что имеет важное значение при лечении инфекций, вызванных внутриклеточными патогенами (Mycoplasma spp., Chlamydia spp., Legionella spp. и др.). Существенным является также то, что макролиды (в большей степени азитромицин и кларитромицин) способны проникать внутрь фагоцитарных клеток, таких как макрофаги, фибробласты, полиморфноядерные гранулоциты, и с ними транспортироваться в воспалительный очаг
Слайд 9Метаболизм и экскреция
Макролиды метаболизируются в печени при участии цитохрома Р-450 (изоформа
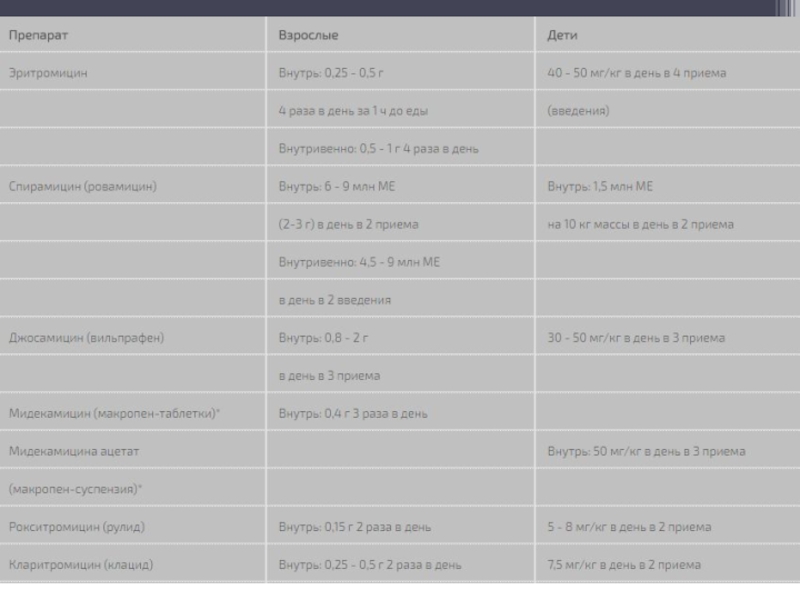
CYP3A4) с образованием как неактивных метаболитов, так и соединений, обладающих антибактериальным свойствами (например, 14-гидроксикларитромицин). Метаболиты выделяются преимущественно с желчью и далее с фекалиями. Почечная экскреция составляет 5 - 10%. Период полувыведения варьирует от 1,5 (эритромицин, джосамицин) до 65 (диритромицин) ч. При нарушении функции почек период полувыведения большинства макролидов (за исключением кларитромицина и рокситромицина) не изменяется, поэтому коррекции режимов дозирования не требуется. При циррозе печени может значительно увеличиваться период полувыведения эритромицина и джосамицина.
Слайд 10Нежелательные реакции
Макролиды рассматриваются как одна из самых безопасных групп антибиотиков, очень
редко вызывающих серьезные нежелательные реакции. Наиболее типичными для макролидов являются реакции со стороны верхних отделов желудочно-кишечного тракта в виде болей, тошноты и рвоты, которые чаще возникают при оральном приеме высоких доз препаратов, но могут наблюдаться и при внутривенном введении. Развитие диспептических расстройств наиболее характерно для эритромицина и олеандомицина, что связано с их стимулирующим действием на моторику желудочно-кишечного тракта. Установлено, что данные препараты являются агонистами рецепторов, чувствительных к эндогенному стимулятору моторики мотилину. Другие 14-членные макролиды (рокситромицин, кларитромицин), азалиды (азитромицин) и 16-членные препараты (спирамицин, джосамицин) реже вызывают диспептические явления. Нежелательные реакции со стороны нижних отделов кишечника возникают редко, хотя описаны случаи развития диареи.
При длительном применении эритромицина и тролеандомицина может развиться холестатический гепатит, сопровождающийся желтухой, приступообразными болями в животе, эозинофилией и высоким уровнем печеночных трансаминаз в сыворотке крови. В редких случаях при назначении высоких доз эритромицина и кларитромицина, особенно больным с нарушениями функции почек, наблюдаются обратимые ототоксические реакции, проявляющиеся ухудшением слуха и звоном в ушах. При внутривенном введении макролидов могут отмечаться тромбофлебиты, факторами риска развития которых являются быстрое введение и высокая концентрация растворов. Возможно развитие суперинфекции (Candida, грамотрицательные бактерии) в желудочно-кишечном тракте или влагалище. Гиперчувствительность к макролидным антибиотикам отмечается очень редко [8,11].
При длительном применении эритромицина и тролеандомицина может развиться холестатический гепатит, сопровождающийся желтухой, приступообразными болями в животе, эозинофилией и высоким уровнем печеночных трансаминаз в сыворотке крови. В редких случаях при назначении высоких доз эритромицина и кларитромицина, особенно больным с нарушениями функции почек, наблюдаются обратимые ототоксические реакции, проявляющиеся ухудшением слуха и звоном в ушах. При внутривенном введении макролидов могут отмечаться тромбофлебиты, факторами риска развития которых являются быстрое введение и высокая концентрация растворов. Возможно развитие суперинфекции (Candida, грамотрицательные бактерии) в желудочно-кишечном тракте или влагалище. Гиперчувствительность к макролидным антибиотикам отмечается очень редко [8,11].
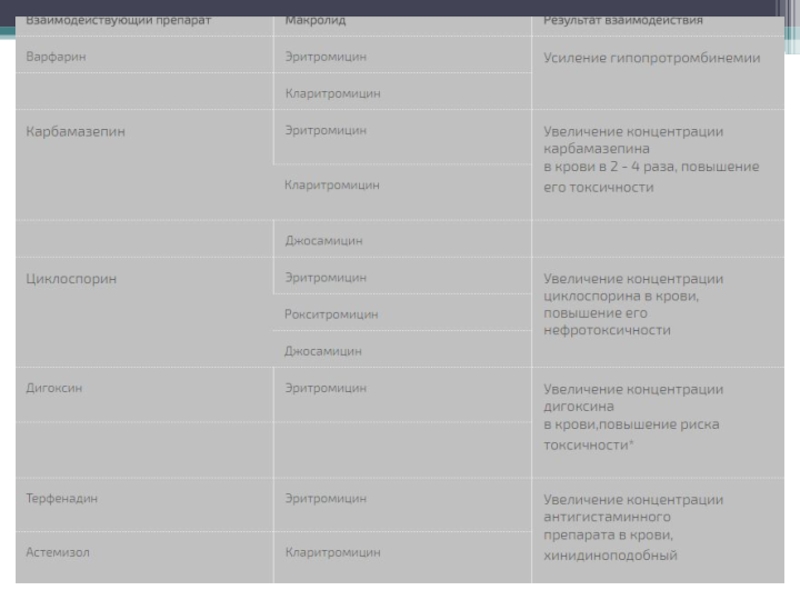
Слайд 11Лекарственные взаимодействия
В процессе биотрансформации 14-членные макролидные антибиотики способны превращаться в нитрозоалкановые
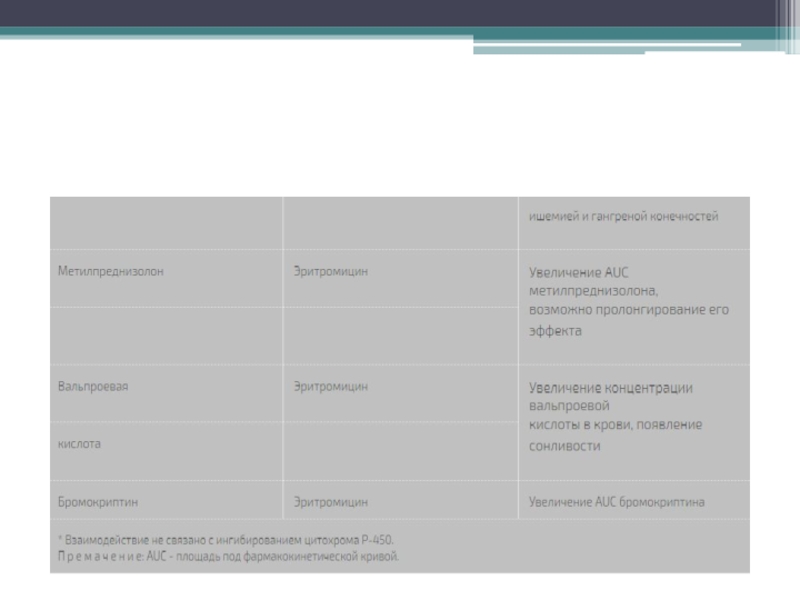
формы, которые связываются с цитохромом Р-450 и образуют с ним неактивные комплексы. Тем самым макролиды могут тормозить метаболизм в печени других лекарсa:2:{s:4:"TEXT";s:72666:"твенных препаратов, повышая их концентрацию в крови и усиливая не только терапевтические эффекты, но и риск токсичности. Наиболее сильным ингибитором цитохрома Р-450 является тролеандомицин. Другие препараты по выраженности такого действия можно расположить в следующем порядке: кларитромицин > эритромицин > рокситромицин > азитромицин > спирамицин [12]. Большинство сообщений об имеющем клиническое значение лекарственном взаимодействии макролидов касается эритромицина и кларитромицина. Использование их в сочетании с варфарином, карбамазепином или теофиллином чревато развитием нежелательных реакций, свойственных последним.
Следует избегать одновременного назначения эритромицина (и, возможно, других макролидов) и циклоспорина. При сочетании эритромицина с ловастатином отмечены случаи тяжелой миопатии и рабдомиолиза. Антигистаминные препараты терфенадин и астемизол, а также прокинетик цизаприд противопоказаны больным, принимающим эритромицин или кларитромицин, вследствие высокого риска развития фатальных нарушений сердечного ритма.
Макролиды способны повышать биодоступность дигоксина при приеме внутрь благодаря подавлению микрофлоры толстой кишки (Eubacterium lentum), которая инактивирует дигоксин. Всасывание некоторых макролидов, особенно азитромицина, в желудочно-кишечном тракте может ослабляться при приеме антацидов. В целом, проблема взаимодействия макролидов с другими лекарственными препаратами является динамично развивающейся областью клинической фармакологии. В ней постоянно появляется новая информация, что связано с расширением контингента пациентов, получающих эти антибиотики.
Макролиды способны повышать биодоступность дигоксина при приеме внутрь благодаря подавлению микрофлоры толстой кишки (Eubacterium lentum), которая инактивирует дигоксин. Всасывание некоторых макролидов, особенно азитромицина, в желудочно-кишечном тракте может ослабляться при приеме антацидов. В целом, проблема взаимодействия макролидов с другими лекарственными препаратами является динамично развивающейся областью клинической фармакологии. В ней постоянно появляется новая информация, что связано с расширением контингента пациентов, получающих эти антибиотики.