Слайд 2Введение
За последние 30 лет активного развития ветеринарии экзотических животных для анестезии
рептилий предприняты попытки использования большинства препаратов, применяемых в медицинской и ветеринарной анестезиологии. Накопленный опыт свидетельствует о том, что целый ряд общепринятых средств аналгезии и седации теплокровных не оказывает действия на рептилий, а дозы эффективных лекарств и динамика их действия значительно отличаются у представителей различных систематических групп.
Фармакокинетика дыхательных и сердечных стимуляторов, ганглиоблокаторов, парасимпатолитиков, нейролептиков, анальгетиков и диуретиков у пресмыкающихся практически не изучена, данные различных авторов зачастую противоречивы.
Бородатая агама (сверху) и маисовый полоз (снизу) в ходе исследования анальгетического действия опиоидов на рептилий.
Фото с сайта https://www.researchgate.net
Слайд 3Особенности анастезии у рептилий
Анатомо-физиологические особенности рептилий не позволяют напрямую использовать методы
иммобилизации и наркоза, широко применяемые для теплокровных. Основную сложность для анестезиолога представляет относительно медленный обмен веществ у рептилий по сравнению с млекопитающими, при этом увеличивается период индукции препаратов при любом способе введения, значительно (до нескольких суток) удлиняется время остаточного действия и в целом резко сужается широта терапевтического действия средств для наркоза, дозы, необходимые для достижения надежной седации, вплотную приближаются к токсическим.
Например, доза кетамина, необходимая для надежного хирургического наркоза черепахи, составляет 100 мг на кг, а 110 мг на кг вызывают необратимую остановку дыхания.
До некоторой степени регулировать обмен веществ можно поддерживая температуру террариума на уровне +28-+30С в течение 2-3 суток перед операцией и не ниже +28С в послеоперационном периоде, а на время вмешательства снижая температуру в операционной до +24-+26С для уменьшения активности животного и продления наркоза без дополнительного введения препаратов.
Однако никогда, даже в случае экстренных операций, не следует анестезировать сильно охлажденную рептилию.
Расчет доз следует производить с учетом веса и размера пациента. Следует отметить, что у рептилий не соблюдается правило скейлинга: с увеличением размера доза действующего вещества на кг живой массы не уменьшается, а несколько возрастает.
В случае выраженного обезвоживания возникает риск передозировать препараты ориентируясь только на параметры веса. Кроме того, при гиповолемии снижается клиренс лекарственных веществ в следствие реабсорбции в нефронах, что может привести к повышению нефротоксичности. Такие животные нуждаются в обязательной регидратации. После устранения явных признаков обезвоживания можно дозировать средства для наркоза в соответствии весу.

Слайд 4Боль и анальгезия у рептилий
Если в хирургии высших позвоночных анальгезия является
необходимой частью анестетического протокола и затем, как правило, применяется при ведении постоперационных больных, то для рептилий специальные анальгезируюшие препараты применяют редко. Это связано с тем, что препараты многих фармакологических групп (например, ненаркотические анальгетики) не вызывают у этих животных терапевтического эффекта в общепринятых дозах, для других препаратов эти дозы приближаются к токсическим, и существует большой риск видоспецифических реакций. Кроме того, сложно дифференцировать поведение у рептилий, испытывающих боль.
Вместе с тем у рептилий, как и у млекопитающих, механизмы, модулирующие боль, вызывают соответствующие поведенческие реакции на болезненные стимулы. При этом в ответ на стимулы, близкие к пороговым, активность обычно возрастает, как и у высших позвоночных (зашита, агрессия, вокализация, избегание и т.д.), и наоборот, в ответ на болезненные стимулы, вызванные повреждением, активность снижается. У рептилий физиологические стрессовые реакции аналогичны теплокровным и включают в себя сужение сосудов, повышение частоты сердечных сокращений и систолического объема, понижение тонуса кишечника и мочевого пузыря, эндокринные реакции, приводящие к нарастанию катаболических процессов и снижению СКФ почек. Ноцицептивная стимуляция мозга также усиливает симпатические реакции, в результате чего увеличивается вязкость и время свертывания крови, фибринолиз и агрегация тромбоцитов. Такие явления часто сопровождают травмы, хирургические вмешательства и другие болезненные процедуры.

Слайд 5Торпидные состояния
Наши представления о рептилиях как о животных, не испытывающих боли
(или, по крайней мере, имеющих значительно более высокие болевые пороги), основаны, вероятно, на способности многих видов впадать в т.н. торпидные состояния даже без болезненных стимулов. Это состояние полного замирания всех физиологических функций, включая видимое дыхание и сердцебиение, практически на сутки. В таком состоянии некоторые ящерицы, например крокодиловый шинизавр, способны сутки пролежать под водой на дне водоема и уж тем более они способны никак не реагировать на болезненные стимулы.
В повышении болевых порогов, так же как и в развитии торпидных состояний, у рептилий и амфибий большую роль играют эндогенные опиаты. Особенно эффект эндогенных опиатов выражен у зимующих видов. Так, у адаптированных к холоду амфибий налоксон-реверсивные болевые пороги достоверно выше, чем у теплолюбивых видов. В ответ на фиксацию или лабораторные стрессы многие рептилии и амфибии показывают стресс-индуцированную анальгезию, которую не удается блокировать налоксоном.
Слайд 6Анальгезия
В клинической практике анальгетики назначают рептилиям при применении инвазивных процедур, во
время хирургических вмешательств, постоперационным больным и при генерализованных заболеваниях, сопровождаемых болевым синдромом, — как компонент консервативной терапии.
Дозы анальгетиков для рептилий чаще всего подбирают эмпирически из клинической практики и назначают схему только для конкретного или близкого вида, очень редко — основываясь на данных фармакокинетики. При применении таких препаратов возможны видоспецифичные реакции; кроме того, дозы значительно варьируют среди основных отрядов рептилий, а также у водных и сухопутных видов.
Общее состояние пациента и, прежде всего, статус гидратации и температура оказывают значительное влияние на фармакокинетику анальгетиков. Поэтому во многих справочниках рекомендуются очень широкие диапазоны доз для отдельных видов рептилий, которые определяют скорее не дозу, а ее порядковое значение. При работе с плохо изученными видами всегда следует начинать с минимальных доз.
Послеоперационные боли у черепах можно облегчить с помощью нестероидных противовоспалительных средств. Рекомендуется эмпирическая доза 1 мг/кг флюниксина каждые 24 часа внутримышечно. О кровотечениях, связанных с применением препаратов этой группы у рептилий, в литературе не сообщалось.

Слайд 7Средства для анальгезии рептилий
В современной практике для рептилий применяют в основном
нестероидные противовоспалительные средства и опиаты. На практике, как правило, используются буторфанол (Moradol) и карпрофен (Rimadyl).
Слайд 8Болевой синдром при заболеваниях
Болевой синдром иногда сопутствует некоторым заболеваниям. При этом
элементы агонистического поведения обычны при острых локальных болях, например, при брыжеечной и почечной колике, травмах, некрозах, циститах и уролитиазе, ожогах, панкреатите, метиоризме, пододерматитах, подагре.
И наоборот, гиподинамия и ступорозные состояния, как правило, сопровождают тяжелые генерализованные заболевания, связанные с интоксикацией: перитонит, пневмонию, септические артриты, опухоли, почечную недостаточность, гепатиты, остеомиелит, вторичный гиперпаратиреоидизм, каловый завал, высокую кишечную непроходимость и т.п.
Слайд 9Характерные нарушения нормального поведения при болевом синдроме
анорексия, закрытые глаза,
атипичные позы (например,
изгибание тела дорсально или вбок, поднимание или вытягивание головы),
повышенная подвижность, повышенная настороженность,
манежные движения, изменения окраски (стрессовая окраска),
гиподинамия, замкнутость и скрытность, избегание обогрева,
летаргия (при этом животное сохраняет неподвижность вне обогрева долгий период времени),
царапанье конечностью или сокращения мышц в области болевых ощущений,
агрессия у пассивных в норме особей, внезапные конвульсии или элементы агрессии (например, хлестание хвостом) у одиночно содержащихся ящериц,
дисфагия, аэрофагия, вызывающая вздутие желудка,
болезненность и напряжение мышц при пальпации (например, брюшной стенки),
хромота и атаксия.
Слайд 10Местная анестезия
Местные анестетики в ветеринарии рептилий применяют для анальгезии при минимальных
вмешательствах, при взятии биопсии и некоторых других диагностических процедурах, а также при сочетанном наркозе.
Рептилии и птицы обладают гиперчувствительностью к новокаину. У мелких млекопитающих его передозировка проявляется конвульсиями, но, так как препарат быстро метаболизируется печенью, кумулятивного эффекта обычно не наступает. Этого нельзя сказать о рептилиях, у которых основное выделение препарата происходит за счет клубочковой фильтрации, и поэтому период полувыведения новокаина оказывается дольше расчетного.
Для местной анестезии рептилий не применяют новокаин и другие препараты эфирного ряда, высвобождающие парааминобензойную кислоту. Литературные данные свидетельствуют, что даже в низких дозах новокаин вызывает у рептилий возбуждение и затем паралич центральной нервной системы. Системное действие новокаина, которое он оказывает на млекопитающих, заключается в понижении возбудимости периферических холинэргических систем, миокарда и моторных зон коры большого мозга, а также блоке вегетативных ганглиев. У рептилий и птиц эти эффекты более выражены, поэтому новокаин сейчас полностью исключен из практики с этими животными.

Слайд 11Местная анестезия. Лидокаин
Лидокаин и некоторые его гомологи широко применяют в практике
с рептилиями для поверхностной аналгезии слизистых оболочек, инфильтрационной, проводниковой и регионарной анестезии при хирургических вмешательствах. Для поверхностной анестезии при интубации традиционно применяли новокаин (citocain), но сейчас перешли на 10% спрей лидокаина. Некоторые анестетики эфирного ряда по-прежнему применяют для обезболивания конъюнктивы и роговицы (пропакаин, аметокаин). Для локальной инфильтрации рептилиям применяют 0,5-1 % раствор лидокаина, без добавления адреналина. Им обезболивают кожу, нервные окончания, надкостницу, синовиальные мембраны и подслизистый слой. Подкожная клетчатка, жировая ткань, мышцы, связки, фасции, кость, хрящ и брыжейки не чувствительны к лидокаину.
Для линейного блока млекопитающим используют более концентрированные растворы. Однако не рекомендуется проводить линейный блок рептилиям из-за различий в анатомии даже у близких видов и отсутствия выраженного эпидурального пространства, т.о. любые инъекции будут попадать субдурально, что чревато компрессией или прямым токсическим воздействием на спинной мозг. Внутривенную регионарную анестезию лидокаином проводят при высокой ампутации хвоста и операциях на конечностях. При использовании 7% раствора лидокаина эффект наступает через 3-5 минут и длится около 90 минут. Такая анестезия может быть чревата расслаблением анального сфинктера или ретракторов гемипенисов и иногда заканчивается пролапсом органов клоаки.
Практически не разработаны методы проводниковой анестезии. Иногда ее применяют для блокады нижнечелюстной ветви при операциях на мандибуле у игуан, также низкая сакральная анестезия применяется при операциях на клоаке у черепах.

Слайд 12Местная анестезия
Описаны случаи гибели игуаны, болотной черепахи, обыкновенного удава и явления
интоксикации у нескольких хамелеонов и агам от передозировки лидокаина. Симптомы включали диспноэ, фасцикуляцию и смерть от прогрессирующей сердечной недостаточности и, возможно, коллапса в течение 15-60 минут. Похоже, что токсическая доза для здоровых рептилий составляет не менее 40 мг/кг (2 мл 2% раствора), но у ослабленных животных возможны токсические реакции и при меньших дозах, поэтому лучше не превышать дозу 20 мг/кг и использовать более слабые растворы (0,5 - 1%).
В зарубежных клиниках нередко используют мепивикаин как наименее токсичный и бупивикаин, который обладает пролонгированным действием. Тримекаин - одно из главных средств наркоза для амфибий, дающий при накожном применении общую анестезию с хорошей адинамией и аналгезирующим эффектом.
Низкая сакральная анестезия лидокаином красноухой черепахе с предварительной седацией дексмедетомидином/кетамином/мидазоламом.
Фото с сайта https://www.researchgate.net
Слайд 13
Подготовка пациента
Перед анестезией рекомендуется провести общий осмотр и некоторые лабораторные исследования,
включающие взвешивание, определение гематокрита, проведение ОКА и биохимического исследования крови, а также копроскопию. Это позволяет в некоторых случаях выявить скрытые патологии печени или почек, достаточно широко распространенные у рептилий. Подозрение на заболевания из этой группы влияет на анестезиологический протокол и ограничивает выбор средств для наркоза. Во время осмотра важно определить ЧСС и ЧДД, хотя оба эти параметра у не анестезированных животных могут быть повышены вследствие стресса.
Перед операцией за 5 - 7 дней необходимо прекратить кормление. Это улучшает дыхание, так как наполненный кишечник вызывает компрессию легких.
Голодную диету назначат только здоровым рептилиям, так как больные обычно не питаются. Рвотный рефлекс для рептилий не характерен, и, кроме того, гортанная щель в норме открывается только во время вдоха, а у анестезированных животных, как правило, остается закрытой, поэтому аспирация содержимого желудка маловероятна. Змеям с наполненным желудком (2 - 5 суток после кормления) лучше отложить операцию. Это же касается животных, находящихся в линьке.
Парентеральную регидратацию назначают всем плановым больным в объеме 20 - 30 мл/кг в сутки за 1 - 3 дня до операции. При экстренных вмешательствах замещение ОЦК начинают за 1 - 2 часа до операции (рассчитав объем и скорость инфузии) и затем при необходимости продолжают и в процессе самой операции. Периоперативная регидратация показана при любых операциях, длящихся более часа. Рекомендуемая скорость введения жидкости составляет 5 мл/кг/час внутривенно или внутрикостно.
Пероральная регидратация.
Фото Д.Б. Васильев, Московский зоопарк
Установление бранюли в вену голени.
Фото Д.Б. Васильев, Московский зоопарк

Слайд 14Интубация
Интубацию проводят всем пациентам, независимо от метода проведения наркоза, если операция
занимает более 15 минут. У рептилий гортанная щель открывается только при вдохе с помощью мышцы-дилататора глотки. В стадии покоя гортанная щель остается закрытой, в отличие от птиц и млекопитающих. Поэтому даже при инъекционном мононаркозе рекомендуется эндотрахеальная интубация.
Трахея у рептилий легко доступна для интубации и на фоне вводного инъекционного седатива в нее легко ввести интубационную трубку соответствующего калибра или катетер. Мелким экземплярам, как правило, удается ввести катетер для центральной вены (0,6 мм) или мочеточниковыи катетер (0,4 мм).
При остановке спонтанного дыхания не сложно проводить искусственную вентиляцию легких с помощью мешка Амбу или шприца соответствующего объема с частотой 2-3 вдоха в минуту.
Водные черепахи в норме способны надолго задерживать дыхание и переходить к анаэробному окислению. Например, черепахи рода Pseudemis способны выживать в среде 100% азота до 27 часов. Известны случаи, когда самостоятельное дыхание, утраченное в процессе операции, возвращалось к черепахе спустя 8 часов. Спинное положение во время операции способствует сдавливанию легких и затрудняет внешнее дыхание. У черепах, помимо этого, сложно проконтролировать дыхание визуально.
Сухопутные черепахи используют для дыхания мышцы передних конечностей и шеи. В стадии хирургического наркоза миорелаксация легко может привести к остановке самостоятельного дыхания, даже если не угнетен дыхательный центр. Все эти особенности повышают шанс остановки дыхания в процессе операции, особенно при использовании инъекционных наркотических средств.

Слайд 15Премедикация. Атропин
Антихолинэргические средства, и прежде всего атропин, раньше предлагали вводить в
рутинную схему премедикации для устранения гиперсаливации и риска брадикардии. Следует отметить, что у многих ящериц снижение сердечного ритма происходит в норме в процессе анестезии и не является осложнением, вызванным побочным действием или передозировкой препарата. Для некоторых особей в предоперационный период наоборот, характерна тахикардия. Поэтому на данный момент не рекомендуется назначать атропин перед любой операцией, за исключением случаев выраженной предоперационной брадикардии или развития брадикардии в латентный период.
Премедикация с использованием холинолитиков может быть необходима для мелких черепах, у которых даже незначительное повышение саливации может вызвать аспирацию слюны в трахею.
Гликопирролат считается несколько более эффективным, хотя в эксперименте, проведенном на 8 здоровых игуанах, не было выявлено достоверных различий ни при внутривенном ни при внутримышечном введении гликопирролата и атропина (Расе, Mader, 2002).
Атропин (0,01 - 0,04 мг/кг внутримышечно или интрацеломически) или гликопирролат (0,01 мг/кг внутримышечно или подкожно) рекомендуют вводить за 15 минут до начала анестезии.

Слайд 16Премедикация. Фенотиазины
Хлорпромазин (аминазин) и ацепромазин (ветранквил) при введении внутримышечно за 40
- 60 минут до наркоза позволяют в 2 - 3 раза снизить дозы барбитуратов или кетамина.
Ацепромазин в дозах 0,1 - 0,5 мг/кг у черепах вызывает степень седации, достаточную для выполнения неболезненных вмешательств. Сведения по его применению для других рептилий в литературе отсутствуют.
Для рептилий рекомендуемые дозы ацепромазина в 5 - 10 раз превышают дозы для млекопитающих. Аминазин в дозе 10 мг/кг внутримышечно вызывает у большинства черепах эффект, аналогичный ацепромазину.
Премедикация фенотиазинами достоверно облегчает и ускоряет восстановительный период при анестезии рептилий, чувствительных к этому препарату.
УЗИ шпороносной африканской черепахе после премедикации с использованием комбинации дексмедетомидина (0.075 мг/кг), мидазолама (1 мг/кг) и кетамина (2,5 мг/кг).
Фото с сайта https://www.researchgate.net
Слайд 17Премедикация. Бензодиазепины
Бензодиазепины используются преимущественно для подготовки к иммобилизации миорелаксантами или для
короткой седации перед наркозом.
Диазепам в дозе 0,22 - 0,62 мг/кг за 20 минут до введения сукцинилхолина (дитилина) у миссисипского аллигатора и кетамина у других рептилий потенцирует их действие, сокращает и облегчает индукцию.
Однако данные по его применению у разных видов рептилий противоречивы, а рекомендуемые разными авторами дозы варьируют в широких пределах.
Для снятия судорожного синдрома при применении диссоциативных анестетиков диазепам рекомендуют в дозе 2,5 мг/кг внутримышечно или внутривенно. По другим данным не рекомендуется превышать дозы 0,4 мг/кг.
Мидазолам в дозе 1 - 2 мг/кг внутримышечно усиливал эффект кетамина у каймановой черепахи, однако впоследствии выяснили, что эффект мидазолама варьируется у разных видов черепах. У красноухих черепах мидазолам вызывал седативный эффект в дозах от 1,5 мг/кг, который в среднем длился 82 минуты. Латентный период составлял 5,5 минут, восстановительный - 40 минут. При этом индивидуальная чувствительность у животных широко варьировала.
Предполагается, что различный эффект мидазолама и, возможно, других бензодиазепинов зависит от видоспецифического распространения ГАМК-рецепторов в разных семействах рептилий и различия нейрорецепторных механизмов в филогенетически не одинаковых группах.
Сведения о применении мидазолама для ящериц и змей в литературе встречаются редко. Мидазолам в дозе 2 - 2,5 мг/кг вызывает хорошую седацию у зеленых игуан на срок около 40 минут. Гиподинамия сохраняется у ящериц еще в течение 1 - 2 часов. Флумазенил производит достаточно быструю реверсию седативного эффекта мидазолама.
Повышение дозы мидазолама более 2 мг/кг может быть опасным для ослабленных пациентов. При переходе на ингаляционный наркоз после индукции мидазоламом в ряде случаев наблюдалось пролонгированное апноэ и брадикардия у нескольких игуан и синеязыкого сцинка (со смертельным исходом), причем реверсии флумазенилом не происходило.

Слайд 18Премедикация. α-адреномиметики
Ксилазин обычно не потенцирует действие кетамина, и эту классическую комбинацию
для рептилий не применяют. Впрочем, здесь данные различных авторов также противоречивы. Ксилазин назначали в дозах 0,1 — 1,25 мг/кг разным видам рептилий, причем при анестезии нильского крокодила комбинация 20 мг/кг кетамина и 1 мг/кг ксилазина оказывала синергичное действие, а у красноухих черепах такой эффект отсутствовал.
Другая комбинация диссоциативного анестетика с α2-адреномиметиком — золетил — вполне успешно применяется для крупных змей. Для ящериц, особенно мелких, потенцированный α2-адреномиметиком наркоз может быть опасен из-за выраженного угнетения дыхания и кровообращения.
Медетомидин - другой препарат этой группы, в последнее время получил достаточно широкое распространение при анестезии черепах. Этот препарат используется в комбинации с кетамином. Для сухопутных черепах рекомендуют 150 мкг/кг медетомидина и 5-10 мг/кг кетамина, смешанных в одном шприце. Для водных черепах дозу медетомидина увеличивают вдвое. Препараты вводят внутримышечно или внутривенно. В рекомендованных дозах вызывают седацию через 15-45 минут, достаточную для проведения неболезненых вмешательств или интубации. Для водных черепах также рекомендуют кетамин (5 — 20 мг/кг), медетомидин (100-300 мкг/кг) и буторфанол (0,4 мг/кг), комбинированные в одном шприце. Смесь вводят медленно внутривенно, и это дает неплохую анестезию, достаточную для коротких вмешательств. Для игуан предложены дозы 5-10 мг/кг кетамина и 100-150 мкг/кг медетомидина внутримышечно. Для крокодилов – 20 мг/кг кетамина и 150 мкг/кг медетомидина, однако реакции на введение последнего широко варьируют. В этой группе животных чаще отмечается угнетение дыхания и сердечной деятельности. Действие медетомидина и комбинаций этого препарата подвержено реверсии α2-антагонистом — атипамезолом. Рептилиям атипамезол вводят внутривенно, в таких же дозах, как и млекопитающим (в 5-кратной дозировке по отношению к медетомидину). Следует отметить, что реверсия после введения атипамезола обычно наблюдается значительно позже, чем у млекопитающих.

Слайд 19Премедикация. Опиоиды
Применение опиоидов для рептилий имеет свои ограничения. Как правило, требуется
значительное увеличение доз, а, кроме того, отмечены широкие видоспецифические реакции.
В последнее время все чаще используют буторфанол для премедикации и вводного наркоза с последующим переходом на ингаляционный наркоз, отдавая ему предпочтение перед бензодиазепинами и α2-адреномиметиками. Это, прежде всего, связано с хорошим аналгезирующим действием препарата, а, кроме того, с его низкой стоимостью. Аналгезирующие дозы должны быть меньше — порядка 0,05-0,4 мг/кг. Для достижения седативного эффекта дозы повышают до 1,5-2 мг/кг и вводят препарат за 30 минут до подачи газа. У игуан поверхностную седацию можно наблюдать в дозах от 1,5 мг/кг.
Слайд 20Премедикация. Барбитураты
Барбитураты характеризуются долгим и непредсказуемым временем индукции и очень долгим
восстановительным периодом, и поэтому в настоящее время редко используются в анастезиологии рептилий. Рептилии часто дают индивидуальные и видоспецифические реакции на препараты этой группы. Механизм выведения барбитуратов из организма рептилий не изучен.
Некоторые авторы рекомендуют барбитураты и для премедикации, и для собственно индукционного наркоза (Jackson, Cooper, 1981; McArthur, 1996). Для разных видов рептилий с успехом применяли тиопентал натрия в форме 2% раствора, интрацеламически, в дозах 15 - 30 мг/кг, латентный период 25 - 45 мин., длительность 25 - 125 мин., остаточное действие 2-7 суток; пентабарбитал натрия в виде 2% раствора, внутривенно, внутримышечно или интрацеломически в дозе 10 - 30 мг/кг, латентный период 40 - 60 мин., длительность 25 - 35 мин., остаточное действие 2 - 7 суток.
Использование нембутала в дозе 200 мг/кг — один из признанных способов эвтаназии рептилий.
Метогекситал — барбитурат ультракороткого действия. Эффект этого препарата на рептилий также оказывается коротким. Препарат можно применять и для очень мелких пациентов подкожно в дозах от 5 до 20 мг/кг. Пациентам с массой тела менее 5 г вводят 0,125% раствор, для рептилий массой от 5 до 100 г — 0,25% раствор и 1% раствор для животных более 100 г. Некоторые виды рептилий, по-видимому, более чувствительны к этому препарату, а при работе с молодыми ящерицами и змеями дозу уменьшают.

Слайд 21Премедикация. Миорелаксанты
Миорелаксанты применяют для непродолжительного обездвиживания, при недостаточной релаксации в процессе
оперативного вмешательства (при контролируемом дыхании) и при операциях на грудной полости.
Дитилин (сукцинилхолин) – деполяризующий миорелаксант — в основном применяют для кратковременного обездвиживания крупных крокодилов и черепах. Дозы для разных видов рептилий варьируются. Для черепах рекомендуют дозы 0,5-1,5 мг/кг, для крупных ящериц — 0,75-1 мг/кг, а для крокодилов — 0,5-2 мг/кг. Адинамия длится около 20 минут, восстановительный период занимает 45-90 минут.
Недеполяризующие миорелаксанты для иммобилизации предпочтительнее, так как позволяют провести реверсию антихолинэстеразными препаратами. Для этого обычно вводят 0,05 мг/кг прозерина и 0,02 мг/кг атропина внутривенно или внутримышечно. Один из недеполяризующих миорелаксанотов — галламин (галламина триэтиодид) сейчас является препаратом выбора при иммобилизации крупных крокодилов. Для них используют дозы 0,6 - 4 мг/кг внутримышечно.
Для ящериц необходимость применения миорелаксантов возникает редко. В некоторых странах (например, в Канаде) применение миорелаксантов в академических институтах вообще запрещено.

Слайд 22Инъекционные средства для наркоза
Эти препараты применяют и для индукционного, и для
базисного наркоза, при операциях, длящихся 30-40 минут.
У рептилий эффекты, вызванные инъекцией анестетика, часто непредсказуемы. Одна и та же доза, введенная двум различным животным, может не оказать никакого эффекта у одного и вызвать глубокий наркоз у другого.
Черепахи имеют относительно медленный обмен веществ. Обычно требуется несколько часов для достижения хирургической стадии наркоза, а полное восстановление функций наступает только через несколько (3-5) суток.
Некоторые препараты оказывают нефротоксическое действие. Поэтому при возможности лучше во всех случаях прибегать к комбинированной анестезии и поддерживать хирургический наркоз с помощью ингаляционных анестетиков.
Внутривенное введение пропофола красноухой черепахе.
Фото с сайта http://spbvet.com/lechenie-reptiliy.html
Слайд 23Кетамина гидрохлорид (Калипсол, Imalgene)
Успешно применяют при работе со всеми отрядами рептилий.
Он особенно полезен как седативное средство и как средство индукционного наркоза.
Кетамин вводят внутримышечно, в передние конечности. Для достижения поверхностного седативного эффекта рекомендуемые дозы 20-40 мг/кг. В низких дозах (5-10 мг/кг) он позволяет добиться уровня седации, достаточного для проведения интубации и перехода на эндотрахеальный наркоз. В этом случае обычно не отмечают пролонгированного апноэ.
При внутримышечном введении кетамина латентный период занимает, как правило, 5-20 мин, при внутривенном введении — около 30-60 секунд, при этом доза должна быть уменьшена на 25 - 50%. Адинамия сохраняется в течение 15-45 мин. В редких случаях у рептилий отмечают ригидность мышц и даже тоникоклонические судороги. Эти реакции снимаются низкой дозой диазепама (0,4 мг/кг), однако при этом увеличивается как продолжительность анестезии, так и восстановительный период.
Для хирургических целей дозы у черепах варьируют в среднем от 60 до 100 мг/кг. Дозы, превышающие 110 мг/кг, обычно вызывают брадикардию и остановку дыхания. Седативный эффект в среднем наступает через 10-30 минут. Для поддержания необходимого уровня анестезии можно вводить дополнительно по 10 - 15 мг/кг препарата с интервалами в 30 минут. Даже при хирургическом мононаркозе кетамином некоторые черепахи сохраняют способность к произвольным движениям. Для хирургического наркоза у ящериц требуется повышение доз до 50-80 мг/кг.
При высоких дозах кетамина восстановительный период даже у клинически здоровых рептилий может занимать до 96 часов, а у ослабленных пациентов — более 6 суток.
Наряду с недостаточной миорелаксацией, свойственной кетаминовому мононаркозу у теплокровных, у рептилий практически отсутствует анальгетический эффект этого препарата и необходима местная анестезия при всех болезненных манипуляциях. Сейчас практически везде отказались от мононаркоза кетамином и используют его в дозах до 30 мг/кг при выполнении кратковременных неболезненных вмешательств (вскрытие абсцессов, ампутация мягких тканей, биопсия, гастроскопия). Чаще кетамин в дозах 5-30 мг/кг комбинируют с буторфанолом (0,5-1,5 мг/кг), диазепамом (0,2-0,8 мг/кг), медетомидином (100-300 мкг/кг), мидазоламом (1-2 мг/кг) или ксилазином (0,1-1 мг/кг).
Предполагается, что у некоторых видов рептилий кетамин частично метаболизируется печенью, а у других удаляется преимущественно почками. Для ослабленных пациентов с нарушенной функцией любого из этих органов кетамин противопоказан.

Слайд 24Тилетамин/золазепам (Telazol, Zoletil)
Золетил (комбинация тилетамин/золазепам) действует сходным образом с кетамином, однако
в 2 - 3 раза сильнее, что снижает дозу действующего вещества. В ранних исследованиях золетил применяли в чрезвычайно высоких дозах (88 мг/кг). Черепахи при этом находились в глубоком наркозе в течение 16 часов, а восстановительный период длился более 22 часов. Для змей и ящериц токсическая доза составляет, повидимому, около 50 мг/кг. Чувствительность к этому препарату среди разных видов рептилий широко варьирует.
Доза 4-5 мг/кг обычно вызывает легкую седацию, достаточную для интубации и перехода на ингаляционный наркоз. В этом случае латентный период составляет 8-15 минут, а восстановление — порядка 0,5-12 часов, в зависимости от вида животного. Для выполнения коротких вмешательств дозу повышают в 1,5-2 раза.
Золетил является препаратом выбора при иммобилизации и кратковременной седации крупных змей (дозы 5-7 мг/кг). Латентный период при этом занимает от 20 до 40 минут, длительность анестезии около 40 минут и восстановительный период около 2 часов.
Дозы, рекомендуемые для остальных рептилий, широко варьируют. Для большинства видов змей, ящериц и черепах рекомендуют 5-10 мг/кг внутримышечно. Для водных черепах дозы обычно несколько выше, порядка 14 мг/кг (от 10 до 20 мг/кг) внутримышечно. Для крокодилов (мелкие особи) рекомендуют 5 — 10 мг/кг для достижения поверхностного седативного эффекта и 10 — 40 мг/кг для хирургического наркоза (для крупных крокодилов 2 - 5 мг/кг). Для аллигаторов рекомендуемая доза составляет 15 мг/кг.
При использовании препарата в рекомендуемых дозах наблюдался широкий спектр реакций, начиная от почти полного отсутствия эффекта (у красноухих и среднеазиатских черепах) до глубокой седации с утерей рефлекса зрачка и длительным апноэ, имелись и летальные случаи.
Поэтому активно этот препарат применяется только для змей. В рецептурном справочнике Джеймса Карпентера указано, что золетил в целом не рекомендуется для анестезии рептилий. Рекомендуется использовать золетил только для тех видов, с которыми у врача уже имелся опыт его применения, и не превышать дозу 10 мг/кг, при необходимости потенцируя наркоз буторфанолом, мидазоламом или медетомидином, а еще лучше - переходя на эндотрахеальный наркоз.

Слайд 25Альфаксалон/альфадалон ацетат (Saffan)
Этот стероидный анестетик общего назначения характеризуется непродолжительным действием. Этот
препарат достаточно популярен в Европе, но в России и США до сих пор не зарегистрирован.
Рекомендуемые дозы для большинства рептилий — 6-9 мг/кг внутривенно или 9-15 мг/кг внутримышечно. Латентный период в первом случае составляет около 5 минут, во втором — 35-40 минут. Адинамия длится 15-35 минут, восстановительный период занимает от 1,5 до 4 часов.
У красноухих черепах доза 24 мг/кг, введенная ин- трацеломически, дает хирургический наркоз с хорошей миорелаксацией на срок около часа, однако восстановление при этом может быть длительным.
Препарат наиболее безопасен из всех инъекционных анестетиков, однако при передозировке возможна остановка дыхания.
Контролируемая подача инъекционного анестетика зеленой игуане.
Фото Д.Б. Васильев, Московский зоопарк
Слайд 26Пропофол (Diprivan, Rapinovet)
Пропофол вводят несколькими медленными болюсами в хвостовую вену или
через внутрикостный катетер в течение 2 минут. Чем быстрее вводится препарат, тем быстрее и выраженнее наступает апноэ. Поэтому его предпочтительнее разводить перед инъекцией в 2 частях изотонического раствора. Восстановление после анестезии пропофолом у рептилий занимает больше времени, чем у млекопитающих, и иногда, помимо брадикардии и длительного апноэ, сопряжено со снижением сатурации артериальной крови кислородом.
Для черепах пропофол рекомендуют в дозе 2-4 мг/кг для достижения поверхностного седативного эффекта. При этом восстановительный период занимает 20-30 минут при температуре 24-30°С. Умеренные дозы пропофола (5-8 мг/кг) используют при кратковременных не болезненных вмешательствах, при этом восстановительный период занимает 30-60 минут. В более высоких дозах (9-15 мг/кг) пропофол используют для хирургического наркоза, при этом восстановительный период занимает до 3 часов.
Змеям пропофол вводят внутрисердечно или в хвостовую вену в дозе 5-7 мг/кг, мелким видам — 10 мг/кг. При фракционировании доз каждые 3-5 минут наблюдается менее выраженное действие на ССС, чем при разовой суммарной дозе.
Ящерицам пропофол вводят в разведении 1:2 в хвостовую вену в дозах 7-10 мг/кг. Для ослабленных пациентов и для хамелеонов лучше использовать более низкие дозы — 3-5 мг/кг.
Для крокодилов рекомендуют несколько повышенные дозы, порядка 10-15 мг/кг. После введения в постзатылочный венозный синус препарат дает хорошую седацию и аналгезию в течение 0,5-1,5 часов.
В большинстве случаев низкие дозы пропофола позволяют произвести интубацию и перейти на ингаляционный наркоз. При этом осложнения возникают редко.
Короткий латентный период, легкая управляемость и быстрый выход из наркоза являются привлекательными сторонами этого препарата. Пропофол — одно из немногих средств для наркоза рептилий, не требующих дополнительной местной анестезии.

Слайд 27Ингаляционный наркоз
Ингаляционный наркоз имеет явное преимущество перед инъекционным. После интубации с
использованием дозирующего испарителя, при управляемом дыхании и подаче кислорода можно полностью контролировать глубину наркоза. Восстановление сознания при этом происходит мягко и быстро, как только прекращается подача анестезирующего газа.
При открытом способе анестезии (контейнеры и капельницы) концентрацию наркотизирующего вещества нельзя точно контролировать. Для некоторых видов рептилий, вообще невозможно достичь хирургического уровня анестезии открытым способом. Для водных черепах, например, способных задерживать дыхание, этот способ неприменим.
На практике самый надежный способ анестезии — использование наркозного аппарата или искусственная вентиляция «ручным» способом с помощью мешка Амбу, с добавлением анестезирующего вещества.
В качестве масок можно использовать тубы инъекционных шприцов или горлышки пластиковых бутылок нужного диаметра, закрытые резиновой мембраной со сделанным в ней Т-образным разрезом. Интубационная трубка должна иметь максимально возможный внутренний диаметр, особенно у мелких пациентов, у которых в дыхательных путях и так возникает слишком сильное сопротивление дыханию. Длина трубки должна позволять при необходимости провести ее до бифуркации трахеи (у черепах трахея в норме является очень короткой, а у змей — длинной), и при этом трубка должна как можно меньше выступать из пасти животного, поскольку в противном случае увеличивается естественное мертвое пространство дыхательной системы и возникает опасность повторного вдыхания углекислого газа.
Ингаляционная смесь для искусственной вентиляции должна подаваться под давлением 8-12 см водного столба, а частота дыхательных движений поддерживаться на уровне 2 - 4 вдохов в минуту.
Рептилии способны выдерживать длительное (до 4 и более часов) апноэ за счет механизмов анаэробного окисления и спонтанного сокращения гладкой мускулатуры легких, изменяющего их объем без активного внешнего дыхания.
Метод ручной подачи ингаляционной смеси очень удобен, так как не требует использования дорогостоящего оборудования. Для рептилий, в отличие от теплокровных животных, он относительно безопасен.
Ручная техника может давать значительные вариации в ЧДД, дыхательном объеме, газообмене и, в конечном счете, нарушать глубину анестезии. Применение механической вентиляции (аппаратного дыхания) устраняет эти недостатки и улучшает стабильность, безопасность и контроль анестезии. Для работы с ящерицами подходит большинство моделей анестезионных машин и испарителей.
Интубация зеленой игуаны.
Фото с сайта https://www.researchgate.net

Слайд 28Восстановление после ингаляционного наркоза
Восстановление рептилий после ингаляционного наркоза обычно занимает значительно
больше времени, чем у млекопитающих. Помимо медленного метаболизма, здесь играют роль и особенности физиологии их дыхания. У рептилий стимуляция внешнего дыхания, в отличие от млекопитающих, происходит в основном не с возрастанием парциального давления углекислоты (к чему рептилии, особенно ныряющие виды, значительно более толерантны), а с уменьшением парциального давления кислорода в артериальной крови. В связи с этим, дыхание чистым кислородом в восстановительный период, способствующее повышению Р 02, должно замедлять стадию пробуждения.
Таким образом, в нормальной ситуации в восстановительный период показано дыхание комнатным воздухом. Дыхание чистым кислородом показано в случае угрожающей жизни гипоксии (падение сатурации артериальной крови кислородом ниже 60%), то есть при пролонгированном апноэ или возникновении дыхательной или сердечно-сосудистой недостаточности.
При анестезии ручным методом вначале подается смесь со скоростью 8-10 вдохов в минуту. Во время наркоза подачу смеси или полностью прекращают (при исчезновении корнеального рефлекса) или продолжают со скоростью 2 вдоха в минуту. В восстановительный период ИВЛ комнатным воздухом проводят со скоростью 2-4 вдоха в минуту. Экстубировать рептилию можно при возвращении спонтанного дыхания (не менее 2 вдохов в минуту) и рефлекса репозиции. Змей можно экстубировать после возвращения лингвального рефлекса.
Среднеазиатская черепаха восстанавливается после пропофол-индуцированной анестезии для ампутации полового члена. Пока животное возобновляет спонтанное дыхание выполняется перемежающаяся вентиляция с положительным давлением каждые 5 минут с помощью мешка Амбу. Плоский ультразвуковой Допплеровский зонд помещается у левой апертуры грудной клетки, чтобы контролировать частоту пульса. Фото с сайта https://www.researchgate.net

Слайд 29Метоксифлюран
Вызывает наиболее быстрое наступление наркоза и быстрое пробуждение по сравнению с
другими фторсодержащими анестетиками. Однако обладает высокой растворимостью в крови, поэтому характеризуется более длительной индукцией и восстановлением. Такой наркоз менее управляем.
Метоксифлюран обладает потенциальной нефро- и гепатотоксичностью, как для пациента, так и для персонала.
Однако у этого препарата есть и некоторые привлекательные стороны. У ящериц он вызывает неплохую аналгезию, сохраняющуюся и в постоперационный период.
Кроме того, он имеет низкую точку кипения, и при 20°С достигает в замкнутом объеме концентрации 3%. Это позволяет использовать его в закрытом контейнере или применять метод капельницы.
Препарат, таким образом, оказывается незаменимым в полевых условиях, причем не только для рептилий, но и для грызунов.
Наркоз в контейнере (около 1 мл метоксифлурана на контейнер объемом 4 л) обеспечивает от 10 до 30 минут хорошего хирургического наркоза.
Механизм выведения метоксифлюрана у рептилий не изучен, однако у млекопитающих около 50% препарата метаболизируется печенью. Поэтому не применяют этот препарат для рептилий с подозрением на патологию печени.

Слайд 30Галотан (Фторотан)
Обладает хорошими гипнотическими качествами, но не дает достаточной аналгезии
и хуже расслабляет мышцы, чем другие ингаляционные анестетики.
Недостатком этого препарата является его явно выраженное угнетающее действие на систему кровообращения, вызывающее падение артериального давления, уменьшение минутного объема сердца и сердечного выброса, расстройства ритма, нарушение кровоснабжения внутренних органов и снижение СКФ. Имеется также выраженное дозазависимое угнетение дыхания.
Помимо этого, галотан имеет относительно высокий показатель метаболизации (около 20% для млекопитающих). Поэтому у рептилий с нарушенной функцией печени может наблюдаться значительное удлинение восстановительного периода.
Галотан плохо сочетается с инъекционными анестетиками. После применения низких доз кетамина (20 — 30 мг/кг) или мидазолама (1 — 2 мг/кг) некоторые пациенты находились на аппаратном дыхании более 5 часов.
При использовании прецизионного испарителя (дозирующего парообразный анестетик вне зависимости от температуры воздуха, потока газа и состава смеси) галотан во вводной фазе наркоза подают в концентрации 3-5% в кислороде, а для поддержания наркоза — 1,5-2,5%. Концентрацию увеличивают постепенно, поскольку возможна внезапная остановка дыхания. Во время индукции галотаном часто наблюдается фаза возбуждения, обычно как раз перед полной релаксацией. В норме индукция составляет 20-30 минут, а восстановление происходит в течение 10-30 минут после прекращения подачи анестетика.
При открытом способе анестезии 5 мл галотана помещают в 3-литровый контейнер. Такая концентрация вызывает наркоз в течение 5 - 30 минут, который длится 5 - 20 минут после однократного введения.
Ящерицы более чувствительны к этому препарату по сравнению с другими рептилиями.

Слайд 31Энфлуран
Показатель метаболизации энфлурана значительно ниже, чем у галотана, порядка 2 —
5% у млекопитающих. В остальном его действие и вызываемые им побочные эффекты близки к галотану. Однако давление пара энфлурана отличается от давления пара галотана и изофлурана, поэтому его можно использовать только в специальном испарителе. Для индукции рекомендуют 3-5% смесь этого препарата с кислородом, а для поддержания наркоза — 1,5-2%.
Не имеет особенных преимуществ по сравнению с галотаном.
Эндотрахеальное введение изофлюрана красноухой черепахе.
Фото с сайта http://spbvet.com/lechenie-reptiliy.html
Слайд 32Изофлюран
Является основным препаратом выбора в анестезиологии рептилий.
Характеризуется низкой растворимостью в
крови и имеет самый низкий показатель метаболизации, что делает наркоз изофлураном наиболее управляемым и безопасным даже для пациентов с нарушенной функцией печени. У рептилий он вызывает хорошую миорелаксацию и аналгезию. В зависимости от дозы, изофлуран оказывает угнетающее действие на дыхание и ССС, хотя и менее выраженное, чем при наркозе галотаном или энфлураном.
Его отрицательное миотропное действие у млекопитающих также менее выражено, но у рептилий достаточно часто проявляется в индукционный период, особенно при мононаркозе у змей. Изофлюран является также сильным сосудорасширяющим средством и приводит к снижению периферического сопротивления сосудов и падению артериального давления. Для пациентов с гиповолемией это может представлять опасность.
В общем случае, для вводного наркоза изофлуран подают в концентрации 4-5%, снижая ее при поддержании наркоза до 1-3%. Индукция при этом занимает 6-15 минут и характеризуется короткой (1-2 минуты) фазой возбуждения. Восстановление занимает от 30 до 60 минут.
Для ослабленных пациентов предпочтительнее проводить мононаркоз изофлюраном, без применения дополнительных седативных средств. В этом случае вводный наркоз осуществляют с помощью маски или помещают животное в контейнер, куда подают ингаляционную смесь.
Учитывая, что раздражающее действие изофлюрана вызывает у рептилий произвольное апноэ, особенно длительное у ныряющих видов, для индукции используют более низкую концентрацию анестетика, порядка 3-4%. В этом случае седативный эффект, достаточный для введения интубационной трубки, наступает через 5-20 мин. У змей, которых интубировать легче, чем других рептилий, вводный эндотрахеальный наркоз изофлюраном характеризуется более длительным латентным периодом (иногда до 40 минут) и более выраженной фазой возбуждения. Для премедикации перед эндотрахеальной подачей газа обычно используется буторфанол или пропофол. Индукция кетамином, золетилом или мидазоламом оказывает более выраженное действие на дыхание и ССС.

Слайд 33Севофлюран
Севофлюран, так же как и другой относительно новый ингаляционный анестетик, —
десфлюран, имеет самый низкий коэффициент растворимости в крови. Это делает наркоз севофлюраном еше более быстрым и управляемым, даже по сравнению с изофлюраном. Однако этот препарат имеет более высокий коэффициент метаболизации (3-5%), чем изофлюран, хотя его метаболиты не оказывают, по-видимому, на рептилий токсического воздействия.
Для индукции концентрация севофлюрана должна быть несколько более высокой — 4-8% и поддерживающая концентрация порядка 3-4%.
Несмотря на некоторые привлекательные стороны севофлюрана, он, тем не менее, все равно не является абсолютно «идеальным» анестетиком. Его преимущество перед изофлюраном имеет не качественное, а количественное значение, при этом разница в цене между этими препаратами отличается почти в 4 раза.
Анестезия изофлюраном открытым способом маисового полоза.
Фото с сайта https://www.researchgate.net
Слайд 34Мониторинг анестезии
Активность рефлексов. Во время наркоза релаксация у рептилий, как и
у других животных, развивается от головы в каудальном направлении. В восстановительный период возвращение двигательных функций происходит в обратном порядке. Рефлекс репозиции (переворачивания из спинного положения) теряется на самых ранних стадиях и характеризует поверхностный седативный эффект. При восстановлении это рефлекс указывает, что пациента можно экстубировать. Потеря рефлекса подъема ребер (если надавить пальцем на позвоночник), реакции брюшной стенки (при проведении кончиком пальца по брюшным щиткам), движения хвостом при сжатии ануса (у змей) свидетельствуют об утрате спинальных рефлексов и переходе к хирургическому уровню анестезии. У черепах достаточная степень седации связана с потерей рефлекса втягивания головы. При хирургическом наркозе у рептилий (кроме змей) должен сохраняться роговичный и пупиллярный рефлексы, а у змей - пассивное втягивание языка при его тракции из влагалища и слабый рефлекс венчика хвоста. Утеря этих рефлексов свидетельствует о слишком глубоком наркозе и требует временного отключения подачи анестетика и переходу к ИВЛ, вначале комнатным воздухом, а затем и кислородом, если это необходимо.
Термометрия. В процессе анестезии опасна как гипо- так и гипертермия, способствующая гипоксии тканей. Для большинства рептилий температура в процессе операции должна поддерживаться над нижней границей диапазона оптимальных температур (не ниже 24°С). Температуру измеряют в клоаке животных с помощью цифровых термометров с выносным зондом.
Мониторинг сердечной деятельности. У ящериц с каудальным положением сердца и у змей сердечный толчок легко пальпируется. У остальных ящериц пульс можно наблюдать на каротидном сплетении (в основании шеи) или в аксиальной (подмышечной) ямке, для чего переднюю конечность необходимо отогнуть краниальнее. Для аускультации сердца применим эзофагальный стетоскоп. Аппаратный контроль сердечной деятельности проводят с помощью кардиомониторов, УЗИ, ЭКГ, с помощью доплерографии и пульсоплетизмографии. В большинстве случаев при анестезии отмечается умеренное снижение ЧСС (на 10 — 15 пунктов) с сатурации кислородом (не ниже 60%) и незначительные отклонения на ЭКГ, которые обычно нормализуются в течение первых 5 — 30 минут наркоза.
Мониторинг дыхания. Наблюдение за частотой, глубиной и ритмом дыхания возможно только у спонтанно дышащей рептилии, отключенной от аппарата ИВЛ. В этом случае легко определяется низкая глубина анестезии, однако у рептилий в состоянии длительного апноэ требуется дополнительно оценить степень гипоксии или гиперкапнии.

Слайд 35Возможные осложнения и реанимация
Реанимационные мероприятия у всех животных с медленным метаболизмом
значительно менее эффективны, чем у теплокровных. Однако в практике с рептилиями иногда удается провести успешную реанимацию животным с пролонгированным апноэ и явной остановкой сердца. При этом эффект от экстренных мер у рептилий наступает ощутимо позже, чем у млекопитающих, зато и так называемое «время оживления организма», занимающее у млекопитающих всего 4-6 минут после остановки сердца и дыхания, у рептилий, по-видимому, имеет значительно больший интервал. Иногда черепаху удается реанимировать даже через несколько часов после прекращения самостоятельного дыхания и с явной остановкой сердца.
Миссисипская черепаха на овариэктомии. Обратите внимание на ультразвуковой допплеровский карандашный зонд, размещенный в верхней чести грудной клетки над правой сонной артерией для мониторинга пульса во время анестезии.
Фото с сайта https://www.researchgate.net
Слайд 36Дыхательная недостаточность
Может возникать при передозировке наркотических средств, обструкции трахеи, пролонгированном
апноэ, отеке гортани и легких, бронхоспазме, пневмотораксе, тракции брыжеек, торпидити и шоке. Действия в этом случае сводятся к следующему:
необходимо переинтубировать трахею, остановить подачу анестетика и перейти на дыхание чистым кислородом: вначале 3-4 вдоха подряд, затем 4 вдоха в минуту;
в случае отека легких или гортани ввести 4 мг/кг дексаметазона или 10 мг/кг преднизолона внутривенно;
при бронхоспазме ввести в трахею несколько капель 24% раствора эуфиллина или 2-4 мг/кг 2,4% раствора эуфиллина внутримышечно;
при передозировке инъекционного анестетика провести реверсию с помощью налоксона, йохимбина, атипамезола или флумазенила, в зависимости от класса анестетика;
ввести дыхательный аналептик (доксапрам, 5 мг/кг внутривенно) и повторять введение каждые 10 минут до достижения необходимого эффекта.
Слайд 37Сердечно-сосудистая недостаточность
Возникает при гиповолемии (геморрагия или предоперационная дегидратация), периферической вазодилатации (вследствие
анестезии, анафилаксии или эндотоксемии), депрессии миокарда (общее действие анестетика, электролитный дисбаланс, гипоксия и ишемия, скрытая первичная патология), нарушениях ЧСС и ритма (синусовая брадикардия, атрио-вентрикулярная блокада, преждевременные желудочковые комплексы, желудочковая тахикардия), нарушении венозного возврата (портальная гипертензия при патологии печени, обструкция сосудов вследствие перикардиального выпота, обструкция опухолью крупных вен и т.п,), рефлекторной гипотензии (при манипуляциях на брыжейках). Действия:
остановить хирургические манипуляции, уменьшить подачу анестетика и перейти на дыхание чистым кислородом;
при возникновении брадикардии или атриовентрикулярной блокады ввести 0,1-0,4 мг/кг атропина внутримышечно;
начать введение кристаллоидов (Рингер лактат/5% глюкоза) со скоростью 10-20 мл/кг/час внутривенно, капельно;
при возникновении ранних желудочковых комплексов и желудочковой тахикардии у млекопитающих назначают лидокаин и пропанолол внутривенно, однако сведения по использованию этих препаратов для рептилий в литературе отсутствуют. Это же касается применения препаратов группы камфары, инотропных препаратов и вазопрессоров.

Слайд 38Остановка сердиа
Может возникать у рептилий при острой гипотензии, передозировке анестетика, гипотермии,
гипоксии, гиперкапнии, гиперкалиемии, респираторном и метаболическом ацидозе. Действия:
вентиляция чистым кислородом, быстрое внутривенное введение кристаллоидов (до 60 мл/кг/час);
включить нагревательный прибор (температура поверхности не более 42°С), поместить на него животное, подложив хирургическую простынь, и согреть пациента, используя только подогретые растворы и прикрыв операционную рану;
ввести адреналин внутрисердечно (1 мл 0,1 % раствора развести в 10 мл воды), вводить из расчета 0,2 мл/кг каждые 30 минут (манипуляция легче осуществляется у змей и варанов);
бикарбонат натрия вводить по 0,5 - 1 мг/кг внутривенно каждые 30 минут;
ввести внутривенно атропин в дозе 0,4 мг/кг.
при электромеханической диссоциации (ЭКГ почти нормальна, но нет механической активности миокарда) ввести глюконат кальция в дозе 100 мг/кг внутривенно;
сведений о применении дефибрилляторов для рептилий нет.
Слайд 39Выводы
Говоря о препаратах, применимых для премедикации рептилий следует отметить фенотиазины, в
особенности хлорпромазин (аминазин) и ацепромазин (ветранквил), которые позволяют в 2-3 раза снизить дозы барбитуратов или кетамина. Премедикация фенотиазинами достоверно облегчает и ускоряет восстановительный период.
Из антихолинэргических препаратов исключительно эффективен гликопирролат, который хорошо тормозит вагосимпатические реакции, в том числе саливацию. С этой же целью применяют атропина сульфат. Бензодиазепины используются преимущественно для подготовки к иммобилизации миорелаксантами. Барбитураты в настоящее время редко используются в анестезиологии рептилий.
Из диссоциативных препаратов наиболее популярен кетамин, применяемый для вводного и базисного мононаркоза или в комбинации с ксилазином и медетомидином. Широко используется кетамин для вводного наркоза, с переходом в дальнейшем на ингаляционную анестезию изофлюраном или этравом. Перспективной комбинацией является смесь кетамина с медетомидином, позволяющая снизить дозу кетамина до 5-8 мг/кг. Отмечается глубокая седация с достаточной миорелаксацией. Преимуществом такой комбинации является возможность быстрой реверсии наркоза прямым антидотом - атипамезолом (антиседан).
Патентованая смесь другого производного фенциклодина - тилетамина с бензодиазепином, золазепамом Zoletil - Telazol нашла ограниченное применение в анестезиологии рептилий вследсвие слабой миорелаксации и недостаточно глубокой седации. Zoletil с успехом применяется для вводного наркоза крупным питонам с дальнейшей интубацией и переходом на ингаляционный наркоз.
В последнее время для наркоза рептилий также используется пропофол. Короткий латентный период, легкая управляемость и быстрый выход из наркоза являются привлекательными сторонами этого препарата.
Классическая комбинация фентанил-дроперидол для нейролептанальгезии теплокровных не оказывает на рептилий никакого действия.
Говоря о местной анестезии рептилий, стоит отметить крайне высокую токсичность и низкую эффективность анестетиков эфирного ряда. Большинство ветеринаров-герпетологов отказались от применения новокаина и используют лидокаин и тримекаин, а также ультракаин в низких концентрациях (0,25-1% р-р ) без добавления адреналина.
Отсутствие диафрагмы и преимущественное участие в акте дыхания двигательной мускулатуры приводят к выключению спонтанного дыхания уже на ранних стадиях наркоза. Гортанная щель у рептилий в состоянии наркоза закрыта, в отличие от млекопитающих и птиц, и открывается в момент самостоятельного вдоха. Хотя рептилии очень устойчивы к гипоксии, а у водных форм существуют механизмы анаэробного дыхания, при длительных вмешательствах рекомендуется интубация трахеи.
Мониторинг состояния рептилий в наркозе обычно осуществляют пульсоксиметрией, желательно с использованием ректального зонда вводимого в клоаку. Попытки применить ЭКГ с отведениями от подкожных игл и пищеводного стетоскопа дают трудно интерпретируемые результаты.
Контроль глубины наркоза в основном ориентирован на глубину миоредаксации. Известно, что у змей характерным признаком недостаточной седации являются движения кончика хвоста. У черепах и ящериц исследуют роговидный рефлекс.

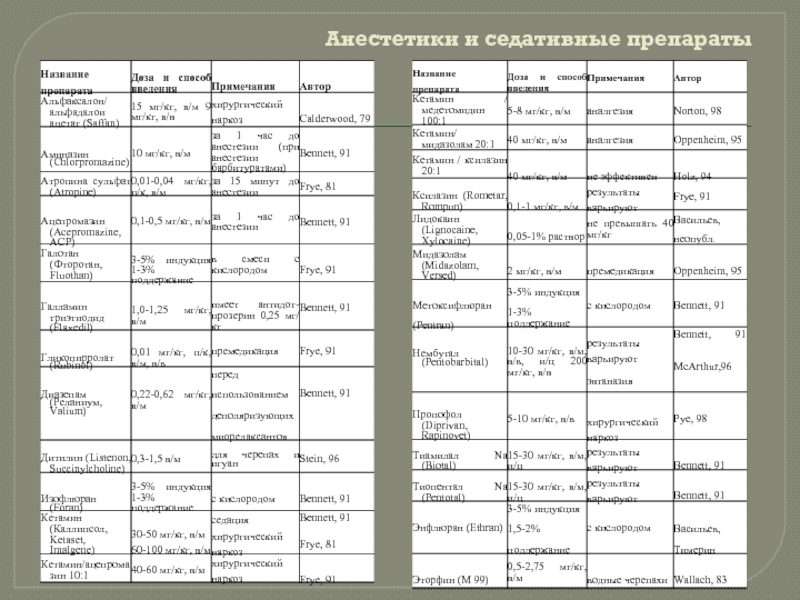
Слайд 40
Анестетики и седативные препараты
Слайд 41Заключение
На анестезиологический протокол влияют такие анатомо-физиологические особенности рептилий, как гетеротермность, низкий
уровень метаболизма, способность к анаэробному дыханию и пролонгированному апноэ, торпидному состоянию, особое строение чешуйчатой кожи и генерализованный механизм линьки, мелкий размер большинства видов и др.
Т.о. потенцированный комбинированный наркоз может дать больше негативных эффектов чем мононаркоз (в отличие от теплокровных).
Его использование обусловлено у рептилий из-за следующих оснований:
прединтубационная седация опасных животных,
снижение доз токсичных препаратов,
возможность реверсии,
невозможность проведения ингаляционного наркоза.
Слайд 42Библиографический список
Васильев Д.Б. «Черепахи болезни и лечение» 1999г.
Васильев Д.Б. «Ветеринарная герпетология:
ящерицы» 2005г.
Васильев Д.Б., Тимерин И.В. «Особенности иммобилизации и анестезии рептилий», Научные исследования в зоологических парках №12, 2000г.
Douglas R. Mader «Reptile medicine and surgery» 2006г.
Elliott R. Jacobson « Infectious diseases and pathology of reptile» Color atlas and text 2007г.
Stuart McArthur «Medicine and Surgery of Tortoises and Turtles» 2004г.
Интернет-ресурсы:
http://vetreptile.ru/
http://vitawater.ru
http://russiantortoise.ru
http://myreptile.ru