- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Железо. Строение атома, физические и химические свойства простого вещества презентация
Содержание
- 1. Железо. Строение атома, физические и химические свойства простого вещества
- 2. О железе Железо – не только
- 3. Немного истории В середине II тысячелетия до
- 4. Железо в природе
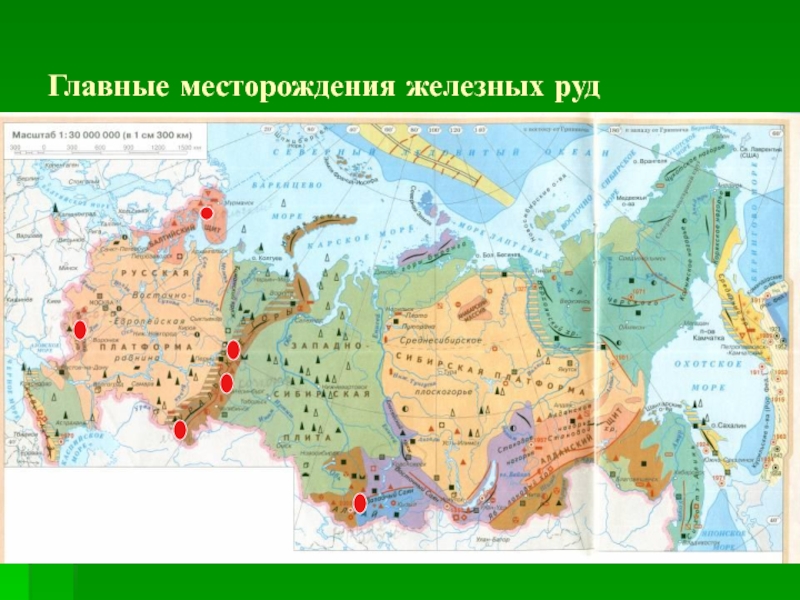
- 5. Главные месторождения железных руд
- 6. Живое железо
- 7. Железо – d-элемент. Порядковый номер
- 8. Физические свойства железа Плотность=7,87 г/см3 Тпл =
- 9. Химические свойства железа Металл средней активности в концентрированных серной и азотной кислотах пассивируется
- 10. Железо реагирует : С простыми веществами: Fe
- 11. Коррозия металла Железо разрушается под действием окружающей
- 12. Защита железа от коррозии Лако-красочные покрытия Эмаль
- 13. Соединения железа FeO →Fe(OH)2 – основные соединения
- 14. Качественные реакции На ион Fe2+ -
- 15. Домашнее задание
Слайд 2О железе
Железо – не только основа всего мира, самый главный
элемент
окружающей нас природы. Оно основа культуры и промышленности.
Оно орудие войны и мирного труда, и во всей таблице Менделеева
невозможно найти другой такой элемент , который был бы так связан с
прошлыми, настоящими и будущими судьбами человечества.
академик Ферсман А.Е.
окружающей нас природы. Оно основа культуры и промышленности.
Оно орудие войны и мирного труда, и во всей таблице Менделеева
невозможно найти другой такой элемент , который был бы так связан с
прошлыми, настоящими и будущими судьбами человечества.
академик Ферсман А.Е.
Слайд 3Немного истории
В середине II тысячелетия до н.э. в Египте была основана
металлургия железа – получение его из железных руд. Это положило начало железному веку в истории человечества.
Слайд 7Железо – d-элемент.
Порядковый номер
26
Относительная атомная масса
55,847
Валентность переменная
II-III
Относительная атомная масса
55,847
Валентность переменная
II-III
Слайд 8Физические свойства железа
Плотность=7,87 г/см3
Тпл = 1539ْ С
Ткип = 3200ْ С
Намагничивается
Легко обрабатывается: режется, прокатывается,
куётся
Слайд 9Химические свойства железа
Металл средней активности
в концентрированных серной и азотной кислотах
пассивируется
Слайд 10Железо реагирует :
С простыми веществами:
Fe + S = FeS
2Fe + 3Cl2
= 2FeCl3
3Fe + 2O2 = Fe3O4 (FeO*Fe2O3)
Со сложными веществами:
3Fe + 4H2O = Fe3O4 +4H2
Fe + 2HCl = FeCl2 + H2
Fe + CuSO4 = FeSO4 + Cu
3Fe + 2O2 = Fe3O4 (FeO*Fe2O3)
Со сложными веществами:
3Fe + 4H2O = Fe3O4 +4H2
Fe + 2HCl = FeCl2 + H2
Fe + CuSO4 = FeSO4 + Cu
Слайд 11Коррозия металла
Железо разрушается под действием окружающей среды – оно ржавеет
4Fe +
3O2 + 2n·H2O = 2Fe2O3·nH2 O
Состав ржавчины очень сложный
Состав ржавчины очень сложный
Слайд 12Защита железа от коррозии
Лако-красочные покрытия
Эмаль – силикатное стекло с добавлением оксидов
металлов
Металлические покрытия: лужение, оцинковывание, хромирование и т.д.
Выплавление нержавеющих сталей
Ингибирование
Металлические покрытия: лужение, оцинковывание, хромирование и т.д.
Выплавление нержавеющих сталей
Ингибирование
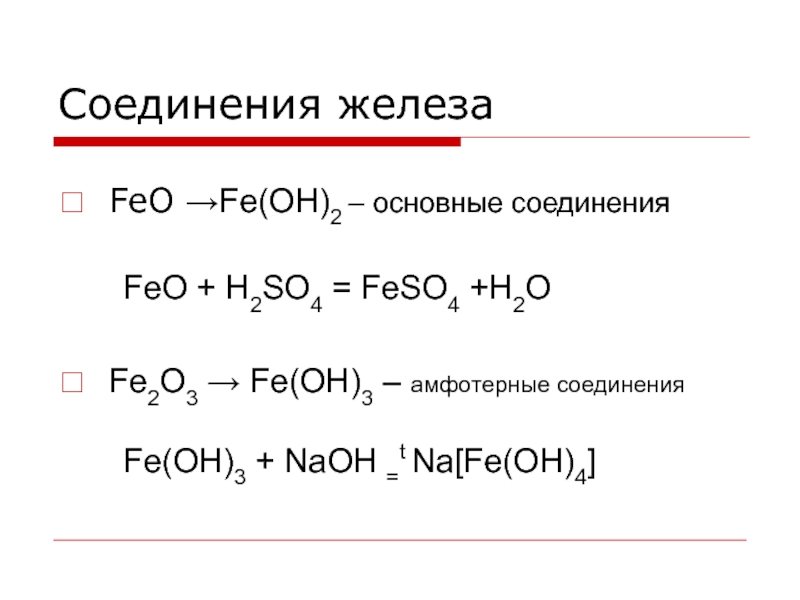
Слайд 13Соединения железа
FeO →Fe(OH)2 – основные соединения
FeO + H2SO4
= FeSO4 +H2O
Fe2O3 → Fe(OH)3 – амфотерные соединения
Fe(OH)3 + NaOH =t Na[Fe(OH)4]
Fe2O3 → Fe(OH)3 – амфотерные соединения
Fe(OH)3 + NaOH =t Na[Fe(OH)4]
Слайд 14Качественные реакции
На ион Fe2+ - взаимодействие с красной кровяной солью гексацианоферратом
(III)калия
Fe+2SO4+K3[Fe(CN)6]=KFe+3[Fe+2(CN)6]↓+K2SO4
синего цвета
На ион Fe3+–взаимодействие с роданидом аммония
Fe+3CI3+3NH4SCN↔Fe(SCN)3↓+3NH4CI
кроваво-красного
цвета
Fe+2SO4+K3[Fe(CN)6]=KFe+3[Fe+2(CN)6]↓+K2SO4
синего цвета
На ион Fe3+–взаимодействие с роданидом аммония
Fe+3CI3+3NH4SCN↔Fe(SCN)3↓+3NH4CI
кроваво-красного
цвета
Слайд 15Домашнее задание
Составьте уравнения
химических реакций, следуя цепочке превращений
1) Fe →FeCI2→Fe(OH)2→FeO→Fe
2) Fe→FeCI3→Fe(OH)3→Fe2O3→Fe
3)↑X1 →Fe(OH)2→FeSO4
Fe3O4→Fe ↓ ↓
↓X2→Fe(OH)3→Fe2(SO4)3
1) Fe →FeCI2→Fe(OH)2→FeO→Fe
2) Fe→FeCI3→Fe(OH)3→Fe2O3→Fe
3)↑X1 →Fe(OH)2→FeSO4
Fe3O4→Fe ↓ ↓
↓X2→Fe(OH)3→Fe2(SO4)3











![Качественные реакции На ион Fe2+ - взаимодействие с красной кровяной солью гексацианоферратом (III)калия Fe+2SO4+K3[Fe(CN)6]=KFe+3[Fe+2(CN)6]↓+K2SO4](/img/tmb/5/494598/1e00058b539b8f1aad7fe2acdc88801f-800x.jpg)






