- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Йодиметрия и йодометрия. (Лекция 9) презентация
Содержание
- 1. Йодиметрия и йодометрия. (Лекция 9)
- 2. План 1. Сущность йодиметрии и йодометрии.
- 3. В основе методов йодиметрии и йодометрии лежат
- 4. Возможности метода: восстановители,
- 5. Условия проведения йодиметрических и йодометрических определений
- 6. Тиосульфат-ионы реагируют с оксидом углерода(IV):
- 7. Стандартизация раствора натрия тиосульфата по калия дихромату
- 8. Определение оксида мышьяка(III) As2O3 +
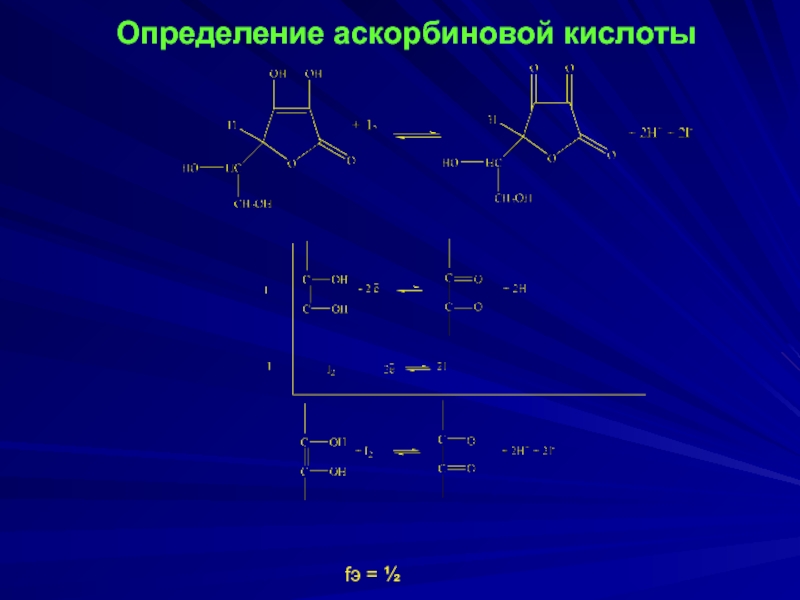
- 9. Определение аскорбиновой кислоты fэ = ½
- 10. Определение пероксида водорода 1 H2O2 +
- 11. Определение кислот IO3- +
Слайд 2План
1. Сущность йодиметрии и йодометрии.
2. Возможности метода.
3. Условия проведения йодиметрических и
йодометрических определений.
4. Титранты.
5. Применение йодиметрии в анализе.
6. Применение метода йодометрии для определения окислителей.
4. Титранты.
5. Применение йодиметрии в анализе.
6. Применение метода йодометрии для определения окислителей.
Слайд 3В основе методов йодиметрии и йодометрии лежат полуреакции:
I3- + 2ē ⇆
3 I-
3 I- - 2ē ⇆ I3-
или:
I2 + 2ē ⇆ 2 I-
2 I- - 2ē ⇆ I2
3 I- - 2ē ⇆ I3-
или:
I2 + 2ē ⇆ 2 I-
2 I- - 2ē ⇆ I2
Слайд 4Возможности метода:
восстановители, стандартный потенциал которых меньше 0,54 В (оксид
мышьяка(III), натрия тиосульфат, гидразина сульфат и т.д.) прямым титрованием. Такие восстановители, как формальдегид, натрия сульфит, натрия сульфид определяют обратным титрованием;
окислители, стандартный потенциал которых больше 0,54 В (пероксид водорода, калия дихромат, натрия арсенат и т.д.), заместительным титрованием;
ароматические и гетероциклические соединения, с которыми йод вступает в реакции замещения (антипирин), а также ненасыщенные органические соединения по реакциям присоединения.
окислители, стандартный потенциал которых больше 0,54 В (пероксид водорода, калия дихромат, натрия арсенат и т.д.), заместительным титрованием;
ароматические и гетероциклические соединения, с которыми йод вступает в реакции замещения (антипирин), а также ненасыщенные органические соединения по реакциям присоединения.
Слайд 5Условия проведения йодиметрических и йодометрических определений
Определение следует проводить на холоду, т.к.
йод и его растворы летучи. Кроме того, при повышении температуры понижается чувствительность крахмала как индикатора.
Определение нельзя проводить при рН более 9, так как при рН>9 протекает реакция диспропорционирования йода:
I2 + 2 OH- ⇆ IO- + I- + H2O
В сильнокислой среде протекает реакция окисления йодид-ионов кислородом воздуха:
4 I- + 4 H+ + O2 ⇆2 I2 + 2 H2O
Определение нельзя проводить при рН более 9, так как при рН>9 протекает реакция диспропорционирования йода:
I2 + 2 OH- ⇆ IO- + I- + H2O
В сильнокислой среде протекает реакция окисления йодид-ионов кислородом воздуха:
4 I- + 4 H+ + O2 ⇆2 I2 + 2 H2O
Слайд 6 Тиосульфат-ионы реагируют с оксидом углерода(IV):
S2O32- + CO2 + H2O
⇆ S↓ + HSO3- + HCO3-
при этом концентрация раствора увеличивается.
Тиосульфат-ионы окисляются кислородом воздуха:
2 S2O32- + O2 → 2 SO42- + 2 S↓
при этом концентрация раствора уменьшается.
при этом концентрация раствора увеличивается.
Тиосульфат-ионы окисляются кислородом воздуха:
2 S2O32- + O2 → 2 SO42- + 2 S↓
при этом концентрация раствора уменьшается.
Слайд 8 Определение оксида мышьяка(III)
As2O3 + 6 OH- ⇆ 2 AsO33- +
3 H2O
AsO33- + 2 H+⇆ AsO2- + H2O
1 AsO2- + 2 H2O – 2ē ⇆ HAsO42- + 3 H+
1 I2 + 2ē ⇆ 2 I-
AsO2- + I2 + 2 H2O ⇆ HAsO42- + 2 I- + 3 H+
fэ(As2O3 ) = ¼
AsO33- + 2 H+⇆ AsO2- + H2O
1 AsO2- + 2 H2O – 2ē ⇆ HAsO42- + 3 H+
1 I2 + 2ē ⇆ 2 I-
AsO2- + I2 + 2 H2O ⇆ HAsO42- + 2 I- + 3 H+
fэ(As2O3 ) = ¼
Слайд 10 Определение пероксида водорода
1 H2O2 + 2 H+ + 2ē ⇆ 2
H2O
1 2 I- - 2ē ⇆ I2
H2O2 + 2 I- + 2 H+ ⇆ I2 + 2 H2O
I2 + 2 S2O32- ⇆ 2 I- + S4O62-
fэ = ½
1 2 I- - 2ē ⇆ I2
H2O2 + 2 I- + 2 H+ ⇆ I2 + 2 H2O
I2 + 2 S2O32- ⇆ 2 I- + S4O62-
fэ = ½