- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водородная связь (11 класс) презентация
Содержание
- 1. Водородная связь (11 класс)
- 2. Химическую связь между атомами водорода одной молекулы
- 3. Водородная связь Межмолекулярная Возникает между молекулами
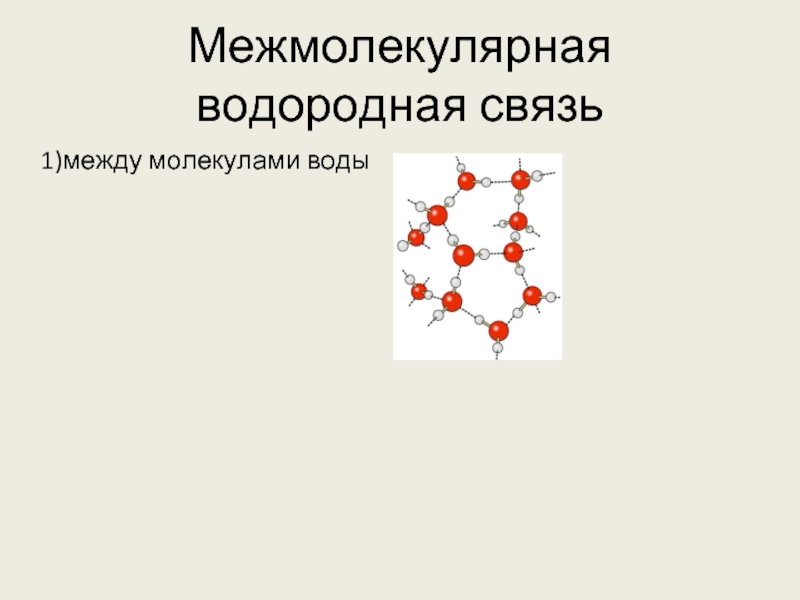
- 4. Межмолекулярная водородная связь 1)между молекулами воды
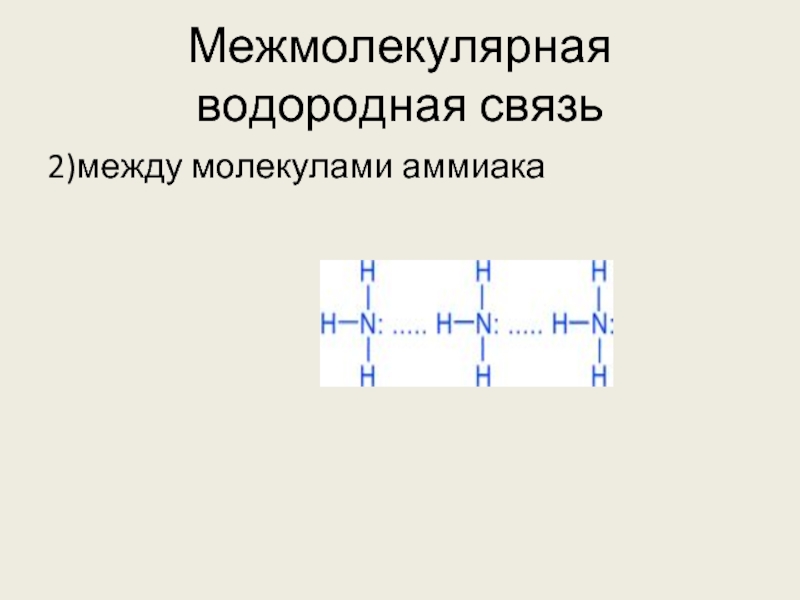
- 5. Межмолекулярная водородная связь 2)между молекулами аммиака
- 6. Межмолекулярная водородная связь 3)между молекулами спиртов (метанол, этанол, пропанол, этиленгликоль, глицерин)
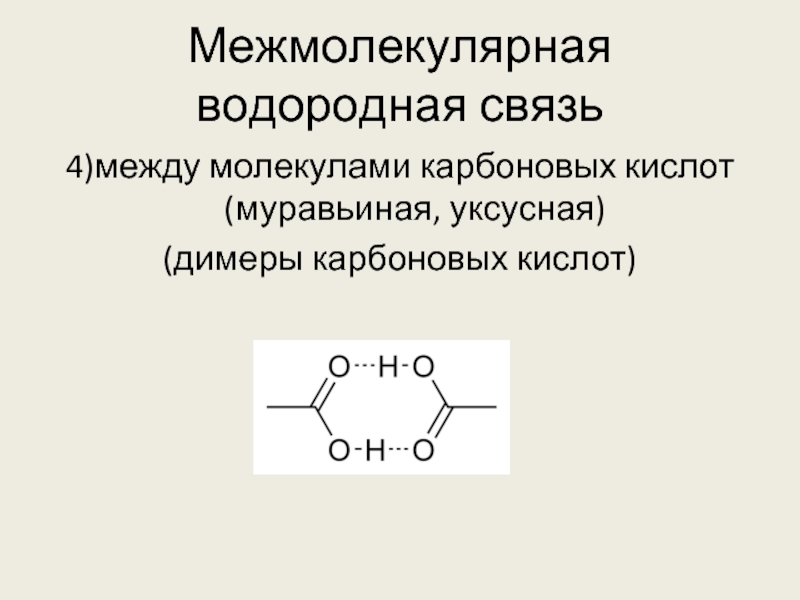
- 7. Межмолекулярная водородная связь 4)между молекулами карбоновых кислот
- 8. Межмолекулярная водородная связь 5)Между молекулами фтороводорода
- 9. Особые свойства веществ, образованных межмолекулярной водородной связью
- 10. Особые свойства веществ, образованных межмолекулярной водородной связью 2)некоторые спирты и кислоты неограниченно растворимы в воде
- 11. Особые свойства веществ, образованных межмолекулярной водородной связью
- 12. Особые свойства веществ, образованных межмолекулярной водородной связью
- 13. Внутримолекулярная водородная связь возникает 1)внутри молекул
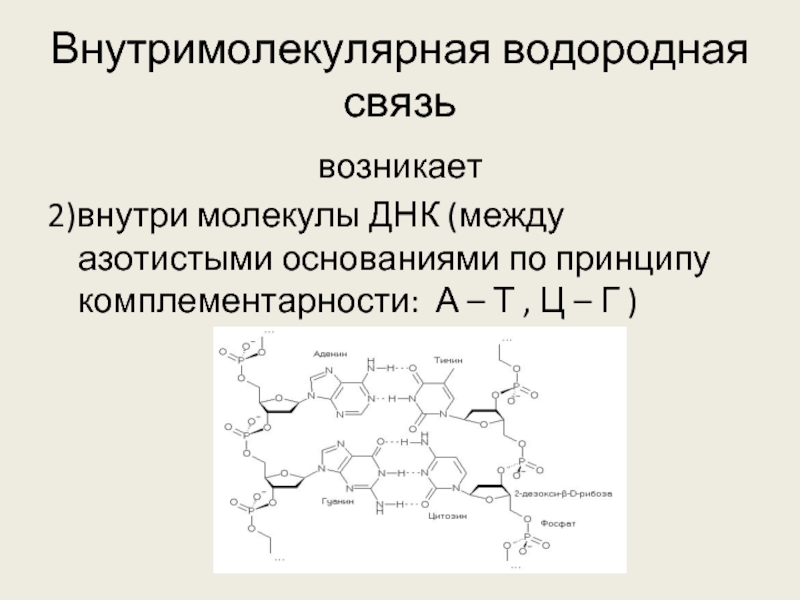
- 14. Внутримолекулярная водородная связь возникает 2)внутри молекулы ДНК
- 15. Значение внутримолекулярной связи Способствует образованию молекул белков
- 16. Механизм образования водородной связи Электростатическое притяжение атома
- 17. Факторы, разрушающие водородную связь в белковой молекуле
Слайд 2Химическую связь между атомами водорода одной молекулы (или её части) и
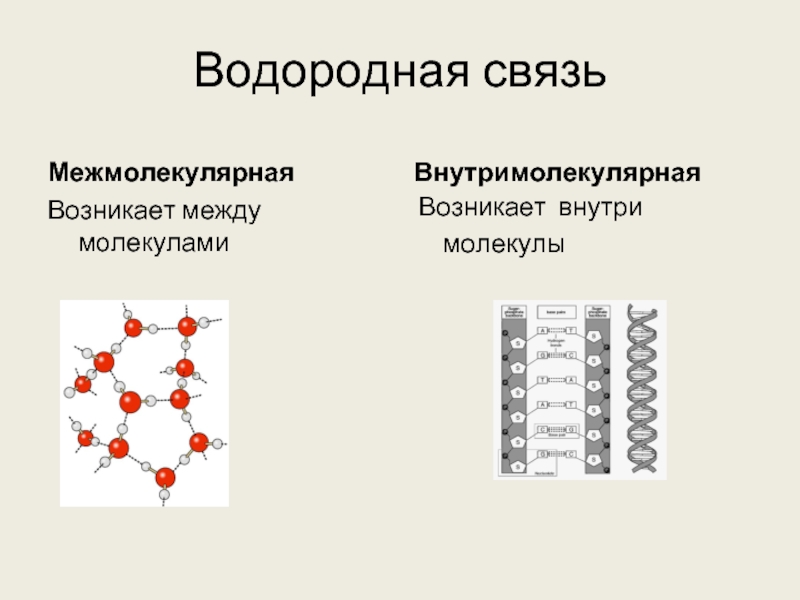
Слайд 3Водородная связь
Межмолекулярная
Возникает между молекулами
Внутримолекулярная
Возникает внутри
молекулы
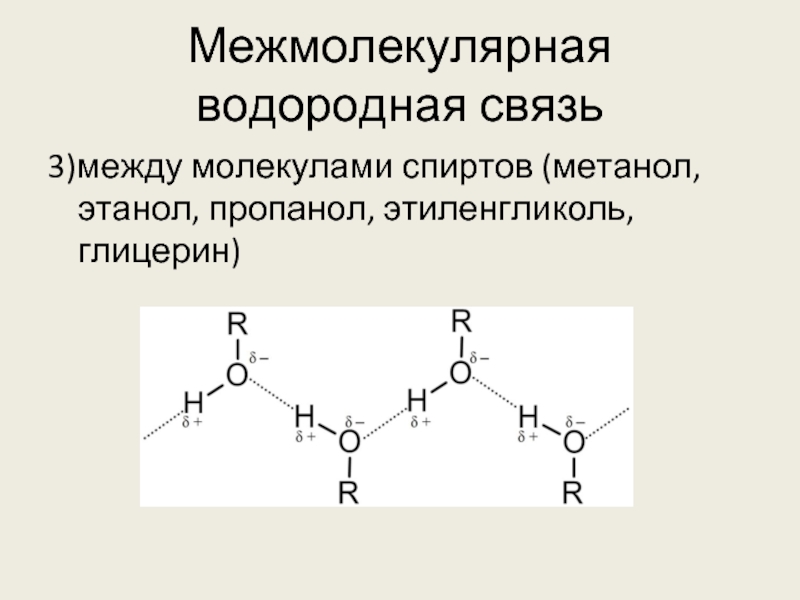
Слайд 6Межмолекулярная водородная связь
3)между молекулами спиртов (метанол, этанол, пропанол, этиленгликоль, глицерин)
Слайд 7Межмолекулярная водородная связь
4)между молекулами карбоновых кислот
(димеры карбоновых кислот)
Слайд 8Межмолекулярная водородная связь
5)Между молекулами фтороводорода
Н – Fδ- … δ+ H – F δ- … δ+Н – F δ- …
Слайд 9Особые свойства веществ, образованных межмолекулярной водородной связью
1)вещества с низкой молекулярной массой
(вода, метанол, этанол, муравьиная кислота, уксусная кислота, фтороводород, аммиак)
Слайд 10Особые свойства веществ, образованных межмолекулярной водородной связью
2)некоторые спирты и кислоты неограниченно
Слайд 11Особые свойства веществ, образованных межмолекулярной водородной связью
3)аномально высокие температуры кипения и
Мr (H2O) = 18 Mr (С2Н5ОН) = 42
t кип. (H2O) = 1000 С t кип. (С2Н5ОН) = 780С
t пл. (H2O) = 00 С
Слайд 12Особые свойства веществ, образованных межмолекулярной водородной связью
5)водородные связи способствуют образованию кристаллов
Слайд 13Внутримолекулярная водородная связь
возникает
1)внутри молекул белков (водородная связь удерживает витки спирали
Слайд 14Внутримолекулярная водородная связь
возникает
2)внутри молекулы ДНК (между азотистыми основаниями по принципу комплементарности:
Слайд 15Значение внутримолекулярной связи
Способствует образованию молекул белков и ДНК
Определяет функционирование ДНК и
Слайд 16Механизм образования водородной связи
Электростатическое притяжение атома водорода, имеющего частично положительный заряд,
Н δ+ – Fδ⁻ . . . Hδ+ – F δ-
Донорно-акцепторное взаимодействие между почти свободной орбиталью атома водорода и неподеленной электронной парой атома кислорода (фтора или азота)
Слайд 17Факторы, разрушающие водородную связь в белковой молекуле
(денатурирующие факторы)
Электромагнитное излучение
Вибрации
Высокие
Химические вещества