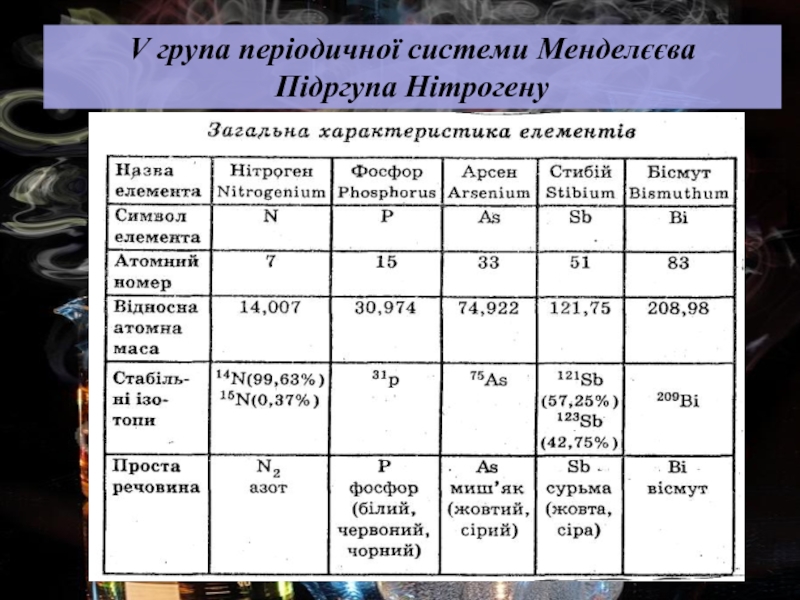
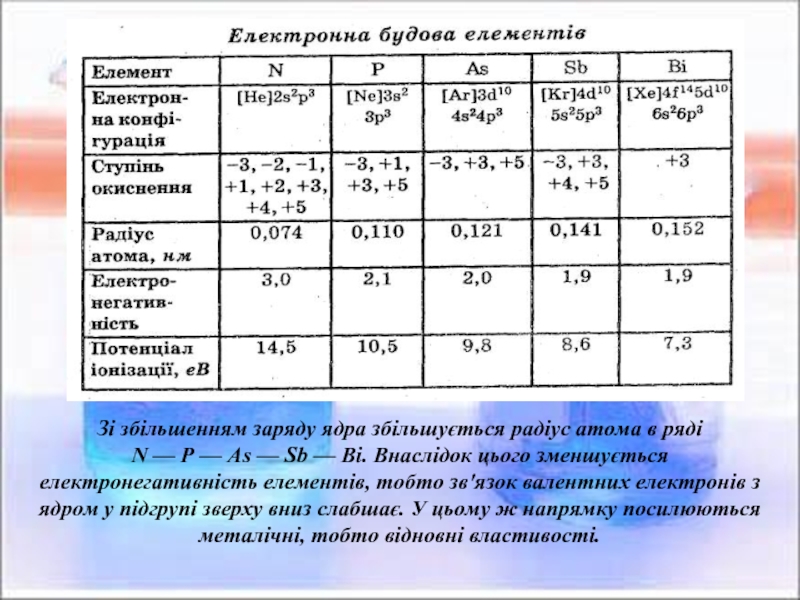
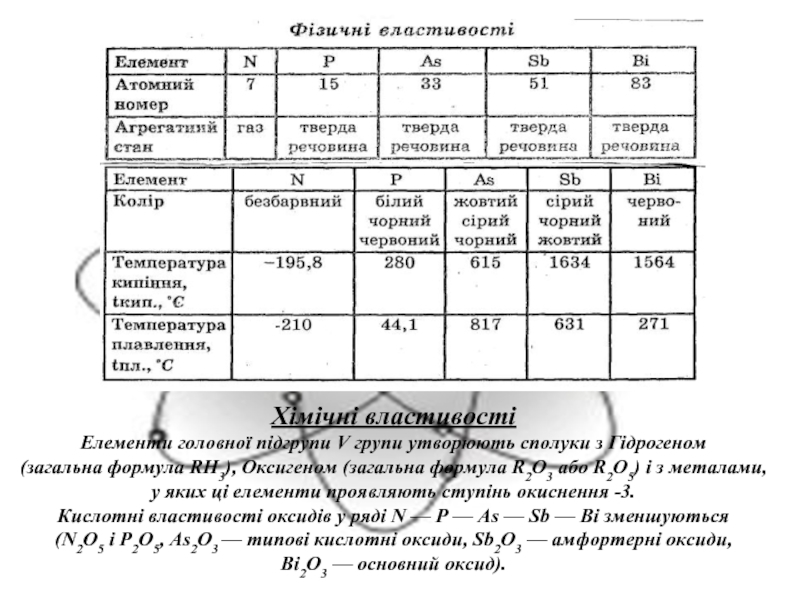
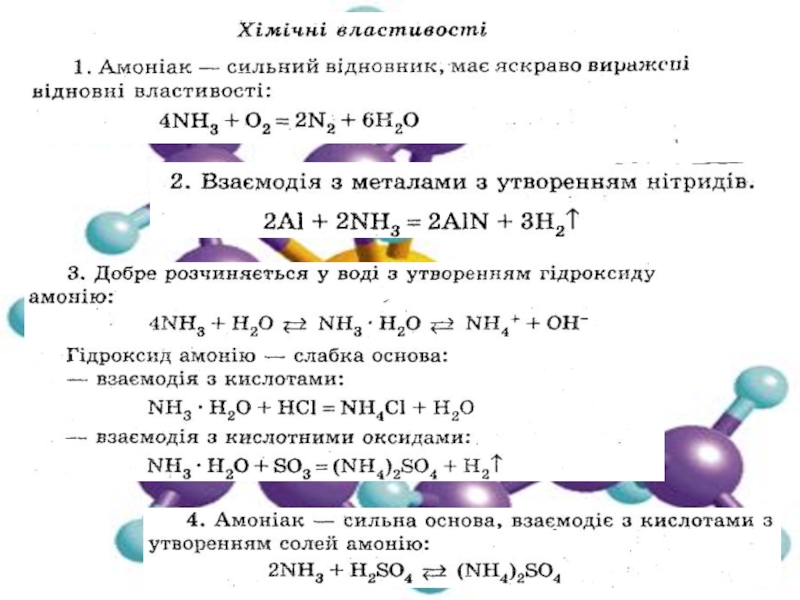
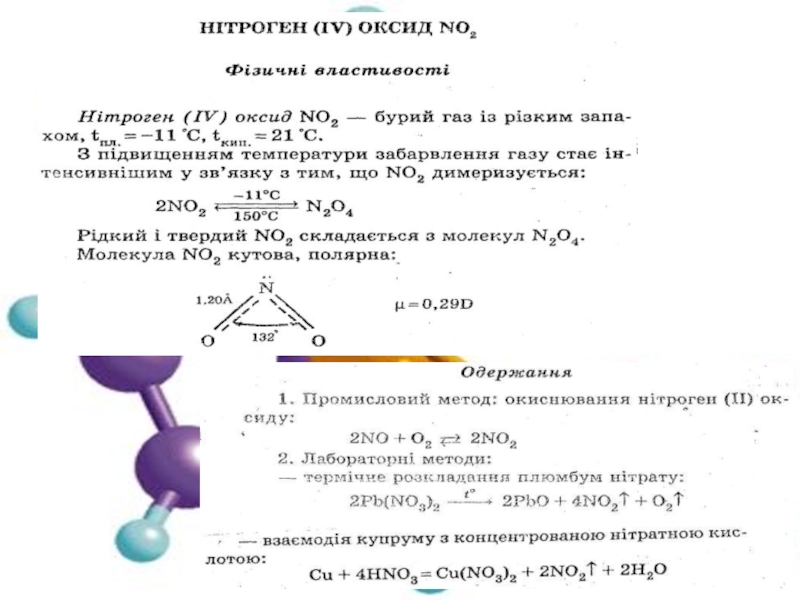
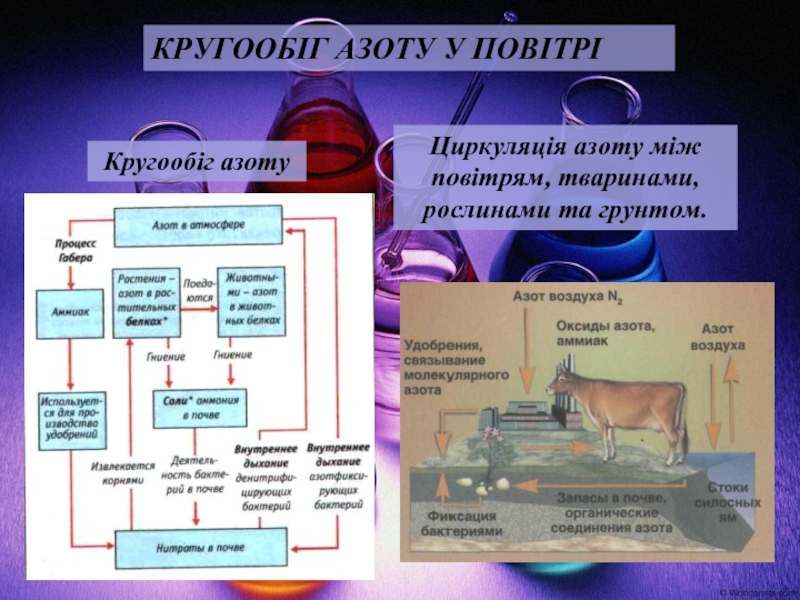
2. Нітроген. Оксиди Нітрогену.
Властивості, одержання, застосування
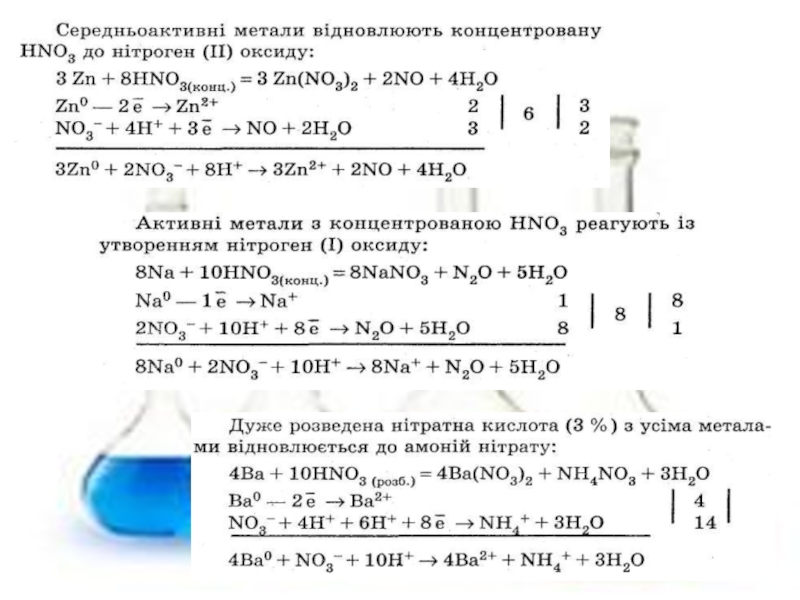
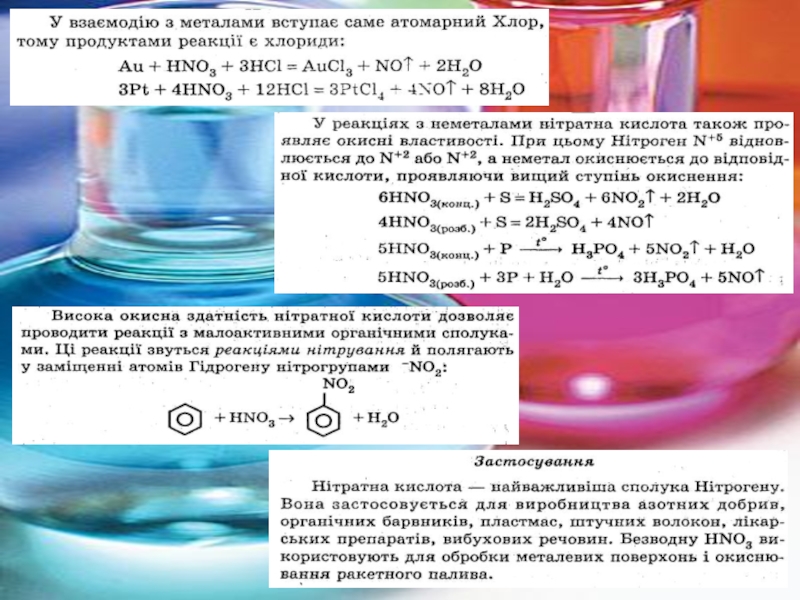
3. Нітратна кислота. Властивості, застосування.
4. Солі нітратної кислоти.
5. Фосфор, характеристика, властивості, застосування.
6. Сполуки фосфору. Властивості, значення, застосування.
7. Ортофосфатна кислота.
Значення, властивості застосування.
8. Арсен, Стибій, Бісмут. Значення, властивості.