- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углеводы - 2 презентация
Содержание
- 1. Углеводы - 2
- 2. Содержание : 1.Пути обмена глюкозо-6 фосфата в
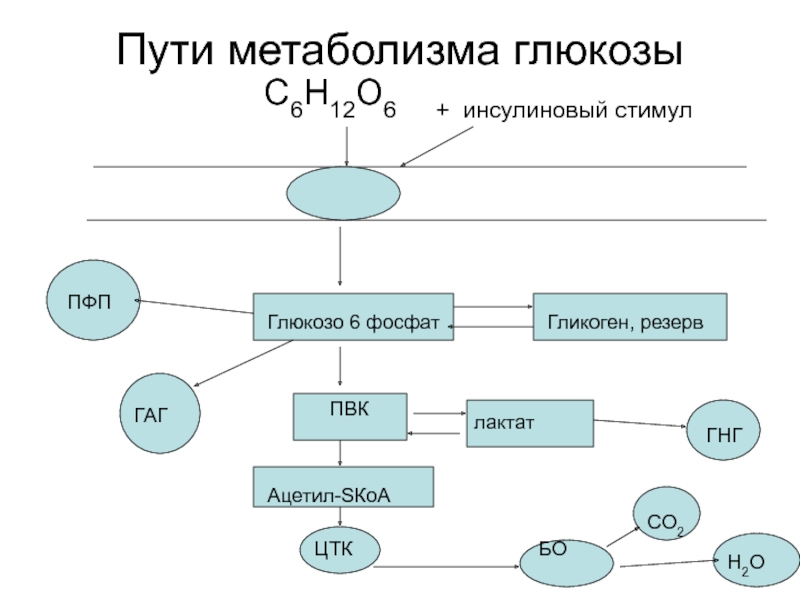
- 3. Пути метаболизма глюкозы
- 4. Гликолиз Это центральный путь
- 8. Первой реакцией гликолиза является фосфорилирование Гл.
- 9. В печени, почках, поджелудочной железе
- 12. 3-я реакция - Фосфофруктокиназная (ФФК)
- 13. Различают регуляторную и субстратную концентрацию АТФ. Км
- 14. При снижении этого коэффициента интенсивность гликолиза увеличивается.
- 15. 4
- 16. 4-я реакция обратима. Фермент-альдолаза Разрыв связи происходит
- 18. Именно в
- 19. Эти фрагменты — глицеральдегид-3-фосфат
- 21. Определение активности
- 22. Таким образом заканчивается первый подготовительный
- 23. II этап гликолиза – гликолитическая
- 25. В этой реакции в молекулу
- 28. Следующий промежуточный продукт, гидролиз которого
- 30. Далее происходит
- 32. На последней стадии, которая катализируется
- 34. При гликолизе на активацию одной
- 35. Ферменты гликолиза, кроме альдолазы нуждаются ионах Мg++
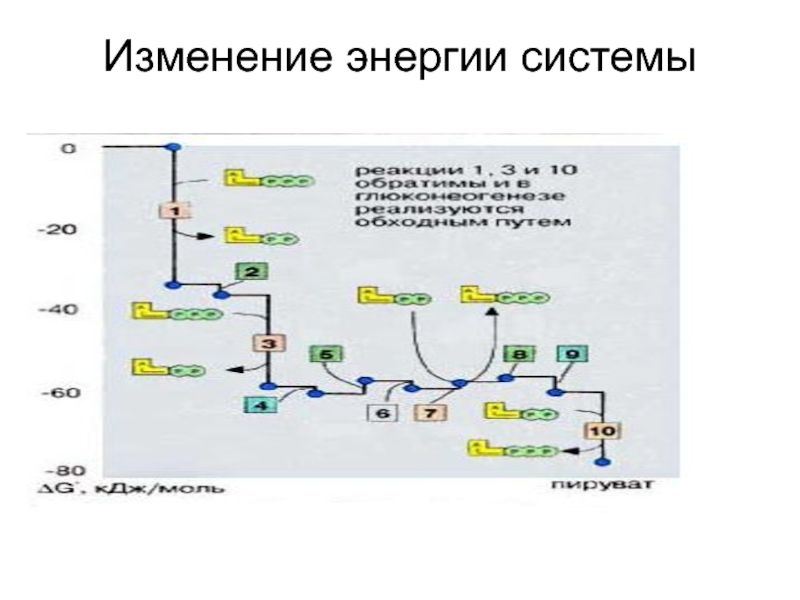
- 36. Изменение энергии системы
- 37. Энергетический баланс гликолиза В 1-й
- 38. Биологическое значение гликолиза 1. Филогенетически
- 39. 4.Роль гликолиза для отдельных клеток.
- 40. В эритроцитах гликолиз это единственный
- 41. Контроль гликолиза осуществляется ЛДГ и
- 42. В анаэробных тканях( печень, мышцы)
- 43. Механизм гликолитической оксидоредукции. Субстратное фосфорилирование
- 44. 3ФГК 1,3
- 45. Это цикл гликолитической оксидоредукции.
- 46. Кроме этих двух существует еще
- 47. Спиртовое брожение В тканях различных
- 48. глюкоза
- 49. Этанол является уникальным веществом,т.к. представлен
- 52. Введение этанола приводит к сдвигам
- 53. Пути метаболизма этанола
- 54. Дальнейшее окисление ацетальдегида:
- 55. 2. Путь обезвреживания этанола через Микросомальную систему
- 56. 3.путь обезвреживания этанола – пероксидазный, минорный
- 57. Метаболические последствия интоксикации этанолом Этанол
- 58. При приеме этанола увеличивается активность
- 59. Этанол хорошо растворяется в воде
- 60. ЖК
- 62. Второй причиной яв-ся образование ацетил-КоА,
- 63. Аэробный гликолиз.
- 64. Аэробный гликолиз. При анаэробном
- 65. Метаболизм ПВК
- 66. Пируват, образовавшийся в реакциях гликолиза (в
- 67. Пируватдегидрогеназный комплекс включает три фермента:
- 69. Пируватдегидрогеназа состоит из 60 полипептидных
- 71. Е1 катализирует декарбоксилирование ПВК с участием кофермента
- 72. Дисульфидная группа липоевой кислоты способна восстанавливаться и
- 73. Наконец, начинает функционировать Е3, коферментом
- 74. Таким образом, в окислительном
- 76. Образующийся ацетил-КоА затем окисляется в
- 77. При недостаточном содержании в диете
- 78. При выраженном дефиците тиамина развивается некомпенсированный ацидоз, который без лечения приводит к летальному исходу.
- 79. При низкой концентрации инсулина и высоком уровне
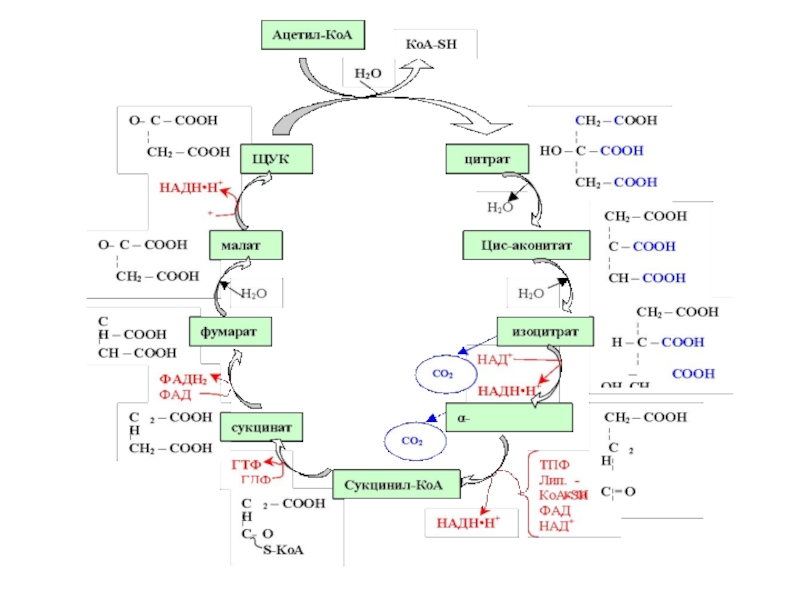
- 80. Цикл Кребса – центральный путь обмена веществ.
- 82. Эффект Пастера –подавление гликолиза дыханием впервые было
- 83. Гликогенолиз
- 84. гликоген
- 85. В процессе гликогенолиза в виде
- 86. Заключение. Т.о. в отсутствие кислорода клетка может
Слайд 2Содержание :
1.Пути обмена глюкозо-6 фосфата в тканях
2.Анаэробное расщепление глюкозы
3.Спитровое брожение
4.Аэробный гликолиз
5.Регуляция
6.Энергетический баланс окисления
углеводов.
Слайд 3Пути метаболизма глюкозы
Глюкозо 6 фосфат
ПВК
лактат
ГНГ
Гликоген, резерв
ПФП
ГАГ
Ацетил-SКоА
ЦТК
БО
СО2
Н2О
Слайд 4Гликолиз
Это центральный путь энергетичекого обмена протекает без окислительных
В анаэробных условиях –гликолиз единственный процесс, поставляющий энергию. Протекает практически во всех тканях. Уровень активности зависит от аэрации и оксигенации тканей
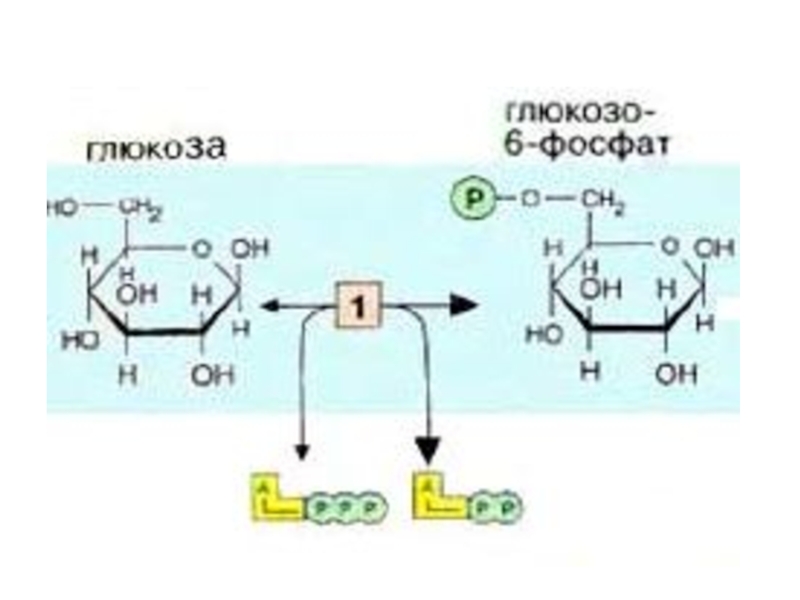
Слайд 8Первой реакцией гликолиза является фосфорилирование Гл.
В результате этой реакции образуется
Гексокиназа- аллостерический ферментом и ингибируется Гл-6-ф. Она также может фосфорилировать фруктозу и маннозу.
Гексокиназа есть во всех клетках организма Км от 0.01-01ммоль/л
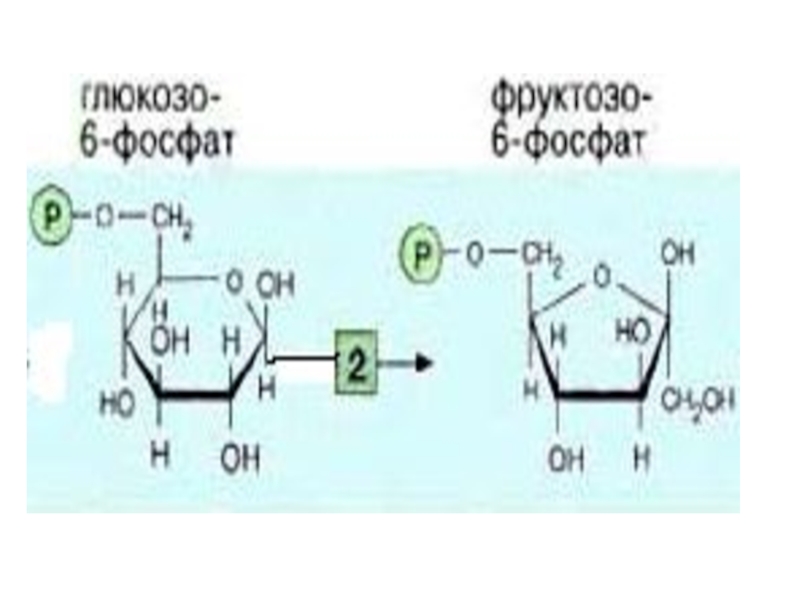
Слайд 9 В печени, почках, поджелудочной железе есть глюкокиназа, которая катализирует
Она не ингибируется Гл-6-ф. и имеет высокую Км для глюкозы ( 10 ммоль/л).
2-я реакция идет в присутствии фосфогексоизомеразы.
Слайд 12 3-я реакция - Фосфофруктокиназная (ФФК) реакция определяет скорость гликолиза
ФФК относится к числу аллостерических ферментов.. Она ингибирует АТФ и стимулирует АДФ и АМФ.
АТФ в данном случае является и субстратом и аллостерическим регулятором для ФФК
Слайд 13Различают регуляторную и субстратную концентрацию АТФ. Км для субстратного и регуляторного
При значительных величинах АТФ/АДФ активность ФФК снижается и гликолиз замедляется↓.
Слайд 14При снижении этого коэффициента интенсивность гликолиза увеличивается. Так в неработающей мышце
Во время работы (АТФ) ↑.
ФФК ингибируется цитратом, активируется ионами СА++. Жирные кислоты, и их ацил-КоА –производные, яв-ся ингибитрами ФФК.
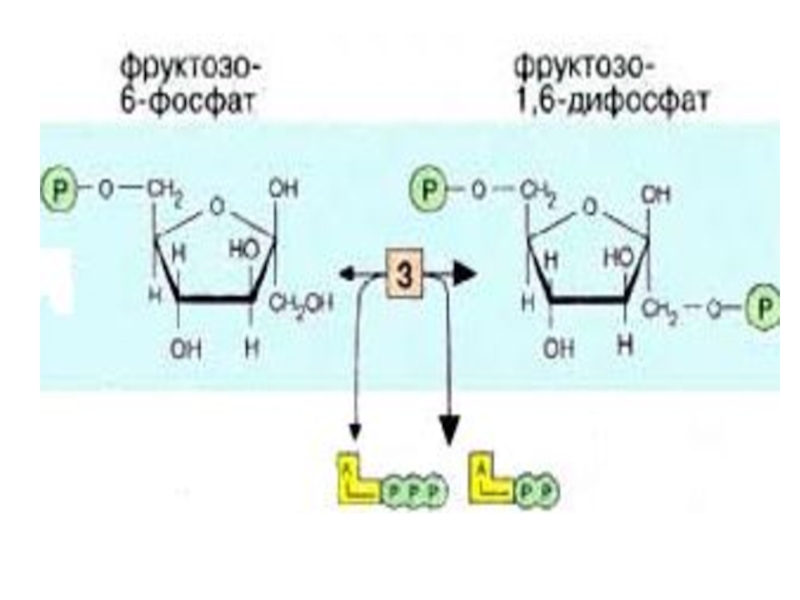
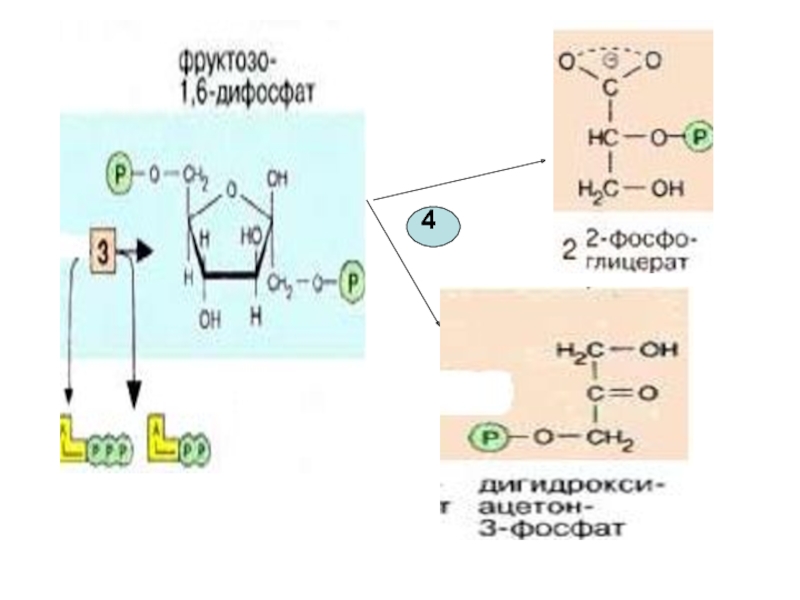
Слайд 164-я реакция обратима. Фермент-альдолаза Разрыв связи происходит в результате напряжения между
Слайд 18
Именно в силу последнего обстоятельства, обратимая триозофосфатизомеразная
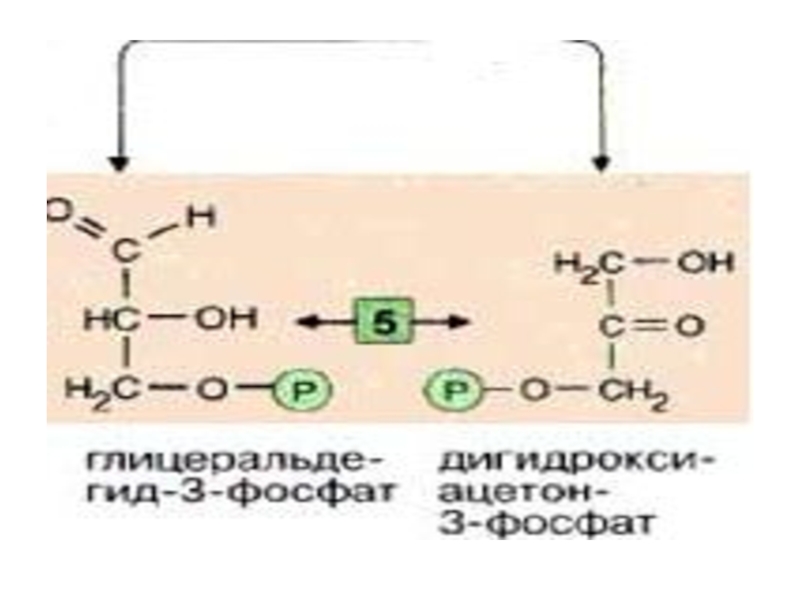
Слайд 19
Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один
Слайд 21
Определение активности альдолазы используют в энзимодиагностике при
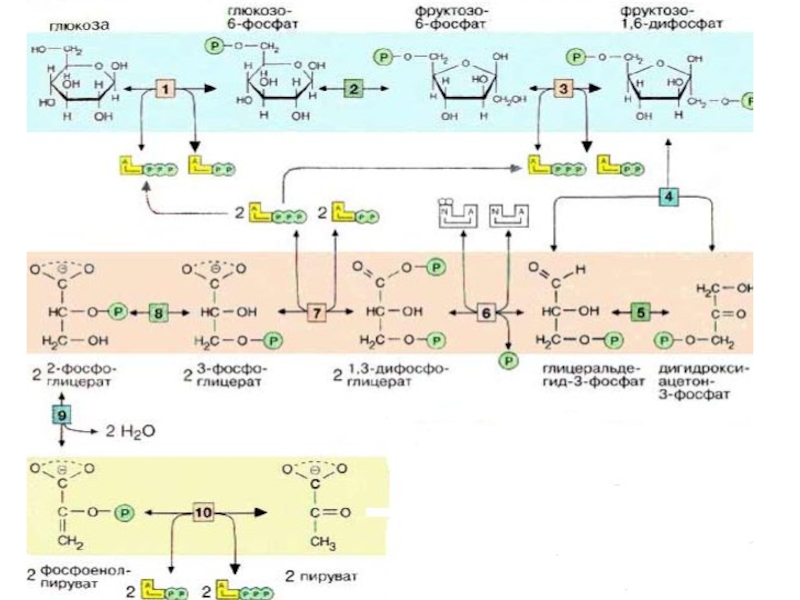
Слайд 22 Таким образом заканчивается первый подготовительный и энергопотребляющий этап гликолиза,
На этом этапе гликолиза фактически образуется 2 молекулы 3-ФГА.
Слайд 23 II этап гликолиза – гликолитическая оксидоредукция.
Реакция контролируется НАД+ и НАДН+Н+. Эту реакцию контролирует ↑ НАД+ и ↓ НАДН+Н+
Слайд 25 В этой реакции в молекулу включается неорганический фосфат («субстратное
Такое промежуточное соединение содержит смешанную ангидридную связь, расщепление которой является высоко экзоэргическим процессом.
Слайд 26
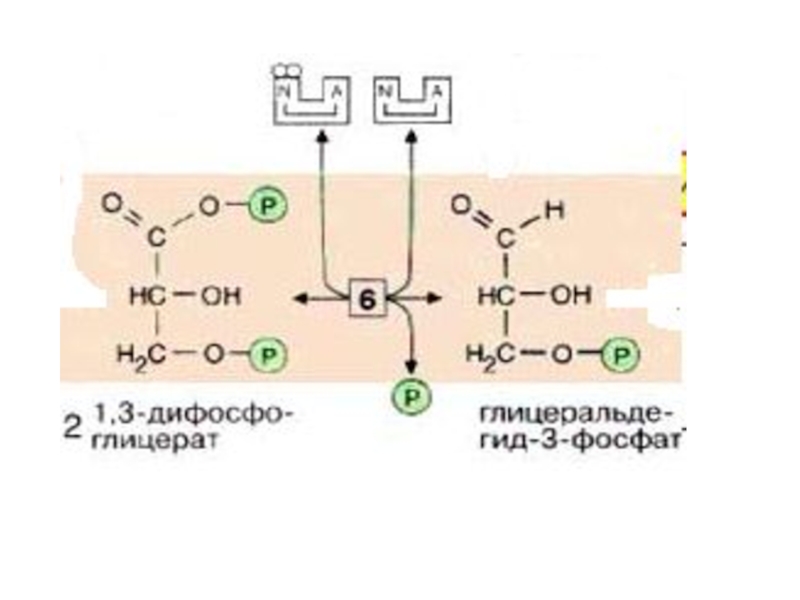
На следующей стадии (катализируемой фосфоглицераткиназой
( фосфотрансфераза).
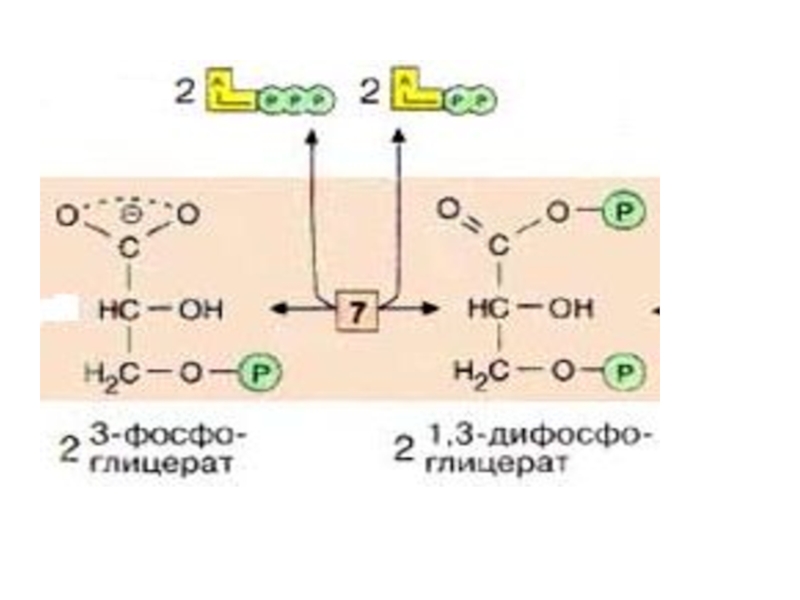
Слайд 28 Следующий промежуточный продукт, гидролиз которого может быть сопряжен с
в 2-фосфоглицерат (фермент: фосфоглицератмутаза [8])
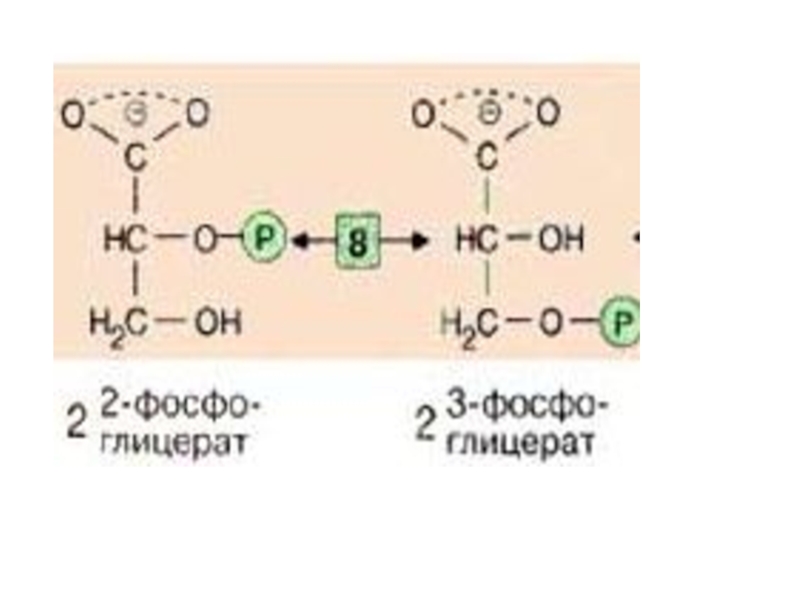
Слайд 30
Далее происходит отщепление воды (фермент: енолаза [9]).
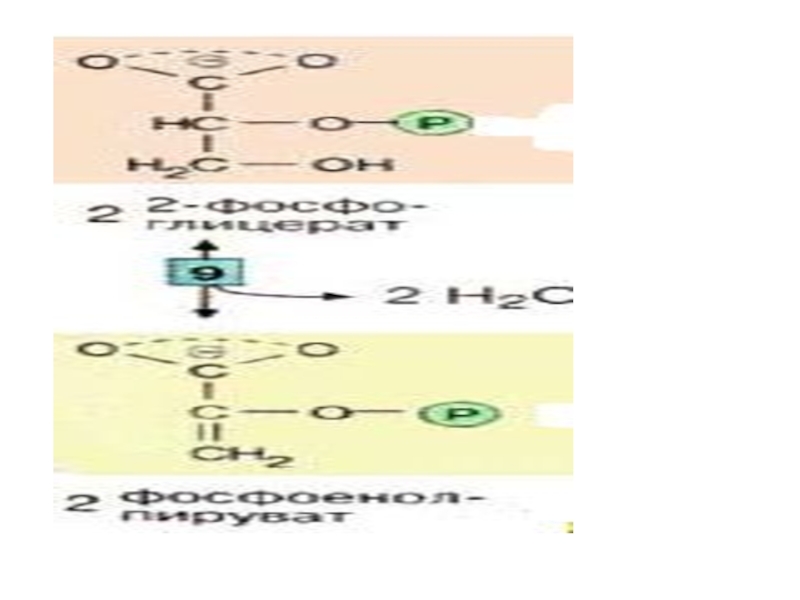
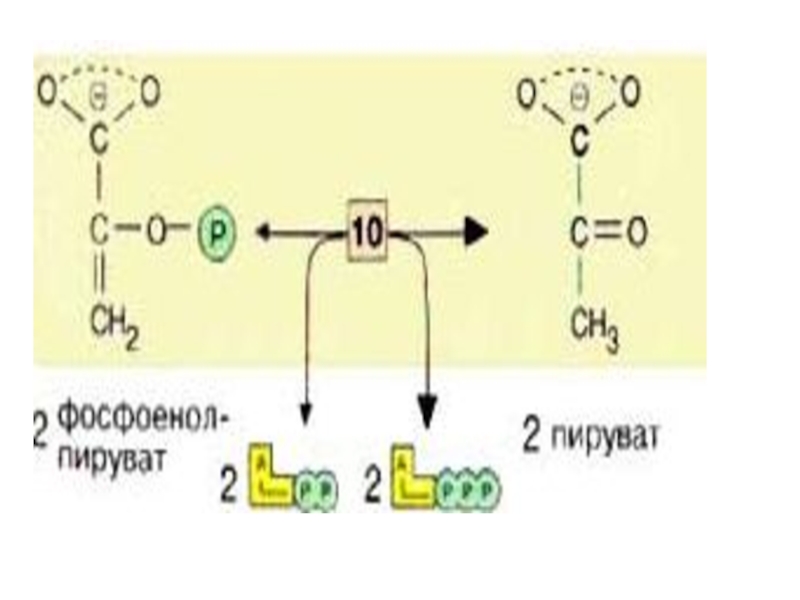
Слайд 32 На последней стадии, которая катализируется пируваткиназой [10], образуются пируват
Слайд 34 При гликолизе на активацию одной молекулы глюкозы потребляется 2
В результате выигрыш энергии составляет 2 моля АТФ на моль глюкозы.
Слайд 37Энергетический баланс гликолиза
В 1-й стадии гликолиза затрачивается 2 молекулы
Во 2-й стадии образуется 4 молекулы АТФ( фосфоглицераткиназная и пируваткиназная реакции).
Т.о. энергетическая эффективность гликолиза составляет 2 мол. АТФ на 1 молекулу глюкозы.
Слайд 38Биологическое значение гликолиза
1. Филогенетически самый древний способ получения энергии
3.Гликолиз является источником углеродных радикалов для биосинтезов ( липидов, аминокислот, глюкозы).
Слайд 394.Роль гликолиза для отдельных клеток.
В мышцах гликолиз поставляет АТФ.
используются в ГНГ
(глюконеогенезе), а избыток глюкозы
переходит в липиды.
В клетках мозга гликолиз является
фрагментом аэробного пути
окисления.
Слайд 40 В эритроцитах гликолиз это единственный путь получения энергии, поскольку
Наследственный дефект пируваткиназы является причиной гемолитической анемии. Если эритроциты имеют менее 25% активности фермента, то скорость гликолиза снижается.
Слайд 41 Контроль гликолиза осуществляется ЛДГ и ее изоферментами.
В
( сердце, почки) преобладают ЛДГ1 и ЛДГ2. Эти ферменты ингибируют даже небольшие концентрации ПВК, что препятствует образованию лактата и способствует более полному окислению ПВК в ЦТК.
Слайд 42 В анаэробных тканях( печень, мышцы) преобладает ЛДГ4 и ЛДГ5.
ЛДГ4 и ЛДГ5 обеспечивают интенсивное превращение ПВК в лактат.
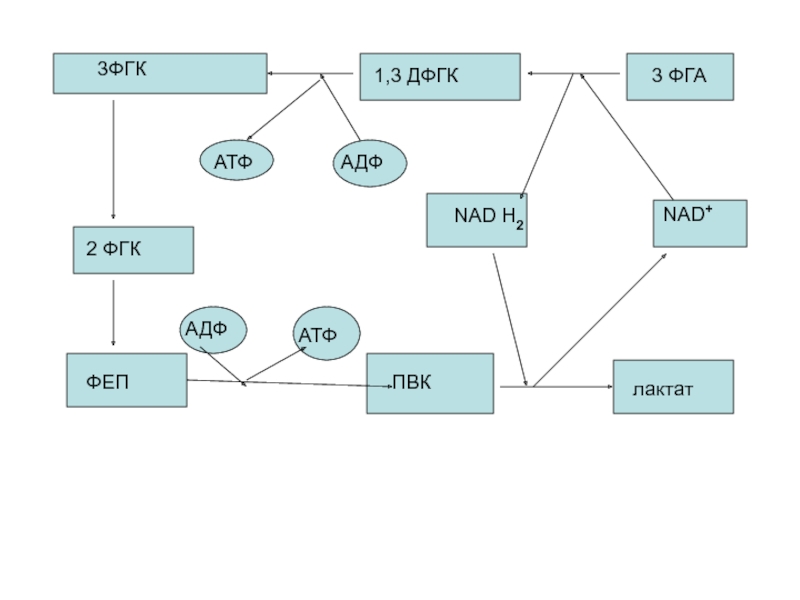
Слайд 45 Это цикл гликолитической оксидоредукции. Ключевое значение имеет реакция
Здесь также указаны пункты образования АТФ путем фосфорилирования. Они соответствуют 2-м киназным реакциям- фосфоглицераткиназной и пируваткиназной.
Слайд 46 Кроме этих двух существует еще 2 киназные реакции, в
Киназные реакции гликолиза являются
фосфотрансферазными, т.е. осуществляется перенос макроэргического фосфата с S на АДФ в фосфоглицераткиназной и пируваткиназной реакциях, а также с АТФ на S в гексокиназной и фосфофруктокиназной р- ях.
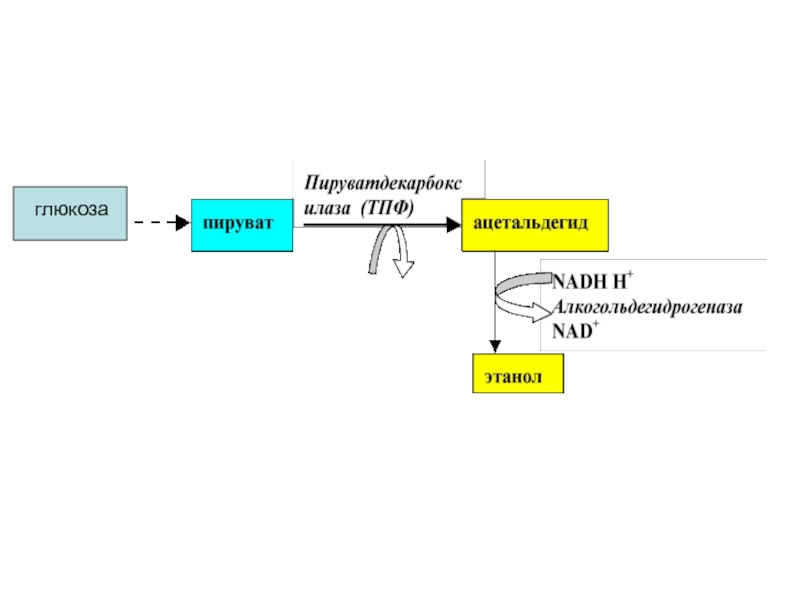
Слайд 47Спиртовое брожение
В тканях различных организмов имеются ферменты, расщепляющие глюкозу
Суммарное уравнение :
С6Н12О6_? 2 СО2 + 2С2Н5ОН
По своему механизму СБ очень близок к
гликолизу. Расхождение начинается лишь после образования ПВК.
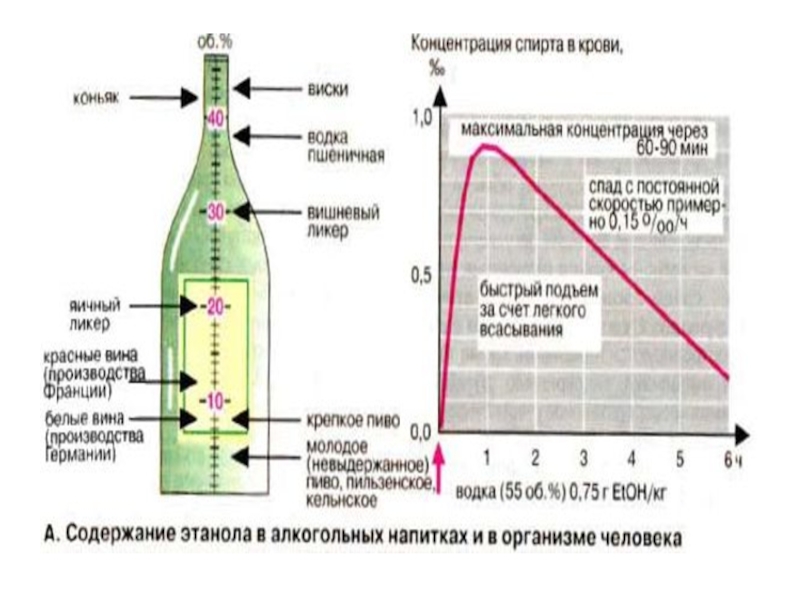
Слайд 49 Этанол является уникальным веществом,т.к. представлен в двух видах:
1.
моль/л- это нормальная эндогенная концентрация.
2.При употреблении в больших дозах этанол выступает как ксенобиотик-чужеродный для организма агент.
Слайд 52 Введение этанола приводит к сдвигам в нервной системе, которые
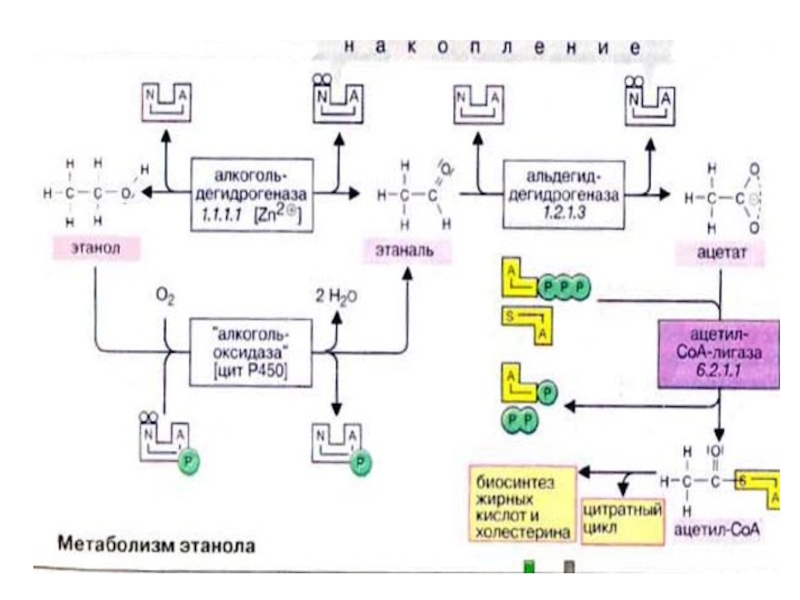
Слайд 53Пути метаболизма этанола
1.СН3СН2ОН<----------------?CН3СОН
Где АлДГ- алкогольдегидрогеназа ( NAD зависимая)
CН3СОН – это центральный фигурант токсических эффектов этанола
NADH2
Слайд 54Дальнейшее окисление ацетальдегида:
CН3СОН-----------?СН3СО SКоА---?ЦТК
↓[O]
↓
СН3СООН
Н Н
| l
СН3---С =О + Н2N—R-----? СН2— С=NR
Шиффовое основание
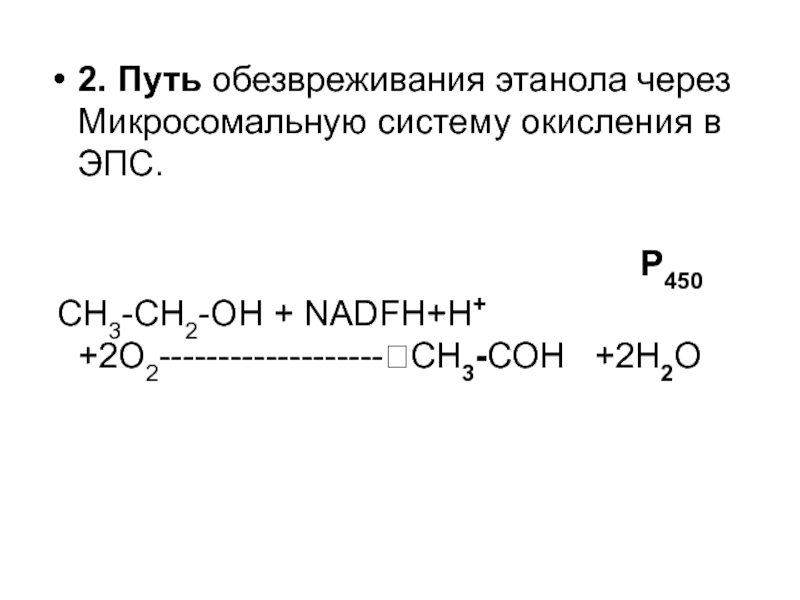
Слайд 552. Путь обезвреживания этанола через Микросомальную систему окисления в ЭПС.
СН3-СН2-ОН + NADFH+H+ +2O2-------------------?СН3-СОН +2Н2О
Слайд 56 3.путь обезвреживания этанола – пероксидазный, минорный каталазный
СН3-СН2-ОН +Н2О2 --*-?
где *- каталаза
Ацетальдегид нацелен на аминогруппы(-NН2), с которыми он может образовывать шиффовые основания. За счет двойных связей происходят реакции полимеризации и образуются пигменты, обладающие морфиноподобным действием.
Слайд 57Метаболические последствия интоксикации этанолом
Этанол лимитирует основной фонд NAD+, переводя
Побочными продуктами ГЛУ являются ГАМК и ГОМК- медиаторы торможения.
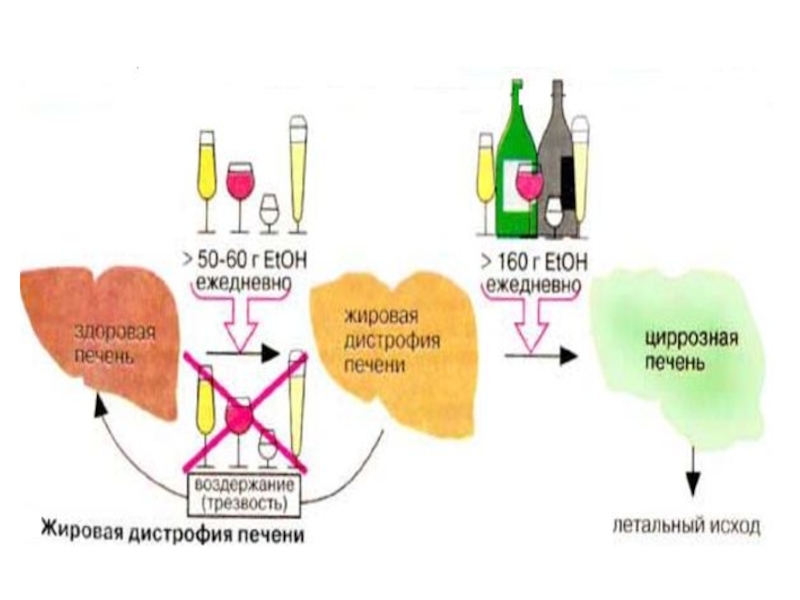
Слайд 58 При приеме этанола увеличивается активность каталазы,которая провоцирует перекисные процессы,
При хронической алкогольной интоксикации развивается жировая инфильтрация и дегенерация печени.
Слайд 59 Этанол хорошо растворяется в воде и липидах. Он растворим
Введение этанола создает экстремальную ситуацию, которая во- первых, сопровождается выбросом адреналина, а значит активирует липолиз, повышает содержание жирных кислот( ЖК ), которые поступают в печень .
Слайд 60
ЖК должны окисляться под действием NAD-зависимых ДГ,но
При длительном использовании этанола, печень просто не успевает утилизировать ЖК для биосинтеза ФЛ. Поэтому ЖК накапливаются в печени.
Слайд 62 Второй причиной яв-ся образование ацетил-КоА, из этанола, который также
Аналогичные процесс протекают и в миокарде, при этом развивается синдром «жирового» сердца (слой кардиоцитов чередуется с адипоцитами).
Однако,прием этанола обеспечивает устойчивость организма к другим ядам.
Слайд 64Аэробный гликолиз.
При анаэробном гликолизе ПВК превращается в лактат,
Аэробный гликолиз совпадает с анаэробным до стадии образования ПВК, а в дальнейшем протекает окислительное декарбоксилирование (ОД) ПВК.
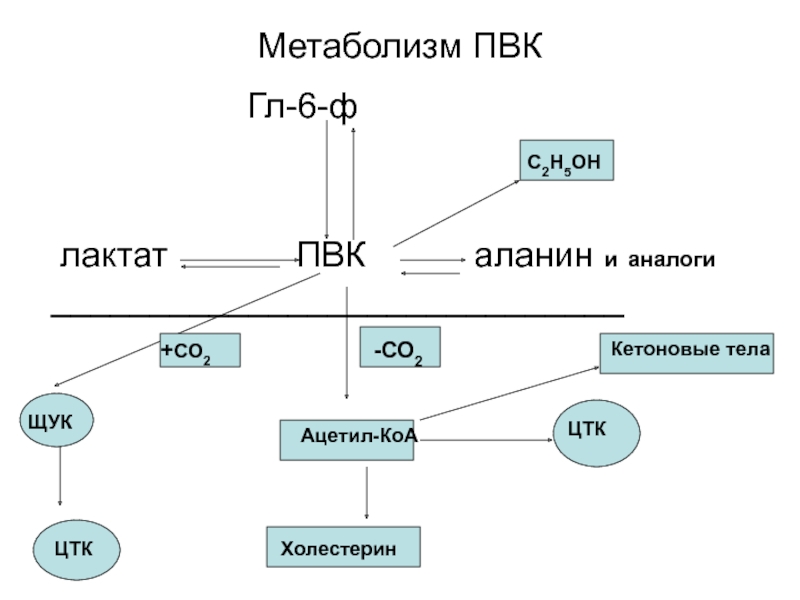
Слайд 65Метаболизм ПВК
лактат ПВК аланин и аналоги _____________________________
Ацетил-КоА
ЦТК
Холестерин
С2Н5ОН
Кетоновые тела
ЩУК
+СО2
-СО2
ЦТК
Слайд 66
Пируват, образовавшийся в реакциях гликолиза (в цитоплазме), должен быть транспортирован в
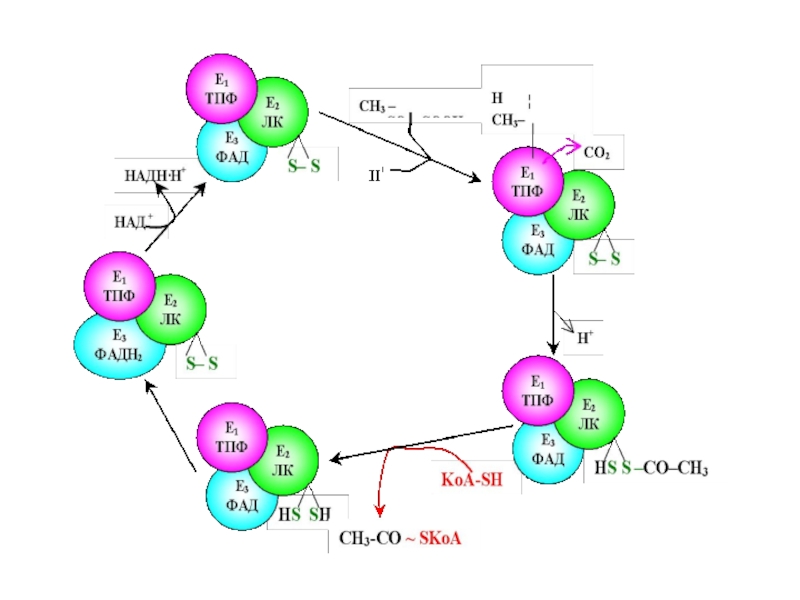
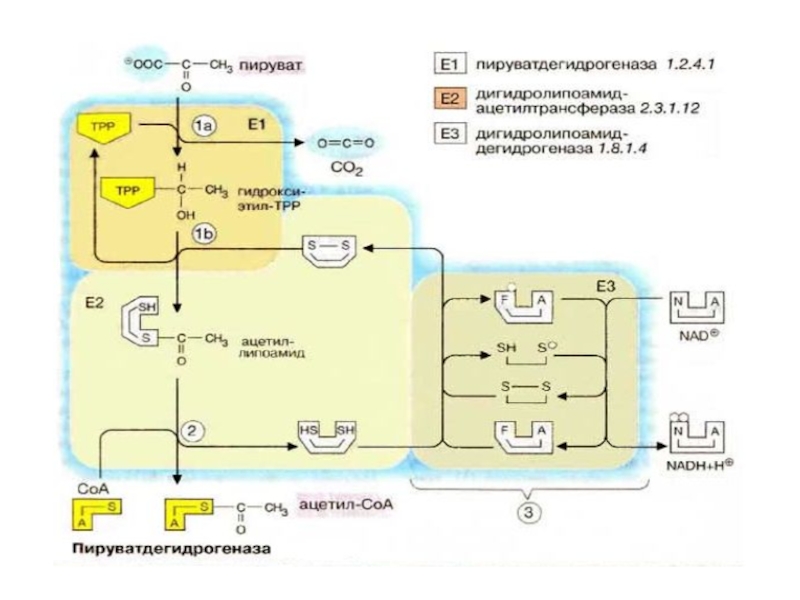
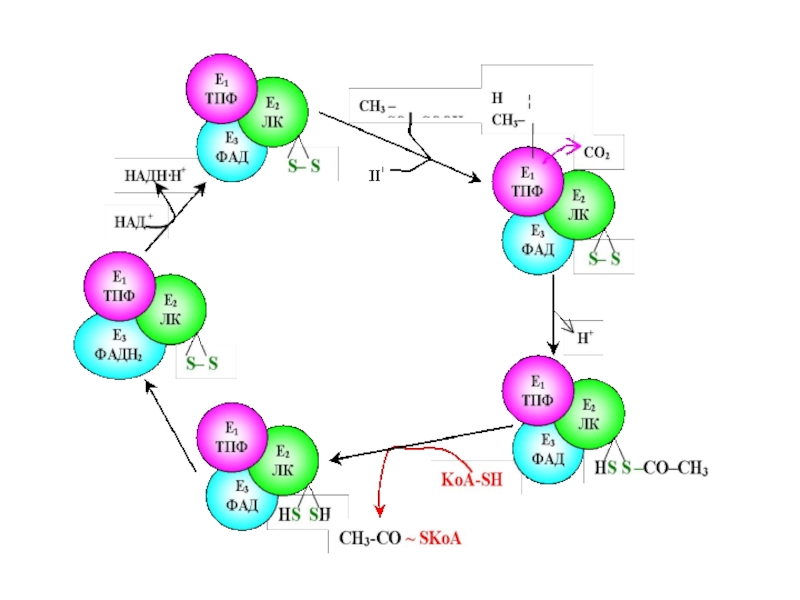
Слайд 67 Пируватдегидрогеназный комплекс включает три фермента:
пируватдегидрогеназу,липоатацетил-
трансферазу
липоамиддегидрогеназу
Слайд 69 Пируватдегидрогеназа состоит из 60 полипептидных цепей, которые можно разделить
Слайд 71Е1 катализирует декарбоксилирование ПВК с участием кофермента тиаминпирофосфата (ТРР). Образовавшийся продукт
Слайд 72Дисульфидная группа липоевой кислоты способна восстанавливаться и ацетилироваться. В реакции, катализируемой
Слайд 73 Наконец, начинает функционировать Е3, коферментом которого является ФАД: кофермент
Слайд 74
Таким образом, в окислительном декарбоксилировании ПВК участвует фактически 3
Слайд 76 Образующийся ацетил-КоА затем окисляется в цикле Кребса, а водород
ПВК-ДГ отличается большим отрицательным редокс-потенциалом, который способен обеспечить не только восстановление NAD+, но и способствовать образованию высокоэнергетической тиоэфирной связи в ацетил-КоА (СН3-СО~ SкоА).
Слайд 77 При недостаточном содержании в диете входящих в состав ПВК-ДГ
Слайд 78
При выраженном дефиците тиамина развивается некомпенсированный ацидоз, который без лечения приводит
Слайд 79При низкой концентрации инсулина и высоком уровне энергообеспеченности клетки (↑АТФ, ↑
Слайд 80Цикл Кребса – центральный путь обмена веществ.
Своё название этот метаболический путь
Слайд 82Эффект Пастера –подавление гликолиза дыханием впервые было обнаружено у микроорганизмов.
Эффект Кретбри-
Слайд 83 Гликогенолиз и гликолиз
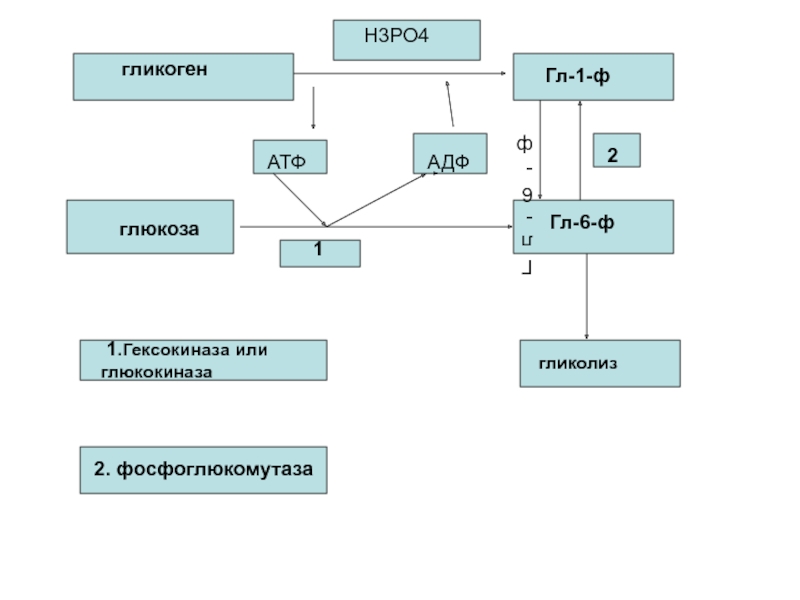
Процесс анаэробного распада гликогена получил название гликогенолиза.
Образовавшийся в ходе фосфоглюкомутазной реакции Гл-6-ф, включается в процесс гликолиза.
После образования Гл-6-ф, дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
Слайд 84
гликоген
Н3РО4
Гл-1-ф
глюкоза
Гл-6-ф
АТФ
АДФ
1
2
1.Гексокиназа или глюкокиназа
2. фосфоглюкомутаза
гликолиз
Слайд 85 В процессе гликогенолиза в виде макроэргических соединений накапливается не
На первый взгляд кажется, что гликогенолиз энергетически более выгодный процесс. Но во время синтеза гликогена расходуется АТФ, поэтому гликогенолиз и гликолиз энергетически равноценны.










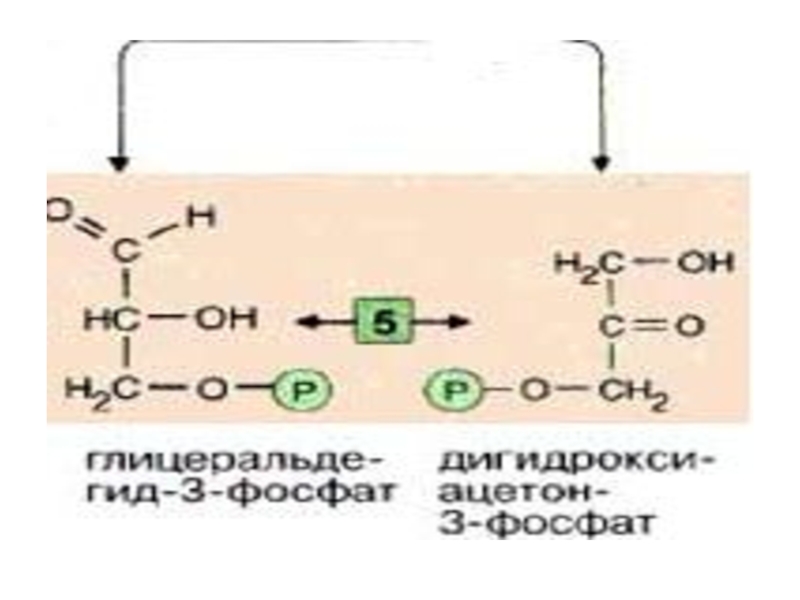

![Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один в другой триозофосфатизомеразой [5].](/img/tmb/5/446248/3c482ec9cb7e6fd017665882bd65e3cc-800x.jpg)


![II этап гликолиза – гликолитическая оксидоредукция. Глицеральдегид-3-фосфат затем окисляется глицеральдегид-З-фосфатдегидрогеназой [6] с образованием](/img/tmb/5/446248/b0f0641554dc027db5d0e1639be40043-800x.jpg)

![На следующей стадии (катализируемой фосфоглицераткиназой [7]), гидролиз этого соединения сопряжен с образованием](/img/tmb/5/446248/768f7b286421da182dbcf807c3f85bfb-800x.jpg)

![Далее происходит отщепление воды (фермент: енолаза [9]). Продукт представляет собой сложный эфир фосфорной](/img/tmb/5/446248/67f2ce2d1373b41597af943d0fb6ee81-800x.jpg)
![На последней стадии, которая катализируется пируваткиназой [10], образуются пируват и АТФ. Наряду со стадией](/img/tmb/5/446248/1adf764934015d113c23fcd4941be781-800x.jpg)















![Дальнейшее окисление ацетальдегида: HSKoACН3СОН-----------?СН3СО SКоА---?ЦТК ↓[O] ↓](/img/tmb/5/446248/9007d8927d805c958d3cbbcee63f55b8-800x.jpg)