- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углеводороды. Алкены презентация
Содержание
- 1. Углеводороды. Алкены
- 2. Алкены (этиленовые углеводороды, олефины) -
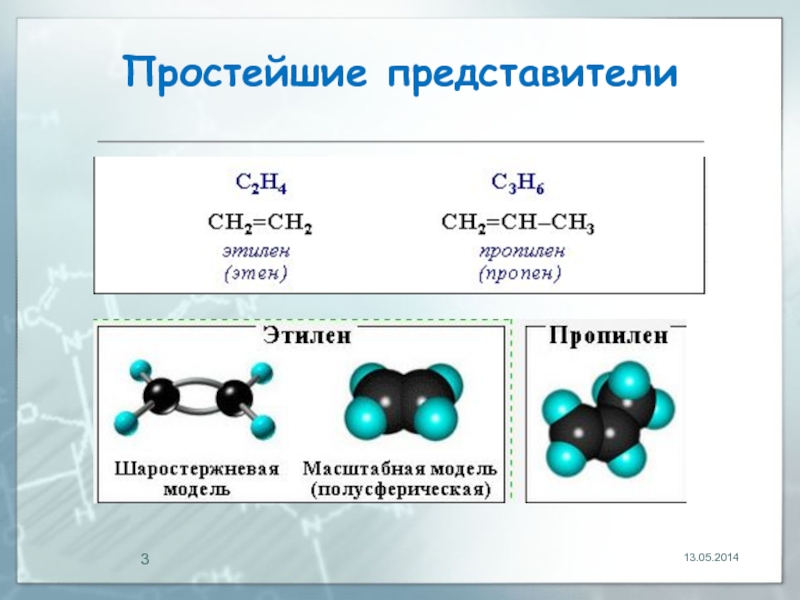
- 3. Простейшие представители 13.05.2014
- 4. Алкены В отличие от предельных углеводородов,
- 5. Строение С=С связи Каждый из атомов имеет
- 6. Строение С=С связи Двойная связь является сочетанием
- 7. Строение С=С связи Образование связей в молекуле этилена можно изобразить следующей схемой: 13.05.2014
- 8. Строение С=С связи σ-Связи, образуемые sp2-гибридными орбиталями,
- 9. Номенклатура алкенов названия алкенов производят от названий
- 10. Номенклатура алкенов названия алкенов производят от названий
- 11. Номенклатура алкенов Нумерацию углеродных атомов начинают с
- 12. Номенклатура алкенов В номенклатуре различных классов органических
- 13. Номенклатура алкенов Назовите следующие алкены: CH2=CH2 CH3—CH=CH2
- 14. Структурная изомерия алкенов 13.05.2014 1. Изомерия углеродного скелета (начиная с С4Н8):
- 15. Структурная изомерия алкенов 13.05.2014 2. Изомерия положения двойной связи (начиная с С4Н8) :
- 16. Структурная изомерия алкенов 13.05.2014 3.Межклассовая изомерия с циклоалканами, начиная с С3Н6 :
- 17. Пространственная изомерия алкенов Вследствие жесткой закрепленности атомов
- 18. Пространственная изомерия алкенов в молекуле СН3–СН=СН–СН3 группы
- 19. Свойства алкенов Физические свойства алкенов
- 20. Свойства алкенов Химические свойства алкенов
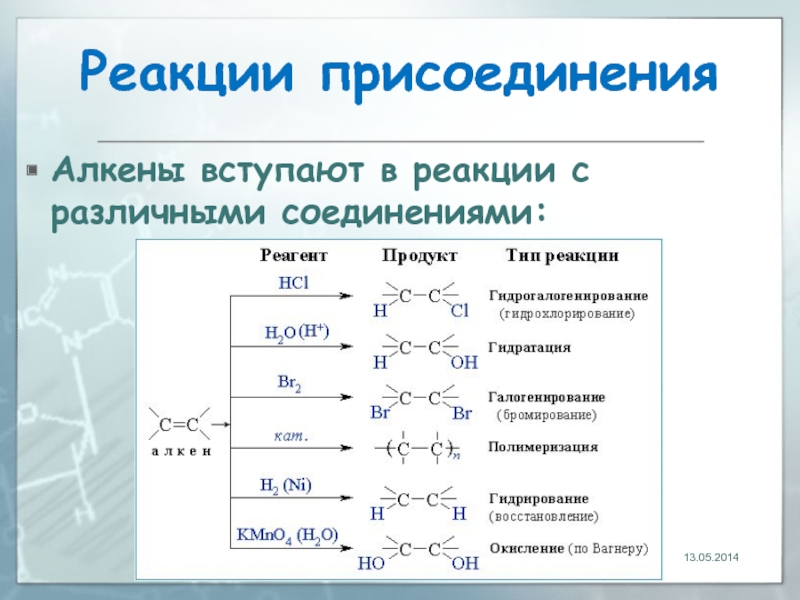
- 21. Реакции присоединения Алкены вступают в реакции с различными соединениями: 13.05.2014
- 22. Гидрирование (присоединение водорода) Алкены взаимодействуют с
- 23. Гидрирование (присоединение водорода) Присоединение водорода к
- 24. Гидрирование (присоединение водорода) Эта реакция используется в промышленности для получения высокооктанового топлива: 13.05.2014
- 25. Галогенирование (присоединение галогенов) Присоединение галогенов по
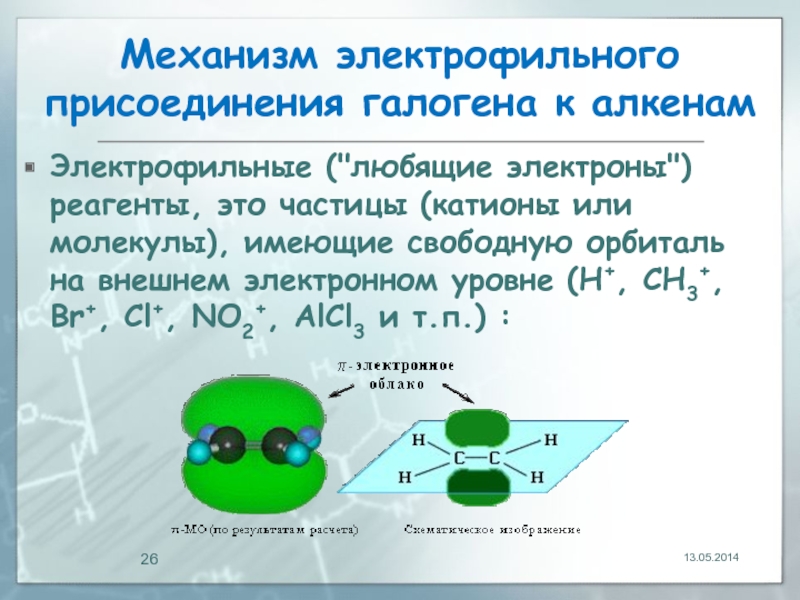
- 26. Механизм электрофильного присоединения галогена к алкенам Электрофильные
- 27. Механизм электрофильного присоединения галогена к алкенам Механизм
- 28. Механизм электрофильного присоединения галогена к алкенам Стадия
- 29. Механизм электрофильного присоединения галогена к алкенам Стадия
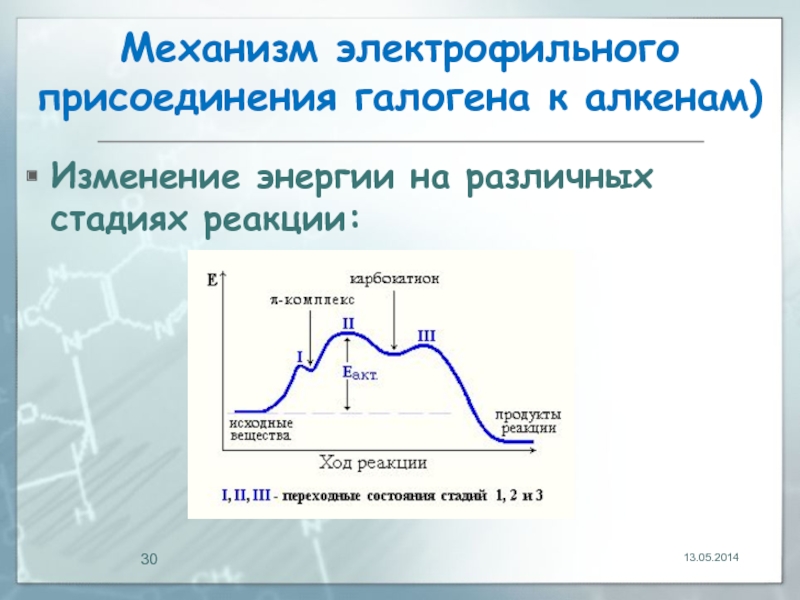
- 30. Механизм электрофильного присоединения галогена к алкенам) Изменение энергии на различных стадиях реакции: 13.05.2014
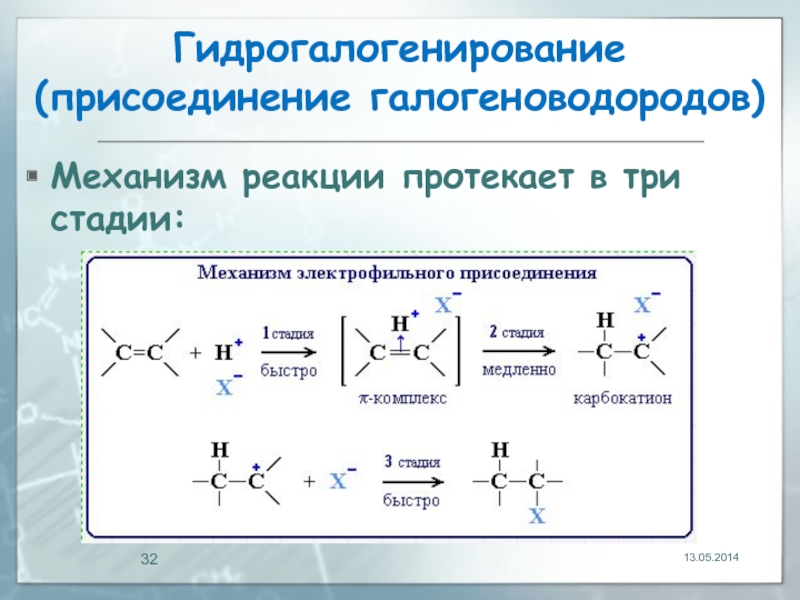
- 31. Гидрогалогенирование (присоединение галогеноводородов) Реакция идет по механизму
- 32. Гидрогалогенирование (присоединение галогеноводородов) Механизм реакции протекает в три стадии: 13.05.2014
- 33. Гидратация (присоединение воды) Гидратация происходит в
- 34. Гидратация (присоединение воды) Реакция происходит в
- 35. Полимеризация алкенов 1. Полимеризация – реакция образования
- 36. Полимеризация алкенов Число n называется степенью полимеризации.
- 37. Полимеризация алкенов 2. Димеризация алкенов – образование
- 38. Получение алкенов I. Крекинг алканов: например: 13.05.2014
- 39. Получение алкенов II. Отщепление (элиминирование) двух
- 40. Получение алкенов II. Отщепление : дегидратация
- 41. Получение алкенов II. Отщепление : Дегидрогалогенирование
- 42. Применение алкенов Алкены применяются в качестве
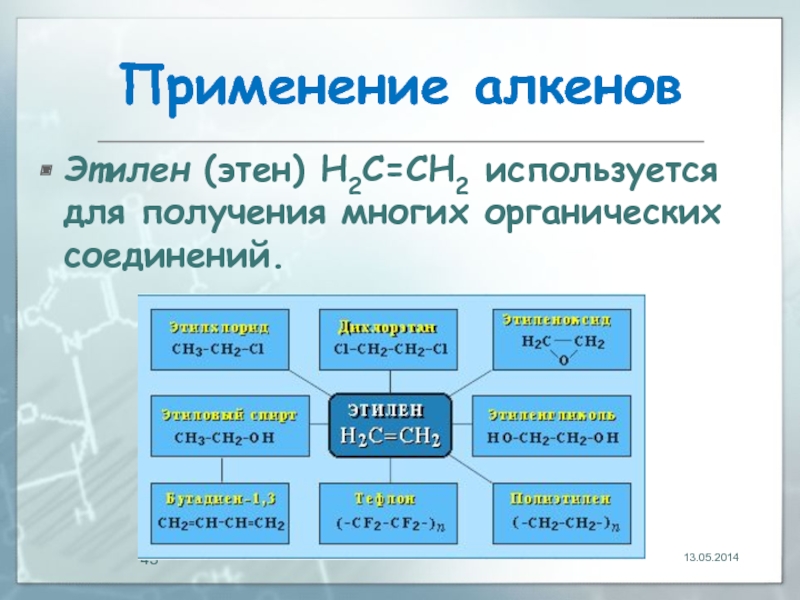
- 43. Применение алкенов Этилен (этен) Н2С=СН2 используется для получения многих органических соединений. 13.05.2014
- 44. Применение алкенов Пропилен (пропен) Н2С=СН2–СН3 и
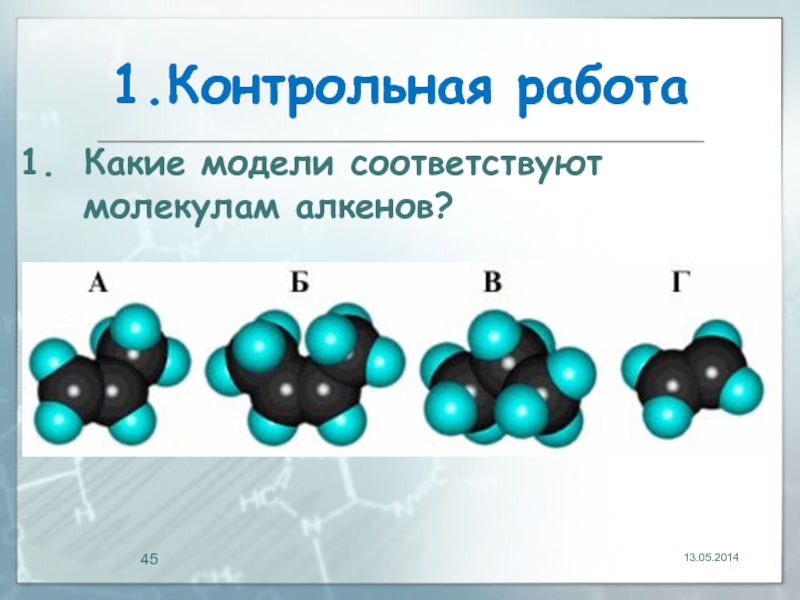
- 45. 1.Контрольная работа 13.05.2014 Какие модели соответствуют молекулам алкенов?
- 46. 2. Контрольная работа 13.05.2014 Дайте названия следующих
- 47. 3.Контрольная работа 13.05.2014 Назовите соединение:
- 48. 4. Контрольная работа 13.05.2014 Сколько изомерных алкенов
- 49. 5. Контрольная работа 13.05.2014 Двойная связь является
- 50. 6. Контрольная работа 13.05.2014 Какова гибридизация атомов
- 51. 7. Контрольная работа 13.05.2014 Наиболее характерными реакциями
Слайд 1Основы органической химии
Семинар-8. Углеводороды.Алкены
E-mail: irkrav66@gmail.com
лектор:
проф. Рохин Александр
Слайд 2Алкены
(этиленовые углеводороды, олефины) - непредельные алифатические углеводороды, молекулы которых
Общая формула ряда алкенов:
13.05.2014
Слайд 4Алкены
В отличие от предельных углеводородов, алкены содержат двойную связь С=С,
В образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии
13.05.2014
Слайд 5Строение С=С связи
Каждый из атомов имеет по три 2sp2-гибридных орбитали, направленных
13.05.2014
Слайд 6Строение С=С связи
Двойная связь является сочетанием σ- и π-связей (хотя она
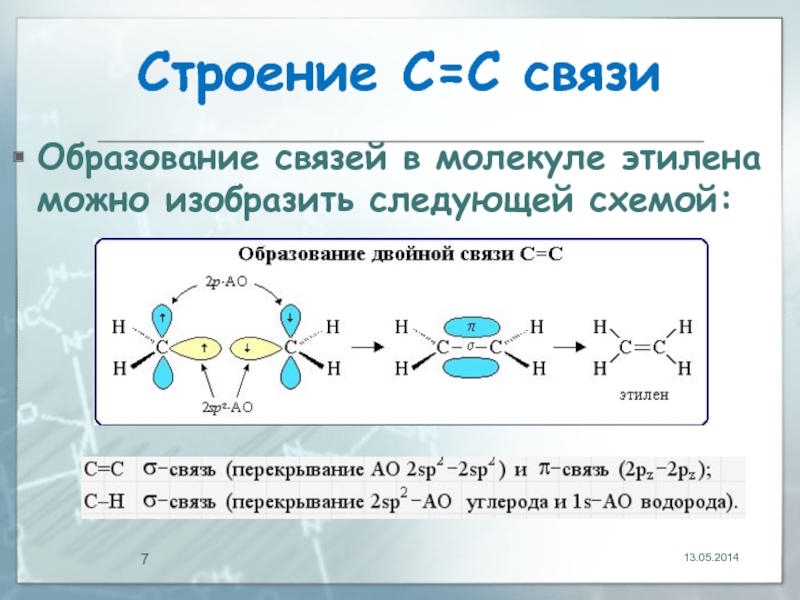
σ-Связь возникает при осевом перекрывании sp2-гибридных орбиталей,
π -связь – при боковом перекрывании р-орбиталей соседних sp2-гибридизованных атомов углерода.
13.05.2014
Слайд 7Строение С=С связи
Образование связей в молекуле этилена можно изобразить следующей схемой:
13.05.2014
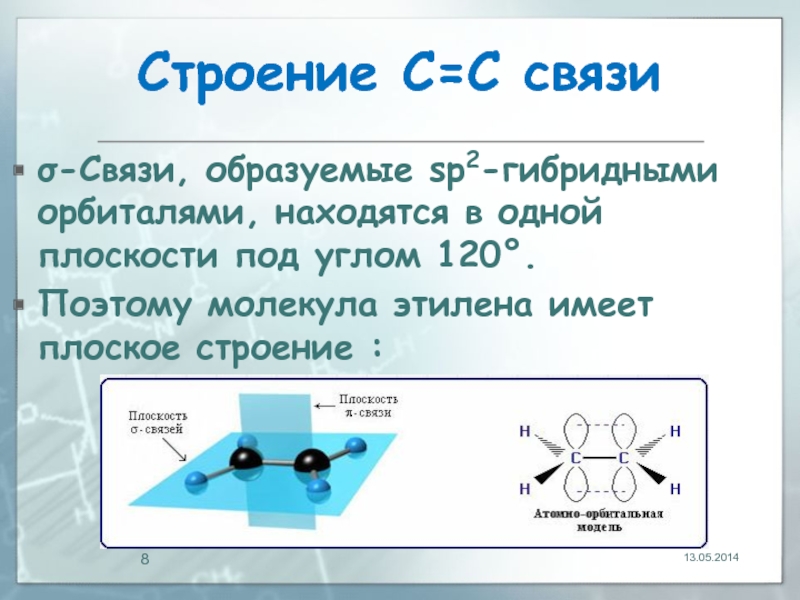
Слайд 8Строение С=С связи
σ-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под
Поэтому молекула этилена имеет плоское строение :
13.05.2014
Слайд 9Номенклатура алкенов
названия алкенов производят от названий соответствующих алканов (путем замены суффикса
2 атома С → этан → этен; 3 атома С →пропан → пропен
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь.
13.05.2014
Слайд 10Номенклатура алкенов
названия алкенов производят от названий соответствующих алканов (путем замены суффикса
2 атома С → этан → этен; 3 атома С →пропан → пропен
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь.
13.05.2014
Слайд 11Номенклатура алкенов
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца
Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен.
Например:
13.05.2014
Слайд 12Номенклатура алкенов
В номенклатуре различных классов органических соединений наиболее часто используются следующие
13.05.2014
Слайд 13Номенклатура алкенов
Назовите следующие алкены:
CH2=CH2
CH3—CH=CH2
CH3—CH3—CH=CH2
CH3—CH=CH—CH3
CH2=CH—CH=CH2
CH3—CH=CH2
|
13.05.2014
Слайд 15Структурная изомерия алкенов
13.05.2014
2. Изомерия положения двойной связи (начиная с С4Н8) :
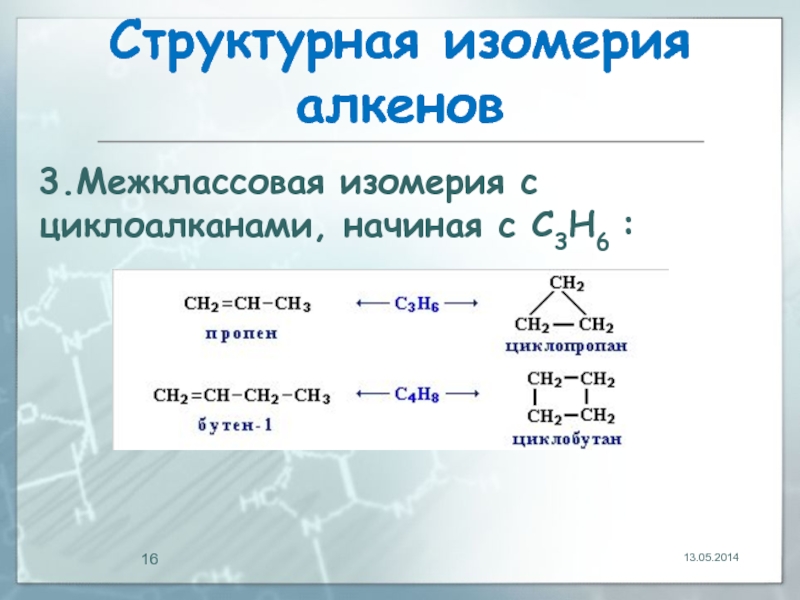
Слайд 16Структурная изомерия алкенов
13.05.2014
3.Межклассовая изомерия с циклоалканами, начиная с С3Н6 :
Слайд 17Пространственная изомерия алкенов
Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи
Но становится возможной цис-транс-изомерия:
13.05.2014
Слайд 18Пространственная изомерия алкенов
в молекуле СН3–СН=СН–СН3 группы СН3 могут находиться либо по
13.05.2014
Слайд 19Свойства алкенов
Физические свойства алкенов изменяются в гомологическом ряду:
от
начиная с С5Н10 – жидкости,
с С18Н36 – твердые вещества.
Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях
13.05.2014
Слайд 20Свойства алкенов
Химические свойства алкенов определяются строением и свойствами двойной
Алкены химически более активны, чем алканы.
13.05.2014
Слайд 22Гидрирование
(присоединение водорода)
Алкены взаимодействуют с водородом при нагревании в присутствии металлов
13.05.2014
Слайд 23Гидрирование
(присоединение водорода)
Присоединение водорода к атомам углерода в алкенах приводит к
Поэтому гидрирование алкенов относят к реакциям восстановления.
13.05.2014
Слайд 24Гидрирование
(присоединение водорода)
Эта реакция используется в промышленности для получения высокооктанового топлива:
13.05.2014
Слайд 25Галогенирование
(присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко в
Эти реакции протекают по механизму электрофильного присоединения
13.05.2014
Слайд 26Механизм электрофильного присоединения галогена к алкенам
Электрофильные ("любящие электроны") реагенты, это частицы
13.05.2014
Слайд 27Механизм электрофильного присоединения галогена к алкенам
Механизм присоединения протекает в три стадии:
Стадия
13.05.2014
Слайд 28Механизм электрофильного присоединения галогена к алкенам
Стадия 2 (лимитирующая): образование карбокатиона. Электрофил
На втором углеродном атоме, лишенном связывающих p-электронов, появляется положительный заряд:
13.05.2014
Слайд 29Механизм электрофильного присоединения галогена к алкенам
Стадия 3: взаимодействие карбокатиона с анионом
13.05.2014
Слайд 30Механизм электрофильного присоединения галогена к алкенам)
Изменение энергии на различных стадиях реакции:
13.05.2014
Слайд 31Гидрогалогенирование (присоединение галогеноводородов)
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом
Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X - галоген):
13.05.2014
Слайд 32Гидрогалогенирование (присоединение галогеноводородов)
Механизм реакции протекает в три стадии:
13.05.2014
Слайд 33Гидратация
(присоединение воды)
Гидратация происходит в присутствии минеральных кислот по механизму электрофильного
13.05.2014
Слайд 34Гидратация
(присоединение воды)
Реакция происходит в присутствии минеральных кислот (донора Н+) по
13.05.2014
Слайд 35Полимеризация алкенов
1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного
13.05.2014
Слайд 36Полимеризация алкенов
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в
13.05.2014
Слайд 37Полимеризация алкенов
2. Димеризация алкенов – образование димера в результате реакции присоединения.
В присутствии минеральной кислоты (донора протона Н+) происходит присоединение протона по двойной связи:
13.05.2014
Слайд 39Получение алкенов
II. Отщепление (элиминирование) двух атомов или групп атомов от
дегидратация
дегидрогалогенирование
13.05.2014
Слайд 40Получение алкенов
II. Отщепление :
дегидратация (при температуре менее 150°C в присутствии
13.05.2014
Слайд 41Получение алкенов
II. Отщепление :
Дегидрогалогенирование (Дегидрогалогенирование моногалогеналканов при действии спиртового раствора
13.05.2014
Слайд 42Применение алкенов
Алкены применяются в качестве исходных продуктов в производстве полимерных
13.05.2014
Слайд 43Применение алкенов
Этилен (этен) Н2С=СН2 используется для получения многих органических соединений.
13.05.2014
Слайд 44Применение алкенов
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука.
13.05.2014
Слайд 462. Контрольная работа
13.05.2014
Дайте названия следующих алкенов, полученных из алканов:
- пропан
- октан
- этан
- пентан
- гексан