- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углерод. Аллотропные модификации презентация
Содержание
- 1. Углерод. Аллотропные модификации
- 2. Положение в таблице Менделеева Углерод Carbogenium -
- 3. Нахождение в природе В настоящее время известно
- 4. Нахождение в природе Углерод занимает 17-е место
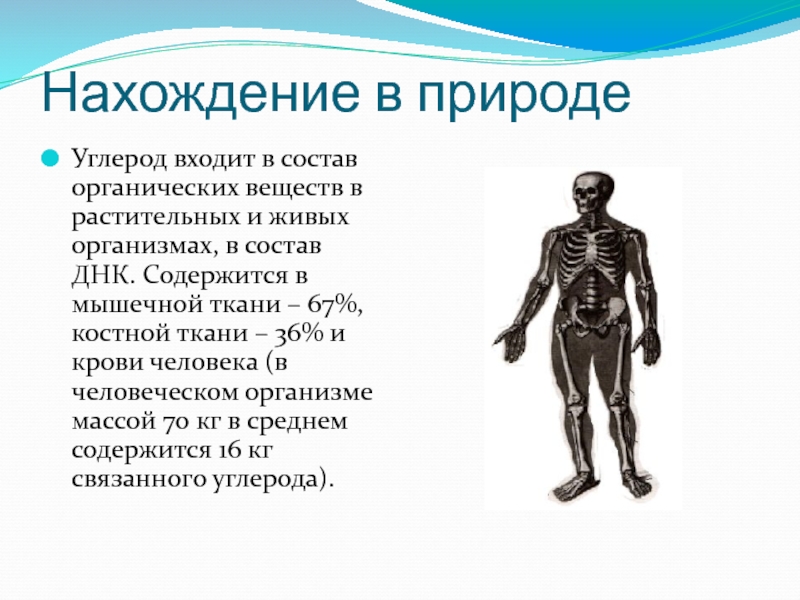
- 5. Нахождение в природе Углерод входит в состав
- 6. Свободный углерод В свободном виде углерод встречается
- 7. Алмаз
- 8. Графит
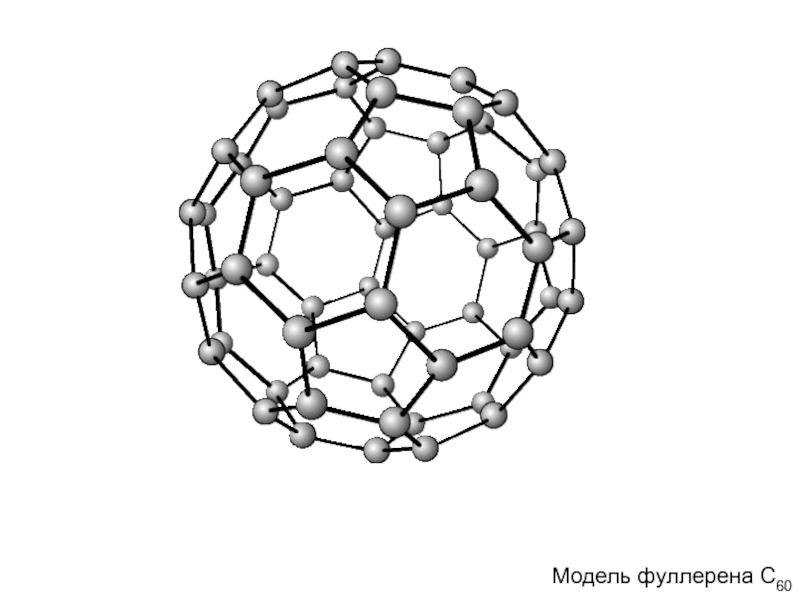
- 9. Модель фуллерена С60 Модель фуллерена С60
- 10. Все это - чистый углерод
- 11. Алмаз Алмаз – бесцветное, прозрачное, сильно преломляющее
- 12. Алмаз Плотность алмаза – 3,5 г/см3, tплав=3730С,
- 13. Алмаз Непрерывная трехмерная сетка ковалентных связей, которая
- 14. Графит Графит – устойчивая при нормальных условиях
- 15. Графит Атомы углерода в графите расположены отдельными
- 16. Графит Графит характеризуется меньшей плотностью и твердостью,
- 17. Карбин Карбин был получен в начале 60-х
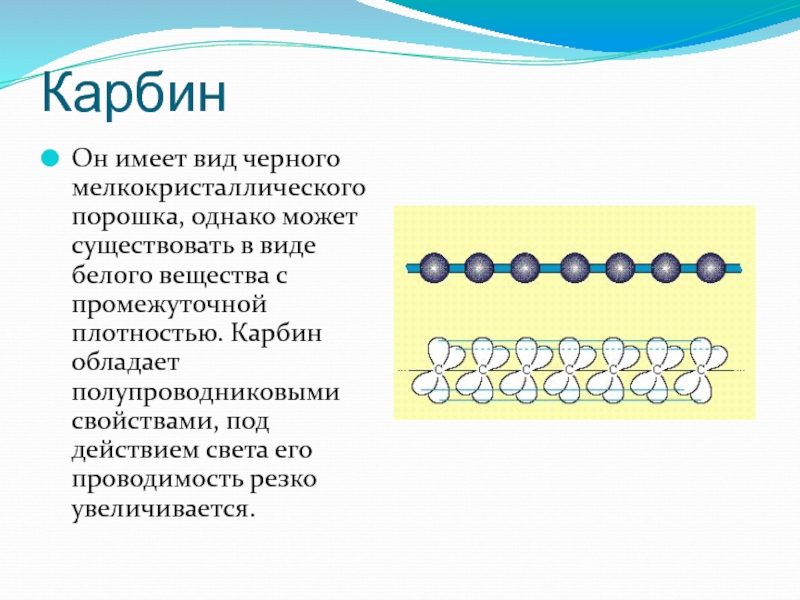
- 18. Карбин Он имеет вид черного мелкокристаллического порошка,
- 19. Карбин За счет существования различных типов связи
- 20. Другие формы углерода Известны и другие формы
- 21. Фуллерены Фуллерены – класс химических соединений, молекулы
- 22. Фуллерены Происхождение термина "фуллерен" связано с именем
- 23. Фуллерены В противоположность первым двум, графиту и
- 24. Нанотрубки Наряду со сфероидальными углеродными структурами, могут
- 25. Нанотрубки На рисунке представлена идеализированная модель однослойной
- 26. Наночастицы В процессе образования фуллеренов из графита
- 27. Графен Графе́н— двумерная аллотропная модификация углерода, образованная
- 28. Графен Основной из существующих в настоящее время
- 29. Конец
Слайд 2Положение в таблице Менделеева
Углерод Carbogenium - 6ой элемент в таблице Менделеева.
Слайд 3Нахождение в природе
В настоящее время известно более миллиона соединений углерода с
Слайд 4Нахождение в природе
Углерод занимает 17-е место по распространенности в земной коре
Слайд 5Нахождение в природе
Углерод входит в состав органических веществ в растительных и
Слайд 6Свободный углерод
В свободном виде углерод встречается в нескольких аллотропных модификациях –
Слайд 11Алмаз
Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех
Структура алмаза
Слайд 12Алмаз
Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС. Алмаз можно получить из
Слайд 13Алмаз
Непрерывная трехмерная сетка ковалентных связей, которая характеризуется большой прочностью, определяет многие
Знаменитый бриллиант «Кохинор»
Слайд 14Графит
Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный
Структура графита
Слайд 15Графит
Атомы углерода в графите расположены отдельными слоями, образованными из плоских шестиугольников.
Слайд 16Графит
Графит характеризуется меньшей плотностью и твердостью, а также графит может расщепляться
Графитовый электрод
Слайд 17Карбин
Карбин был получен в начале 60-х годов В.В. Коршаком, А.М. Сладковым,
Строение карбина
Слайд 18Карбин
Он имеет вид черного мелкокристаллического порошка, однако может существовать в виде
Слайд 19Карбин
За счет существования различных типов связи и разных способов укладки цепей
Метеорит содержащий вкрапления карбина
Слайд 20Другие формы углерода
Известны и другие формы углерода, такие как уголь, кокс
Сажа
Слайд 21Фуллерены
Фуллерены – класс химических соединений, молекулы которых состоят только из углерода,
Фуллерен С70
Слайд 22Фуллерены
Происхождение термина "фуллерен" связано с именем американского архитектора Ричарда Букминстера Фуллера,
Купол Фуллера
Слайд 23Фуллерены
В противоположность первым двум, графиту и алмазу, структура которых представляет собой
Модель фуллерена С60
Слайд 24Нанотрубки
Наряду со сфероидальными углеродными структурами, могут образовываться также и протяженные цилиндрические
Идеальная нанотрубка представляет собой свернутую в цилиндр графитовую плоскость, выложенную правильными шестиугольниками, в вершинах которых расположены атомы углерода.
Строение нанотрубки