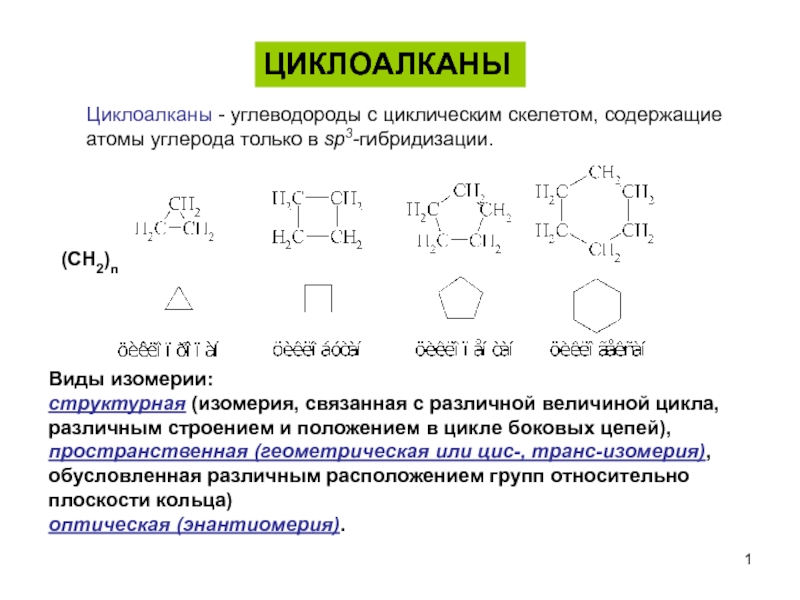
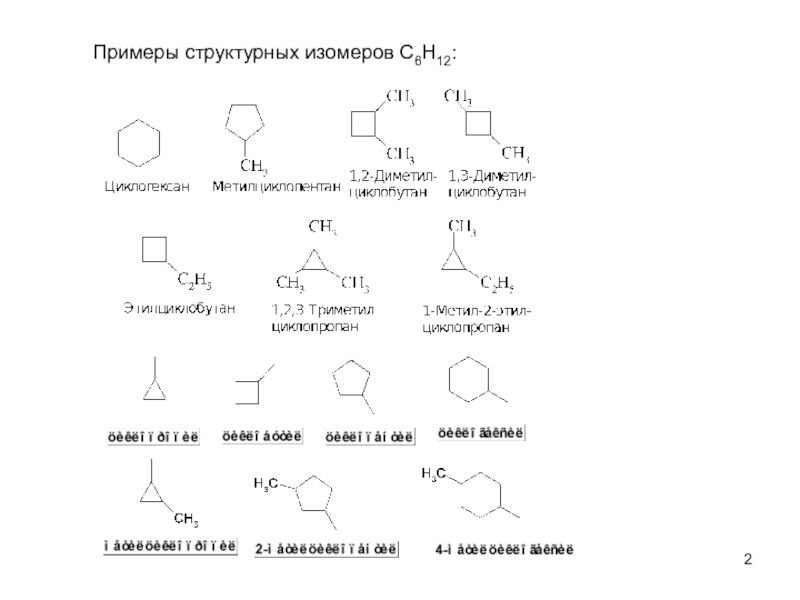
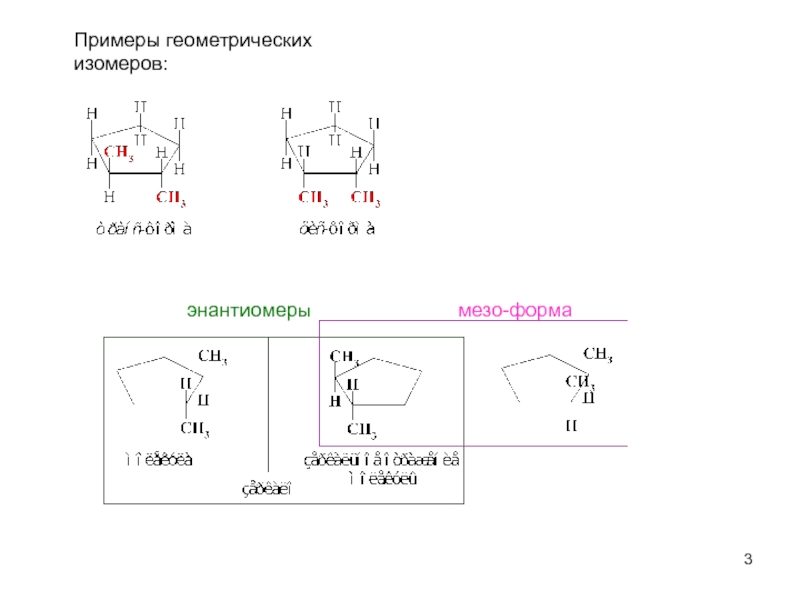
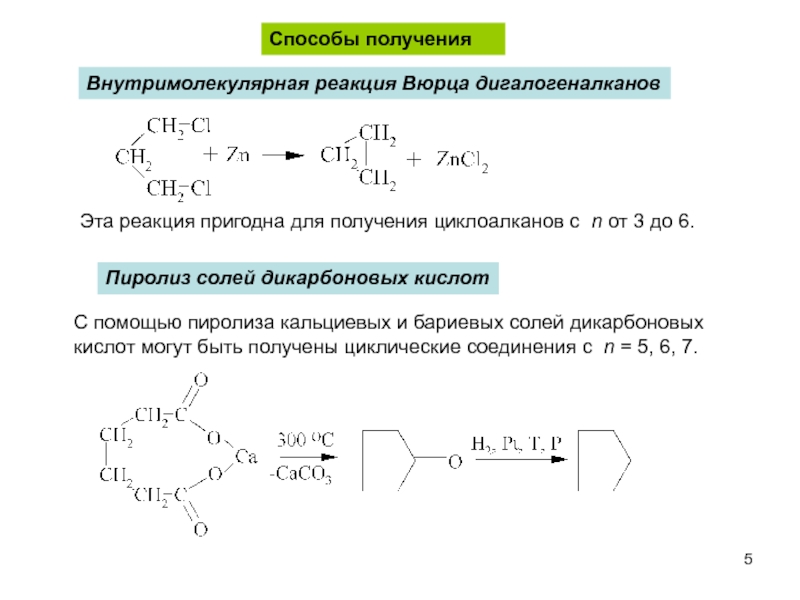
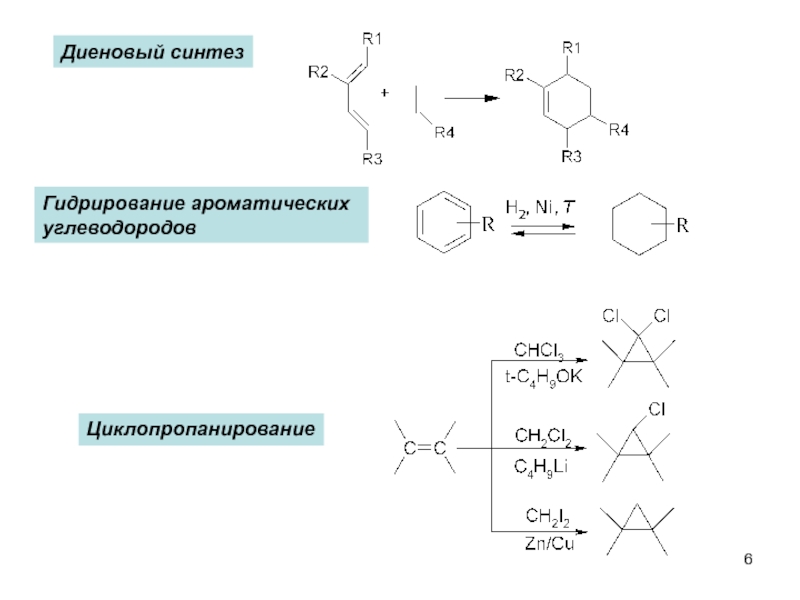
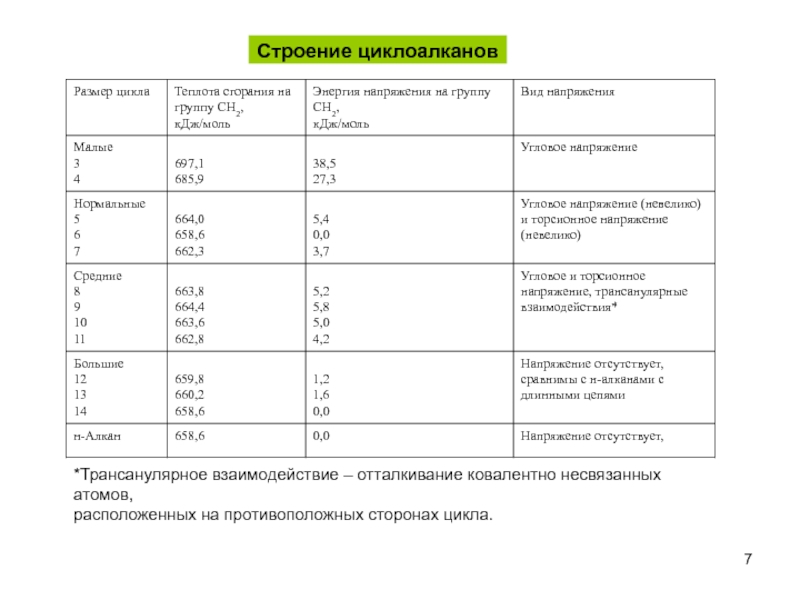
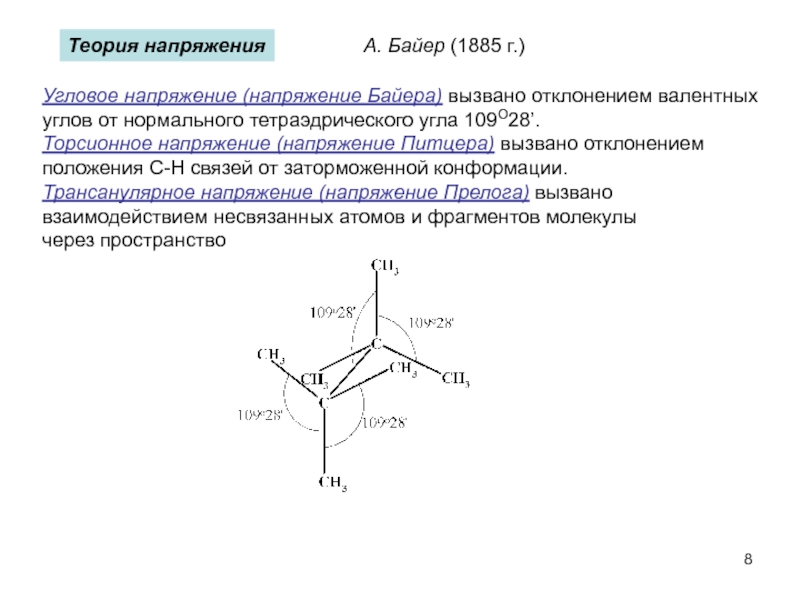
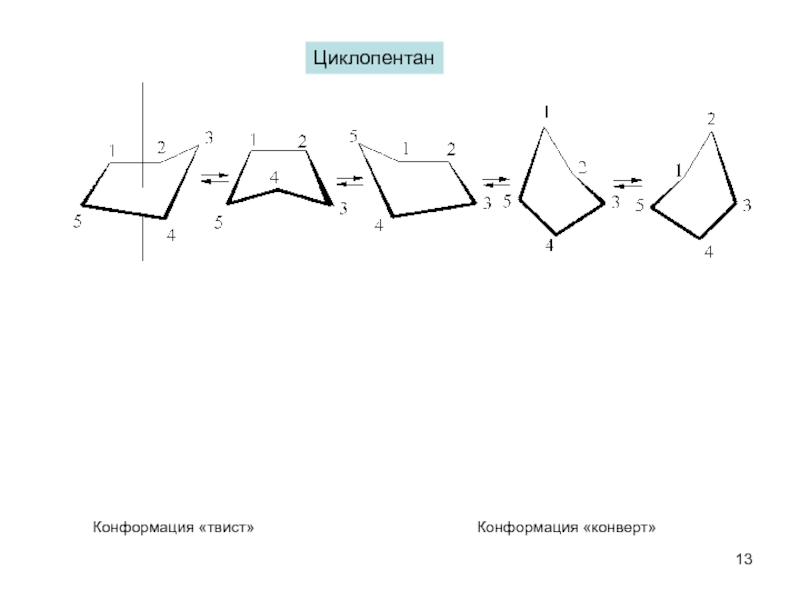
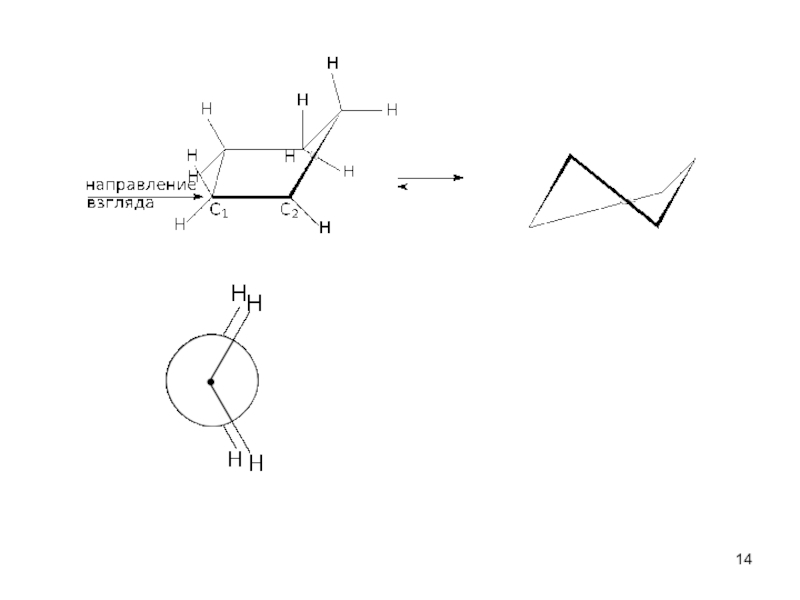
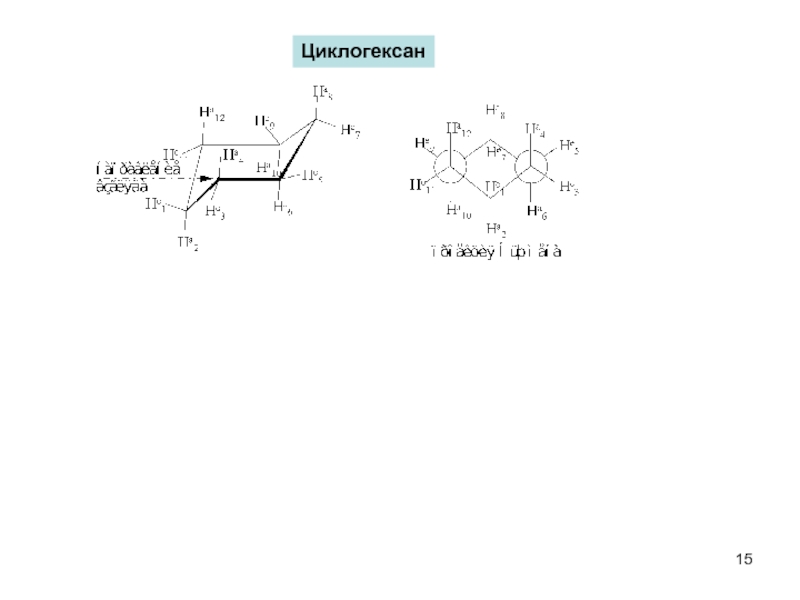
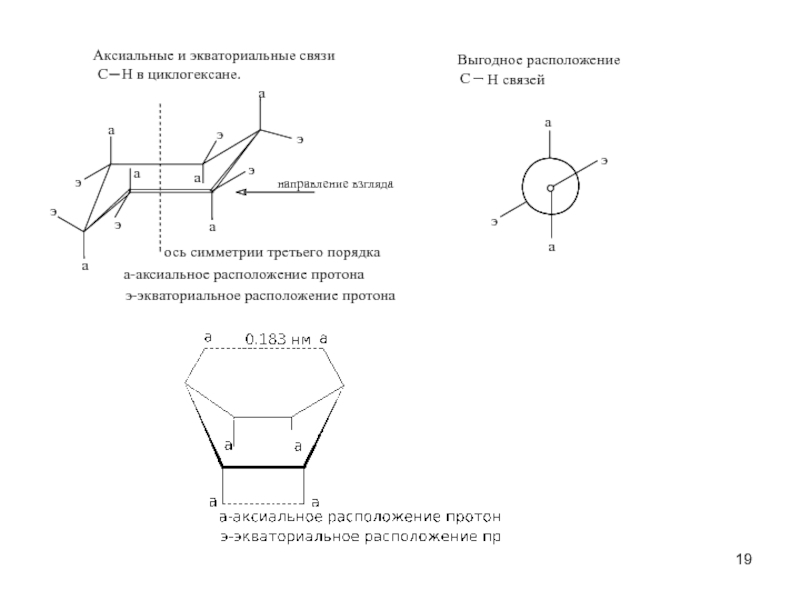
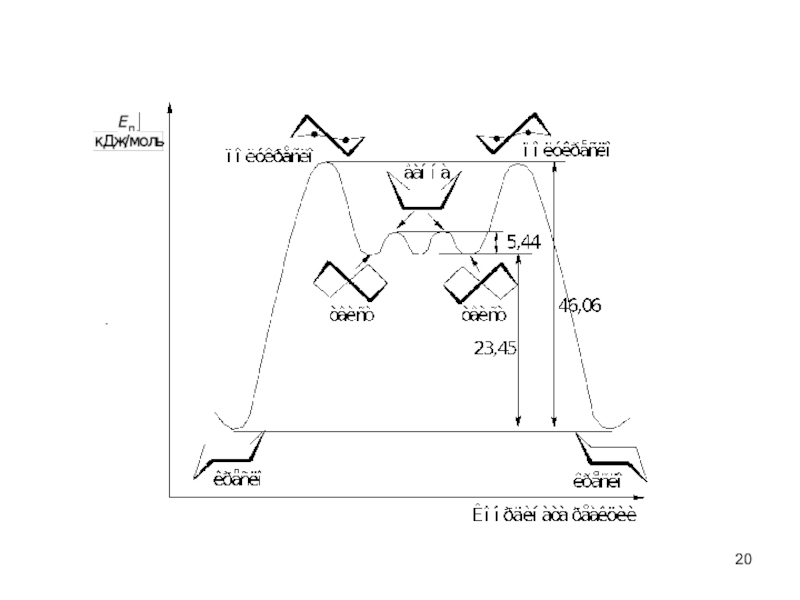
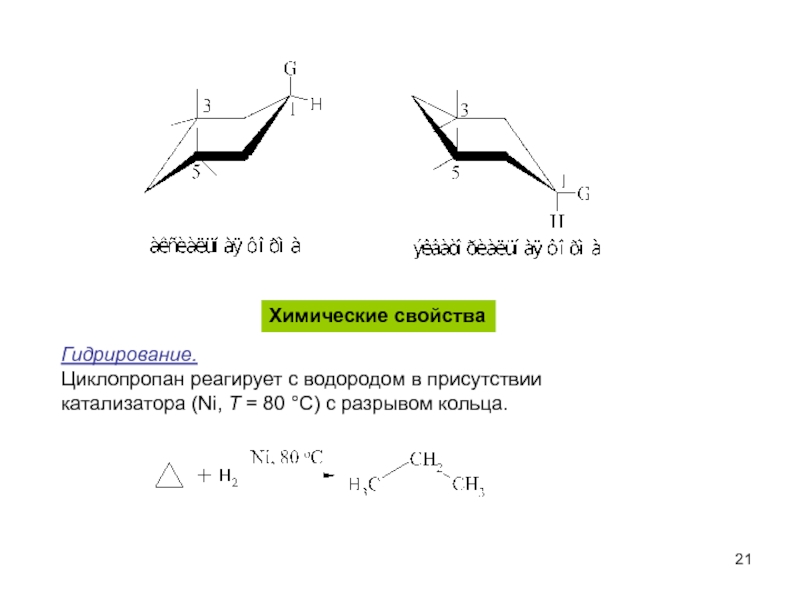
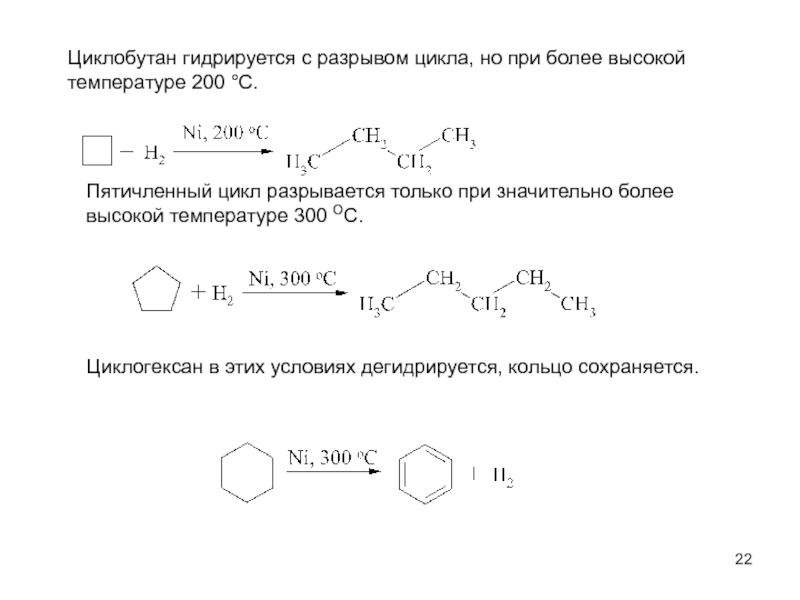
пространственная (геометрическая или цис-, транс-изомерия),
обусловленная различным расположением групп относительно плоскости кольца)
оптическая (энантиомерия).
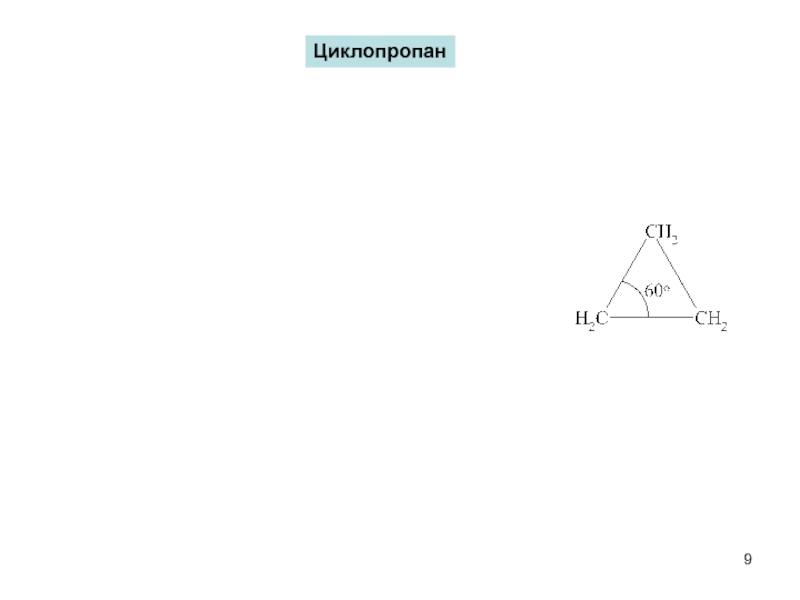
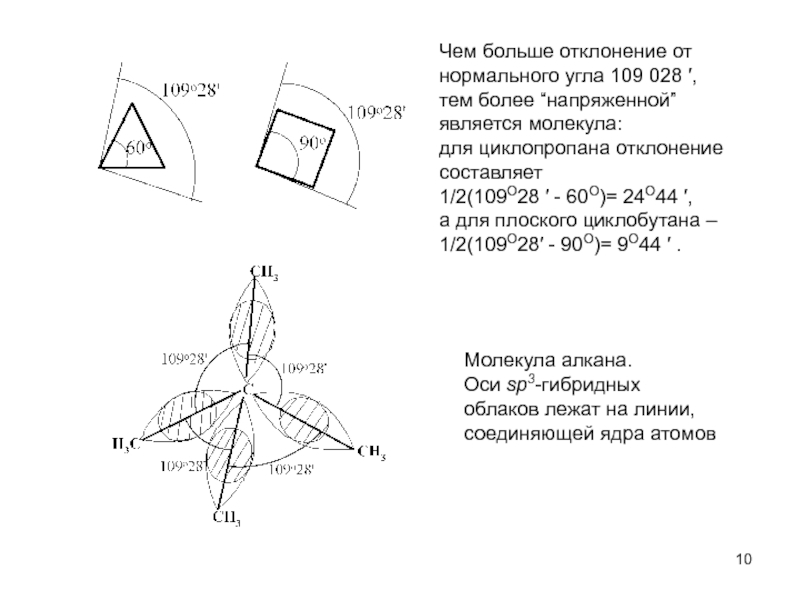
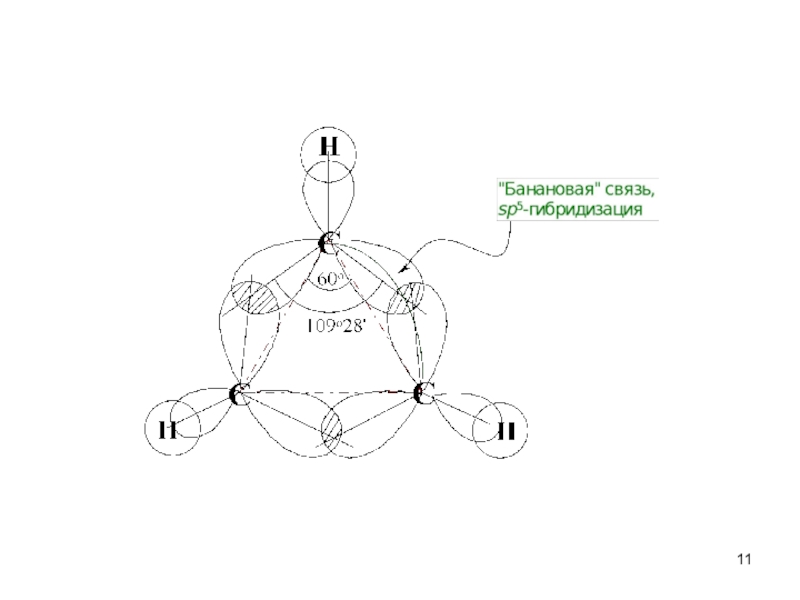
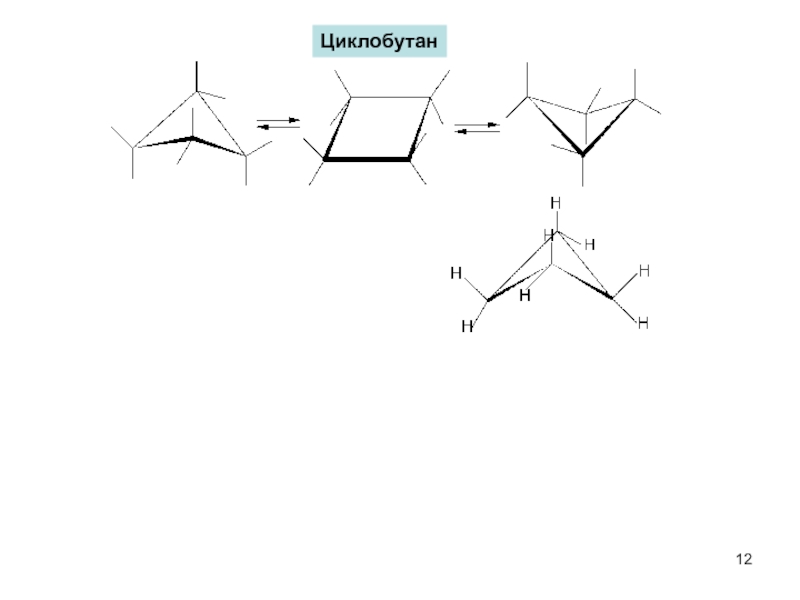
Циклоалканы - углеводороды с циклическим скелетом, содержащие
атомы углерода только в sp3-гибридизации.