Побочная подгруппа: подгруппа Sc + лантаноиды + актиниды
p d (f) f f f f f f
B
Al
Sc
Ga
Y
In
La Ce Pr Nd Pm Sm Eu
Gd Tb Dy Ho Er Tm Yb
Lu
Tl
Ac Th Pa U Np Pu Am
Cm Bk Cf Es Fm Md No
Lr
Особенности группы в целом:
самая элементоемкая группа (37 элементов);
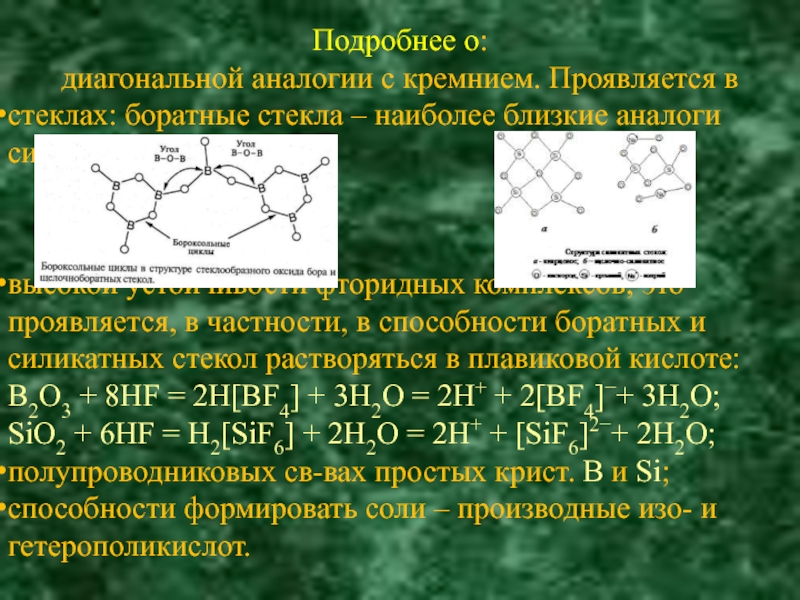
самая «аномальная группа»; «аномальные» элементы: B, Ga, Tl – в главной подгруппе,
Sc, Ce, Tb, Eu, Yb – в побочной. (Элементы, у которых заполнение электрона впервые происходит на новые оболочки: B, Sc, Ce)
Следствие «аномальностей»: аналогии – особенно в главной подгруппе проследить более сложно, чем в других подгруппах;