- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТИР применительно к кислотно-основным взаимодействиям презентация
Содержание
- 1. ТИР применительно к кислотно-основным взаимодействиям
- 2. Растворы могут быть водными и неводными. (H2O
- 3. Существуют водные и неводные растворители.
- 4. Все растворители делятся на протонные и апротонные.
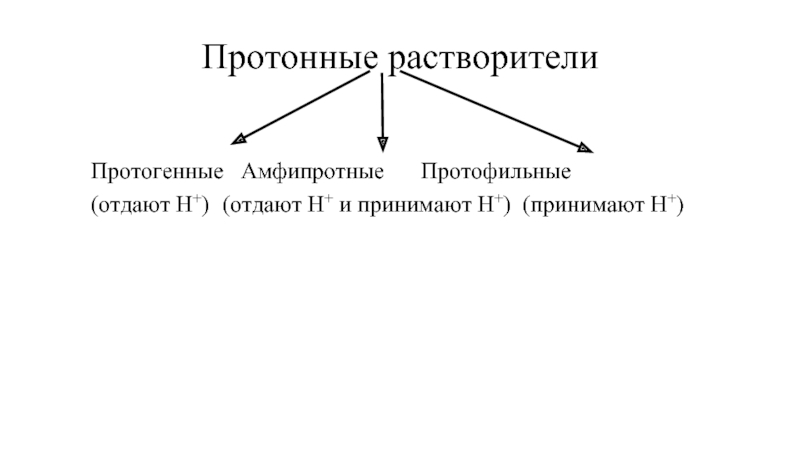
- 5. Протонные растворители Протогенные Амфипротные Протофильные (отдают Н+) (отдают Н+ и принимают Н+) (принимают Н+)
- 6. Автопротолиз Автопротолиз – это саморазложение (самораспад или
- 7. Примеры:
- 8. Кавт. = [S–] ∙ [H2S+], но
- 9. Правило. В любых растворах любых электролитов при
- 10. рН = рКавт – рS; рS = рКавт
- 11. Понятие нейтральности среды Среда нейтральная:
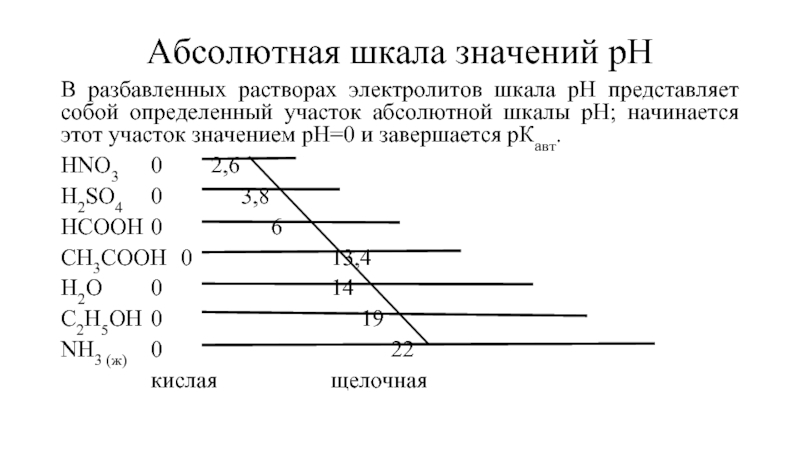
- 12. Абсолютная шкала значений рН В разбавленных
- 13. Понятие нейтральной, кислой и щелочной среды зависит
- 14. Шкала рН водных растворов электролитов
- 15. Расчет рН в чистых водных растворах кислот
- 16. Расчет рН в чистых водных растворах кислот
- 17. Расчет рН в чистых водных растворах кислот
- 18. Расчет рН в чистых водных растворах кислот
- 19. Расчет рН в чистых водных растворах кислот
- 20. Расчет рН в чистых водных растворах кислот
- 21. Расчет рН в чистых водных растворах оснований
- 22. Расчет рН в водных растворах, содержащих смеси
- 23. Расчетные формулы [H+] для смесей кислот: Смесь
- 25. Понятие активной и общей кислотности и щелочности
- 26. рН в растворах кислот или оснований в
- 27. рН в растворах кислот или оснований в
- 28. рН в растворах кислот или оснований в
- 29. рН в растворах кислот или оснований в
- 30. рН в растворах кислот или оснований в
- 31. рН в растворах кислот или оснований в
- 32. Задача. Имеется два раствора кислот с известными
- 33. При смешивании равных объемов растворов двух
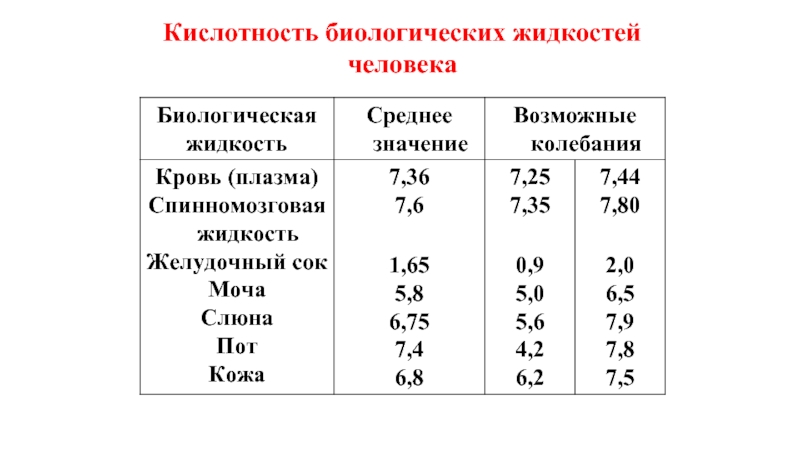
- 34. Кислотность биологических жидкостей человека
- 35. Для биологических жидкостей характерен кислотно-основной гомеостаз (постоянство значений рН), обусловленный действием биологических буферных систем.
- 36. Наиболее опасными видами нарушения кислотно-основного равновесия в
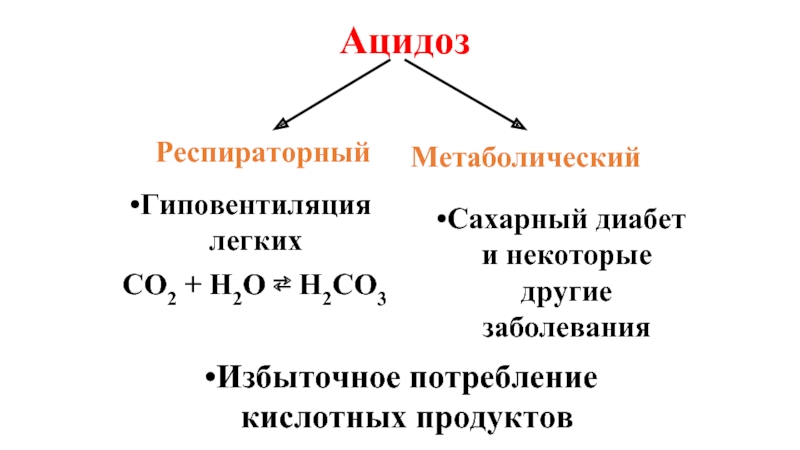
- 37. Ацидоз Респираторный Метаболический Гиповентиляция легких CO2 +
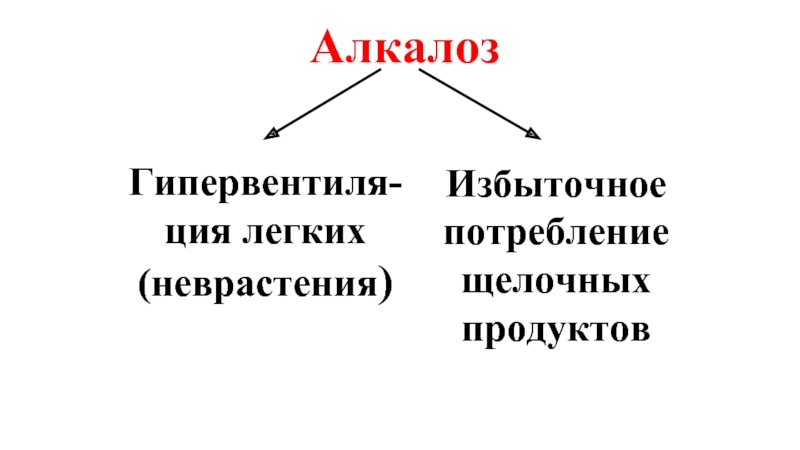
- 38. Алкалоз Гипервентиля-ция легких (неврастения) Избыточное потребление щелочных продуктов
- 39. Опасность изменения рН связана 1) со
- 40. 2) с изменением осмотического давления биологических жидкостей;
- 41. При изменении рН крови на 0,3 единицы
- 42. Коррекция ацидоза - внутривенное введение 4%-ного раствора
- 43. Коррекция алкалоза- внутривенное введение растворов аскорбиновой кислоты (5% или 15%).
- 44. Повышение кислотности в ротовой полости связано с
- 46. Основные положения теории кислот и оснований Бренстеда-Лоури
- 47. Основные положения теории кислот и оснований Бренстеда-Лоури
- 49. 5. Способность веществ быть кислотой или основанием
- 51. 7. Диссоциация кислот и оснований протекает
- 52. 8. Каждая кислота характеризуется константой
- 53. Основания: Численные значения констант основности Кв нулевых
- 54. 9. Расчет Ка, “+” кислот и Кв,
- 55. Для общего случая (т.е. в любых растворителях):
- 56. Правило: В любых растворах любых кислот и
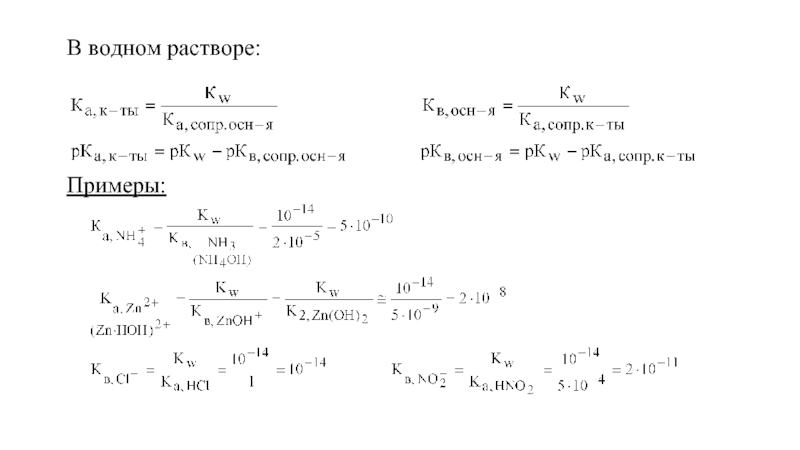
- 57. В водном растворе: Примеры:
- 58. Амфолиты характеризуются и Ка и Кв. Пример:
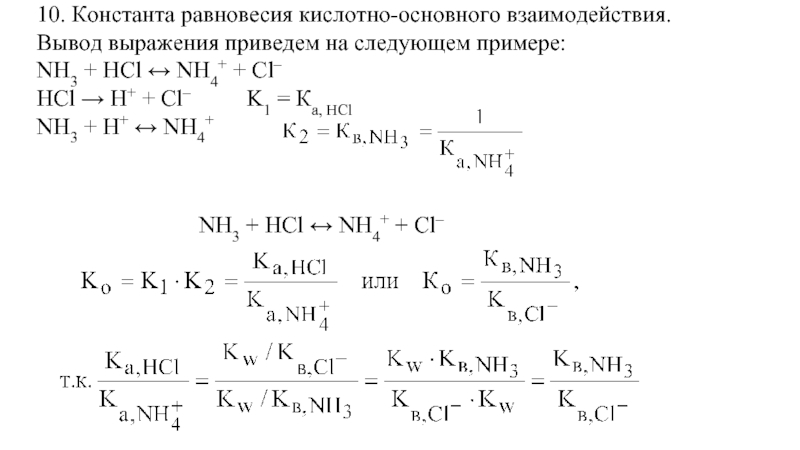
- 59. 10. Константа равновесия кислотно-основного взаимодействия. Вывод выражения
- 60. К равновесия – есть отношение Ка вступившей
- 61. Чтобы протекала кислотно-основная реакция необходимо, чтобы константа
- 62. Так как 5∙10–11>1,8∙10–16, поэтому HCO3– более
- 63. А вот NaHCO3 и C6H5COONa (бензоат натрия),
- 64. 6∙10–5 > 5∙10–10, поэтому реагируют C6H5COOH и NH3, значит реакция идет справа налево.
- 65. 3) NaHCO3 + NH4Cl ↔ H2CO3 +
Слайд 1ТИР применительно к кислотно-основным взаимодействиям
Автопротолиз. Шкала рН растворов электролитов
Понятие нейтральной, кислой
Слайд 2Растворы могут быть водными и неводными.
(H2O + K2SO4): водный раствор K2SO4
(C2H5OH + ФФ): спиртовый раствор фенолфталеина или раствор ФФ в этаноле.
(CHCl3 + Dit): хлороформный раствор дитизона или раствор дитизона в хлороформе.
(H2SO4 конц. + ДФА): сернокислый раствор дифениламина или раствор ДФА в серной кислоте.
Слайд 3Существуют водные и неводные растворители.
Неводные растворители – это вещества, которые
HCl к-та 37% не являются неводными растворителями
NH3 р-р 25%
H2SO4 конц. 100%
HNO3 конц. 100% неводные растворители
NH3 (ж. при t = -33о)
Слайд 4Все растворители делятся на протонные и апротонные.
Протонные растворители взаимодействуют с протоном
Апротонные растворители не взаимодействуют с Н+ (CCl4, CHCl3, C6H6).
Слайд 5Протонные растворители
Протогенные Амфипротные Протофильные
(отдают Н+) (отдают Н+ и принимают Н+) (принимают Н+)
Слайд 6Автопротолиз
Автопротолиз – это саморазложение (самораспад или самодиссоциация) растворителя, в результате которого
Слайд 8
Кавт. = [S–] ∙ [H2S+], но т.к. [H2S+] = [H+], поэтому
После логарифмирования с обратным знаком получаем:
рКавт. = рS + рН
Слайд 9Правило. В любых растворах любых электролитов при данной температуре произведение концентраций лиат-
Слайд 10рН = рКавт – рS; рS = рКавт – рН
Чем больше константа
Они могут принимать значения:
[H+], [S–]: ≠ 0; = 1; < 1; > 1.
рН, рS: 0; < 0; > 0.
Слайд 12Абсолютная шкала значений рН
В разбавленных растворах электролитов шкала рН представляет собой
HNO3 0 2,6
H2SO4 0 3,8
HCOOH 0 6
CH3COOH 0 13,4
H2O 0 14
C2H5OH 0 19
NH3 (ж) 0 22
кислая щелочная
Слайд 13Понятие нейтральной, кислой и щелочной среды зависит от природы растворителя. Одно
Примеры: рН (А) в H2SO4 конц. = 3 щелочная среда
рН (А) в HCOOH конц. = 3 нейтральная среда
рН (А) в NH3 (ж) = 3 кислая среда
При изменении природы растворителя меняются и такие характеристики электролитов как Кдисс., , Кнест.
Слайд 14Шкала рН водных растворов электролитов
0 1
сильно слабо нейтральная слабо сильно
кислая кислая щелочная щелочная
Слайд 15Расчет рН в чистых водных растворах кислот
Однопротонные HCl, HNO3, HI, HBr
HCl
а) Сисх: 10–7 – 10–3 моль/л; I = 0; f(H+) = 1; C(H+) = a(H+)
рН = -lg C(H+) = -lg Cкислоты
Пример:
СHCl = 10–5 рН = 10–5 = 5
Слайд 16Расчет рН в чистых водных растворах кислот
б) Сисх < 10–7 моль/л I
CHCl = 10–9 рН ≈ 7
в) Сисх > 10–3 моль/л; I > 0, f(H+) < 1, C(H+) > a(H+)
рН = -lg a(H+) = -lg f(H+) ∙ Cисх.
Сисх = 10–2 моль/л рН = -lg 10–2 ∙ f(H+) ≈ 2,05
Отн. погрешность 2,5%, если округлить до 2.
Сисх = 10–1 рН = 1,1.
Отн. погрешность 10%, если округлить до 1.
Слайд 17Расчет рН в чистых водных растворах кислот
2. Двухпротонные и многопротонные: H2SO4; H4[Fe(CN)6]
Расчет рН производят так же, как и в 1, т.к. сильные двух- и многопротонные кислоты являются сильными только по 1-й ступени; поэтому наибольший вклад в общую концентрацию Н+ вносит концентрация Н+, соответствующая 1-й ступени диссоциации.
Слайд 18Расчет рН в чистых водных растворах кислот
3. Кислоты слабые.
Однопротонные HF, HCN,
HF ↔ H+ + F– Кк; Кт < 1.
[H+] < Cисх.
[H+] = α ∙ Cисх., но α = f (Cисх.), т.е. для каждого конкретного случая необходимо знать значение α, соответствующее исходной концентрации.
Слайд 20Расчет рН в чистых водных растворах кислот
Двух- и многопротонные кислоты H2S,
Формулы расчета [H+] и рН аналогичны однопротонным кислотам,
но учитывается только К1.
Например:
Слайд 21Расчет рН в чистых водных растворах оснований
Основания: [OH–] рассчитывают по тем
рН = 14 – рОН
Слайд 22Расчет рН в водных растворах, содержащих смеси кислот или оснований
Расчет рН
Для кислот:
Для оснований:
Наибольший вклад в суммарную концентрацию или активность Н+ или ОН–-ионов вносят сильные или более сильные среди слабых кислоты или основания.
Слайд 23Расчетные формулы [H+] для смесей кислот:
Смесь сильных кислот: [H+] = С1+С2+…+Сn
Смесь
Смесь слабых кислот разной силы:[H+] = √Ка.С для более сильной кислоты (константы различаются более чем на порядок)
Смесь слабых кислот примерно равной силы (порядок констант одинаковый):
[H+] = √К1а.С1+ К2а.С2
(индексы 1 и 2 относятся к первой и второй кислоте соответственно)
Формулы для смесей оснований аналогичны с заменой [H+] на [ОH-] и Ка на Кb
Слайд 25Понятие активной и общей кислотности и щелочности
Активная кислотность или щелочность –
Общая кислотность или щелочность – это концентрация кислоты или смеси кислот, основания или смеси оснований в данном растворе. Эта концентрация может быть рассчитана по универсальной или упрощенным формулам расчета для концентраций Н+ или ОН–. Эти расчеты дают грубую оценку. Более точную оценку можно получить в результате титрования с визуальной или инструментальной индикацией.
Слайд 26рН в растворах кислот или оснований в присутствии одноименных и посторонних
Посторонние и одноименные ионы входят в состав солей, которые не вступают в химическую реакцию с кислотой или основанием. Эти соли не подвергаются или подвергаются гидролизу.
1. Сильная кислота (сильное основание) + соль (не гидролизуется, содержит одноименные или посторонние ионы).
Примеры:
HCl + NaCl NaOH + NaCl
HCl + KNO3 NaOH + KNO3
рН рассчитывают, учитывая присутствие в растворе только сильной кислоты или основания.
Слайд 27рН в растворах кислот или оснований в присутствии одноименных и посторонних
2. Сильная кислота (сильное основание) + соль (гидролизуется, содержит одноименные или посторонние ионы).
Примеры:
HCl + FeCl3 NaOH + CH3COONa
HCl + FeSO4 NaOH + HCOOK
Гидролиз солей в присутствии сильных кислот или сильных оснований протекает незначительно или подавляется, поэтому рН рассчитывают, учитывая присутствие в растворе только сильной кислоты или сильного основания, если их концентрация больше чем 10–7 моль/л.
Слайд 28рН в растворах кислот или оснований в присутствии одноименных и посторонних
3. Слабая кислота (слабое основание) + соль (не гидролизуется, содержит посторонние ионы).
Примеры:
CH3COOH + KCl NH4OH + KNO3
рН рассчитывают, учитывая присутствие в растворе только слабой кислоты или слабого основания.
Слайд 29рН в растворах кислот или оснований в присутствии одноименных и посторонних
4. Слабая кислота (слабое основание) + соль (гидролизуется, содержит одноименные ионы).
Примеры:
CH3COOH + CH3COONa NH4OH + NH4Cl
рН рассчитывают, учитывая наличие в растворе:
и слабой кислоты, и соли
и слабого основания, и соли.
Слайд 30рН в растворах кислот или оснований в присутствии одноименных и посторонних
Слабая кислота и слабое основание диссоциируют на ионы незначительно, т.е. в растворе имеется подвижное равновесие между молекулами кислоты или основания и их ионами. Соли как сильные электролиты диссоциируют полностью и увеличивают концентрацию одноименных ионов, а потому смещают равновесие в сторону молекул слабой кислоты или слабого основания. При этом уменьшается концентрация Н+-ионов кислоты и увеличивается значение рН в её растворе.
При этом уменьшается концентрация ОН–-ионов основания и уменьшается значение рН в его растворе.
Слайд 31рН в растворах кислот или оснований в присутствии одноименных и посторонних
Примеры:
CH3COOH ↔ CH3COO– + H+ уменьшается
CH3COONa → CH3COO– + Na+
NH4OH ↔ NH4+ + OH– уменьшается
NH4Cl → NH4+ + Cl–
Изменение значения рН в растворе слабой кислоты или слабого основания в присутствии одноименных ионов называется буферным эффектом.
рН в растворе слабой кислоты при этом увеличивается, а в растворе слабого основания – уменьшается.
Слайд 32Задача. Имеется два раствора кислот с известными значениями рН и одинаковыми
Решение: Поскольку HCl – сильная кислота, Co(HCl) = [H+] = 0,1 моль/л.
По условию задачи концентрации HCl и HA одинаковы, поэтому Co(HA) = 0,1 моль/л.
Для 0,1 М раствора НА известен рН = 3, т.е. [H+] = 10-3 моль/л. При таком значении [H+] можно не учитывать диссоциацию воды и принять [A-]=[H+]. Вычислив степень диссоциации α = [H+]/Cо(HA) = 10-2, можно сделать вывод, что НА – слабая кислота, а для слабых кислот можно использовать приближение [HA] = Co(HA). Далее можно вычислить значение: Kа(HA)=[H+][A-]/[HA]=10-3.10-3/10-1=10-5
Слайд 33
При смешивании равных объемов растворов двух кислот HCl и НА с
Ответ: рН = 1,3.
Слайд 35Для биологических жидкостей характерен кислотно-основной гомеостаз (постоянство значений рН), обусловленный действием
Слайд 36Наиболее опасными видами нарушения кислотно-основного равновесия в крови являются:
ацидоз –
алкалоз –увеличение щелочности крови.
Слайд 37Ацидоз
Респираторный
Метаболический
Гиповентиляция легких
CO2 + H2O ⇄ H2CO3
Сахарный диабет и некоторые другие заболевания
Избыточное
Слайд 39Опасность изменения рН связана
1) со снижением активности ферментов и гормонов, активных
Слайд 402) с изменением осмотического давления биологических жидкостей;
3) с изменением скорости биохимических
Слайд 41При изменении рН крови на 0,3 единицы может наступить тяжелое коматозное
Слайд 42Коррекция ацидоза - внутривенное введение 4%-ного раствора NaHCO3:
HCO3- + H+ ⇄
Антацидными (гипоцидными) называются лекарственные препараты, снижающие кислотность биологических жидкостей
Слайд 44Повышение кислотности в ротовой полости связано с приемом пищи (особенно сладкой).
Сa5(PO4)3F(т) ⇄ 5 Са2+ + 3 РО43- + F-
В норме равновесие смещено влево. При избыточной кислотности концентрация F- уменьшается: Н+ + F- ⇄ НF.
Равновесие смещается вправо.
Слайд 46Основные положения теории кислот и оснований Бренстеда-Лоури
Кислоты (диспротиды) – вещества, способные
Основания (эмпротиды) – вещества, способные принимать Н+ и превращаться в сопряженные кислоты.
Кислоты и основания могут быть электронейтральными, положительными и отрицательными.
Кислота и сопряженное основание или основание и сопряженная кислота представляют собой кислотно-основную сопряженную пару.
Слайд 47Основные положения теории кислот и оснований Бренстеда-Лоури
Примеры:
HCl ↔ H+ + Cl–
H2CO3
HCO3– ↔ H+ + CO32–
H2O ↔ H+ + OH–
H3O+ ↔ H+ + H2O
[Zn(H2O)2]2+ ↔ H+ + [ZnOH∙H2O]+
(ZnOH∙H2O)+ ↔ H+ + Zn(OH)2
C5H5NH+ ↔ H+ + C5H5N
пиридиний-ион пиридин
В сопряженных парах заряд кислоты всегда на единицу больше заряда основания или заряд основания всегда на единицу меньше заряда кислота.
H2CO3 / CO32– несопряженная пара
Слайд 495. Способность веществ быть кислотой или основанием является не абсолютной, а
Пример:
Слайд 50
При взаимодействии кислоты и основания образуются новая кислота и новое основание.
6.
Слайд 51
7. Диссоциация кислот и оснований протекает при непосредственном химическом участии растворителя.
При диссоциации кислот растворитель (вода Н2О) выполняет функцию основания. Диссоциация оснований:
При диссоциации оснований растворитель (вода (Н2О) выполняет функцию кислоты.
Слайд 52 8. Каждая кислота характеризуется константой кислотности Ка, а каждое
Кислоты: Численные значения констант кислотности Ка нулевых “0” и отрицательных “-“ кислот содержатся в справочнике.
Ка “0” кислоты – это единственная или первая ступенчатая константа электронейтральной кислоты (кислоты Аррениуса).
Например:
Ка “-“ кислоты – это соответствующая ступенчатая константа электронейтральной кислоты.
Константы кислотности положительных “+” кислот рассчитывают.
Слайд 53Основания:
Численные значения констант основности Кв нулевых “0” и
положительных “+” оснований
Кв “0” основания – это единственная или первая ступенчатая константа электронейтрального основания (основания Аррениуса).
Кв “+” основания – это соответствующая ступенчатая константа электронейтрального основания.
Например:
Константы основности отрицательных “-“ оснований рассчитывают.
Слайд 549. Расчет Ка, “+” кислот и Кв, “-“ оснований.
Вывод формулы расчета
Перемножим Ка и Кв:
после сокращения получаем:
Слайд 55Для общего случая (т.е. в любых растворителях):
или
Прологарифмируем с обратным знаком.
Если растворитель вода Н2О:
Слайд 56Правило:
В любых растворах любых кислот и оснований при данной температуре произведение
, а так же сумма их показателей – есть величины постоянные и равные соответственно константе автопротолиза Кавт и показателю константы автопротолиза (рКавт), численные значения которых зависят от природы растворителя, в котором содержится кислотно-основная пара.
Слайд 5910. Константа равновесия кислотно-основного взаимодействия.
Вывод выражения приведем на следующем примере:
NH3 +
HCl → H+ + Cl– K1 = Ка, HCl
NH3 + H+ ↔ NH4+
NH3 + HCl ↔ NH4+ + Cl–
Слайд 60К равновесия – есть отношение Ка вступившей в реакцию кислоты к
Кислоты и основания имеют общее название – протолиты.
Слайд 61Чтобы протекала кислотно-основная реакция необходимо, чтобы константа равновесия была бы больше
Пара с большим значением Ка содержит более сильную кислоту, а с меньшим значением Ка – более сильное основание. Другие составные части кислотно-основных пар являются продуктами взаимодействия.
Слайд 62
Так как 5∙10–11>1,8∙10–16, поэтому HCO3– более сильная кислота, а OH– -
Слайд 63А вот NaHCO3 и C6H5COONa (бензоат натрия), а также NH4Cl и
6∙10–5 > 5∙10–11, поэтому реагируют C6H5COOH и CO32–, а HCO3– и C6H5COO– - продукты реакции. Значит реакция идет справа налево.
Слайд 653) NaHCO3 + NH4Cl ↔ H2CO3 + NH3 + NaCl или
Протон Н+ уходит от NH4+, а не от HCO3–, потому что NH4+ более сильная кислота, чем HCO3–, т.к.
В результате сравнения значений Ка кислотно-основных сопряженных пар H2CO3 / HCO3– Ка = 5∙10–7
NH4+ / NH3 Ka = 5∙10–10
приходим к выводу, что реакция может протекать между H2CO3 и NH3, но не между NH4+ и HCO3–. Значит NH4Cl и NaHCO3 совместимы. Эти вещества NaHCO3, C6H5COONa, NH4Cl входят в состав микстуры от кашля, они химически друг с другом не взаимодействуют (это мы доказали расчетами), а потому каждое из них не изменяет лечебного действия.






![Кавт. = [S–] ∙ [H2S+], но т.к. [H2S+] = [H+], поэтому Kавт. = [S–] ∙](/img/tmb/1/55681/c50309510089b8a474a513b9ce88ff83-800x.jpg)







![Расчет рН в чистых водных растворах кислот2. Двухпротонные и многопротонные: H2SO4; H4[Fe(CN)6] Расчет рН производят так](/img/tmb/1/55681/712bbefab57c6078fd6f40734f633a1c-800x.jpg)



![Расчет рН в чистых водных растворах основанийОснования: [OH–] рассчитывают по тем же формулам, что и](/img/tmb/1/55681/678d67f6dcf5c5fb12a9189c9e741bc0-800x.jpg)

![Расчетные формулы [H+] для смесей кислот:Смесь сильных кислот: [H+] = С1+С2+…+СnСмесь сильной и слабой кислоты:](/img/tmb/1/55681/3aa41850afe80627168c767cb5f5af37-800x.jpg)