- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Типы химических связей презентация
Содержание
- 1. Типы химических связей
- 2. Задачи: познакомиться с типами химических связей ;
- 3. Что такое химическая связь? Химическая связь
- 4. Различают четыре типа химических связей:
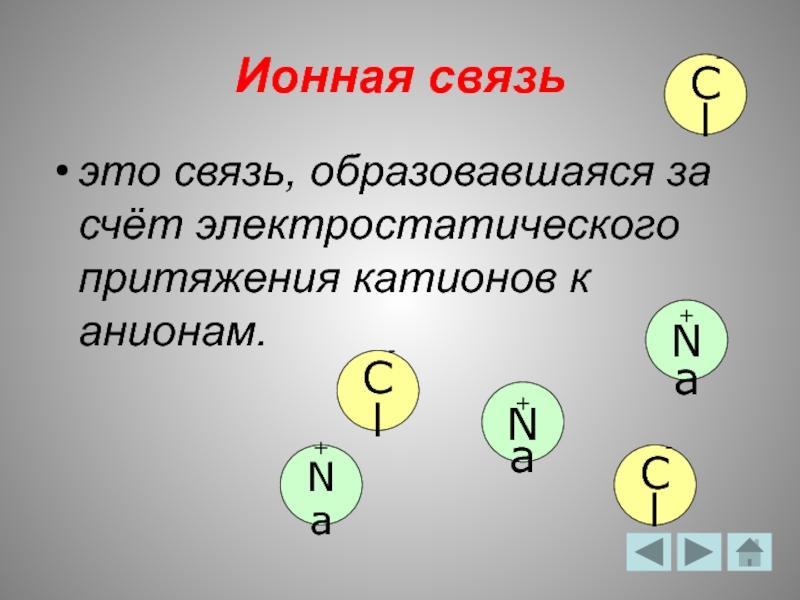
- 5. Ионная связь это связь, образовавшаяся за счёт
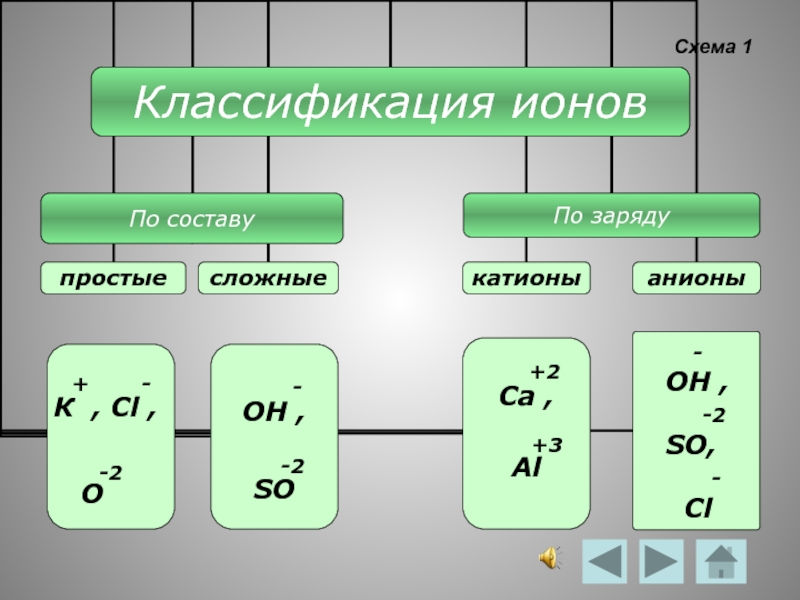
- 6. Схема 1 - ОН ,
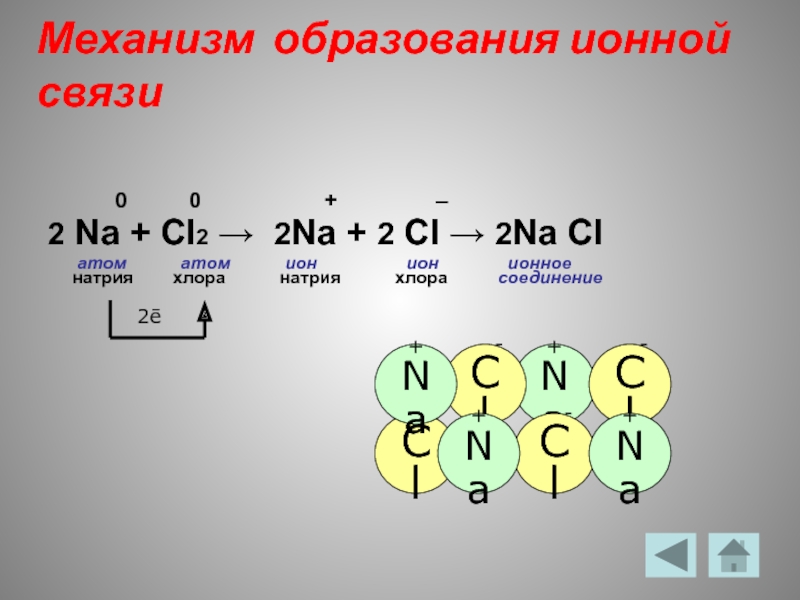
- 7. Механизм образования ионной связи
- 8. Ковалентная связь это связь, возникает между атомами
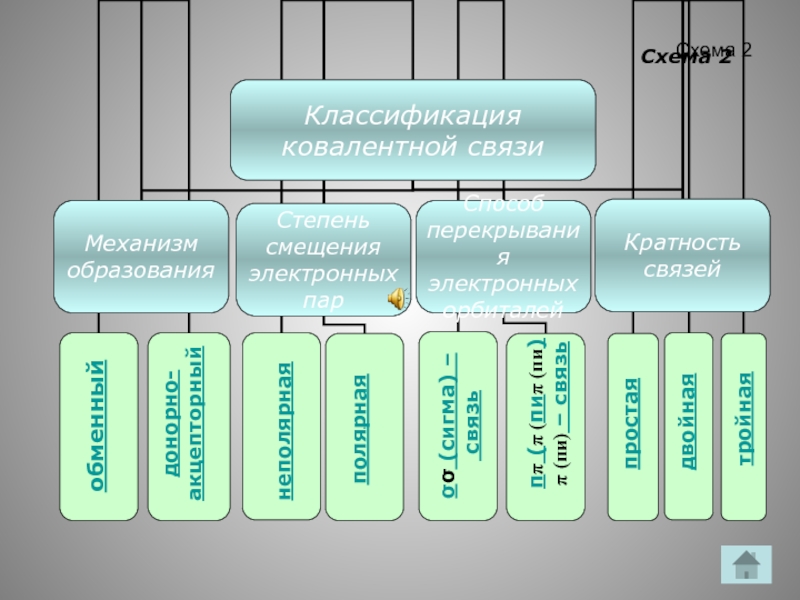
- 9. Схема 2 обменный донорно- акцепторный полярная
- 10. Обменный механизм образования ковалентной связи ☼
- 11. Донорно-акцепторный механизм образования ковалентной связи
- 12. Степень смещения электронных пар ☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ
- 13. Кратность ковалентной связи ☼Зависит от числа общих
- 14. Перекрывание электронных орбиталей. σ – связь. это
- 15. Перекрывание электронных орбиталей. π – связь.
- 16. Металлическая связь это связь, которую осуществляют относительно
- 17. Механизм образования металлической связи:
- 18. Водородная связь Межмолекулярная водородная связь – это
- 19. Водородная связь Внутримолекулярная водородная связь –
Слайд 2Задачи:
познакомиться с типами химических связей ;
научиться определять по молекулярной формуле соединения
научиться составлять механизм образования химической связи.
Слайд 3Что такое химическая связь?
Химическая связь - это взаимодействие атомов, которое связывает
Слайд 4Различают четыре типа химических связей:
Ионная связь.
Ковалентная связь.
Металлическая связь.
Слайд 5Ионная связь
это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
+
Na
-
Cl
+
Na
-
Cl
+
Na
-
Cl
Слайд 7Механизм образования ионной связи
0 0 + –
2 Na + Cl2 → 2Na + 2 Cl → 2Na Cl
атом атом ион ион ионное
натрия хлора натрия хлора соединение
2ē
+
Na
-
Cl
-
Cl
-
Cl
-
Cl
+
Na
+
Na
+
Na
Слайд 8Ковалентная связь
это связь, возникает между атомами за счёт образования общих электронных
ē
ē
ē
ē
ē
ē
Слайд 9Схема 2
обменный
донорно-
акцепторный
полярная
неполярная
σσ (сигма) –
связь
ππ (π (пиπ (пи)π (пи) – связь
простая
двойная
тройная
Схема
Слайд 10Обменный механизм образования ковалентной связи
☼ Действует, когда атомы образуют общие
Например:
Н2 – водород Н• + •Н → Н ׃ Н или Н - Н ;
НCl – хлороводород или соляная кислота
Н• + • Cl → Н Cl или H – Cl ;
3. N2 – азот N • + • N → N N или N N.
••
••
••
••
••
••
••
••
••
•••
•
•
•
•
•••
••
••
ІІІ
Слайд 11Донорно-акцепторный механизм образования ковалентной связи
☼ Действует между
Донор – вещество, у которого имеется свободная электронная
пара.
Акцептор – вещество, у которого имеется свободная орбиталь.
Аммиак Соляная Ион аммония
кислота
(донор) (акцептор)
Н
Н
N
H
..
-
-
І
+
H Cl
□
→
+
[ ]
-
-
-
H
H
H
H
N
••
+
Cl
–
–
Слайд 12Степень смещения электронных пар
☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов.
Ряд электроотрицательности: F, O,
НЕПОЛЯРНАЯ ковалентная связь – это связь, образованная
между атомами с одинаковой электроотрицательностью.
Например : H – H; Cl – Cl; N N.
ПОЛЯРНАЯ ковалентная связь – это связь, образованная между
атомами с разной электроотрицательностью.
Например: H – Cl; H – S – H.
ІІІ
Слайд 13Кратность ковалентной связи
☼Зависит от числа общих электронных пар, связывающих атомы.
Бывает:
ПРОСТАЯ
ДВОЙНАЯ « » - это одна σ-связь и одна
π-связь;
3. ТРОЙНАЯ « » - это одна σ-связь и две
π- связи.
ІІ
ІІІ
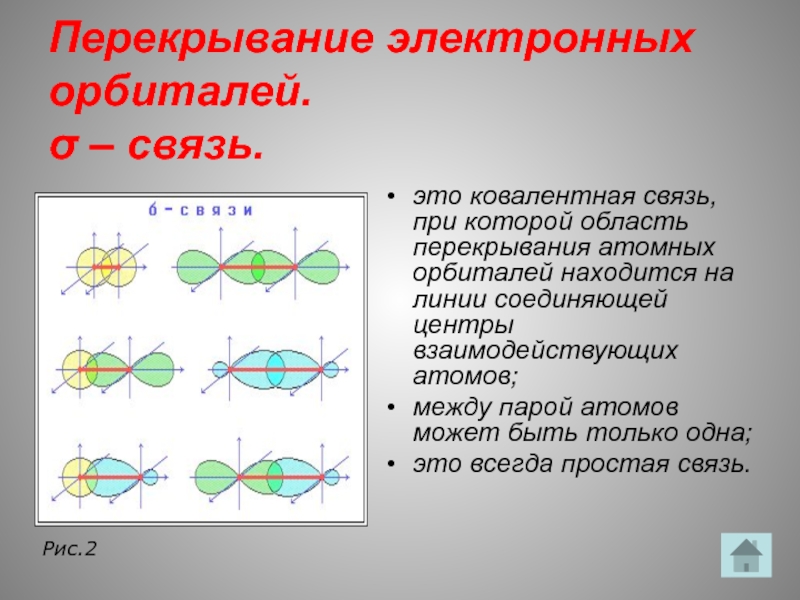
Слайд 14Перекрывание электронных орбиталей.
σ – связь.
это ковалентная связь, при которой область перекрывания
между парой атомов может быть только одна;
это всегда простая связь.
Рис.2
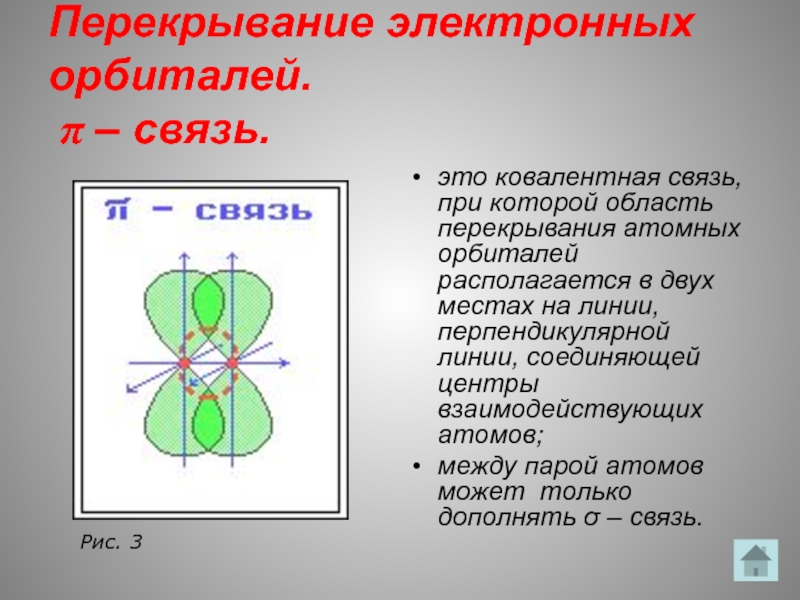
Слайд 15Перекрывание электронных орбиталей.
π – связь.
это ковалентная связь, при которой область
между парой атомов может только дополнять σ – связь.
Рис. 3
Слайд 16Металлическая связь
это связь, которую осуществляют относительно свободные электроны между ионами металлов
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
-
-
-
-
-
-
-
-
-
-
Слайд 17Механизм
образования металлической связи:
М - nē = М
Например:
для элементов (металлов) Ι группы главной
0 1+
подгруппы М - 1ē = М ;
для элементов (металлов) Ι Ι группы главной
0 2+
подгруппы М - 2ē = М .
Слайд 18Водородная связь
Межмолекулярная водородная связь – это
связь между атомами водорода одной
молекулы и
элементами(O, N, F) другой молекулы.
Н О - - - - Н О Н Н
Н Н - - - - О Н - - - - О Н
|
|
|
|
|
|
|
|
Слайд 19Водородная связь
Внутримолекулярная водородная связь –
эта связь возможна при наличии в
молекуле и электроноакцепторной
группы и электронодонорного атома.
Например в молекуле
ДНК: І І
А-Т
Г-Ц
Г-Ц
Т-А
І І
где аденин (А), гуанин (Г), тимин (Т) и цитозин (Ц) - азотистые основания