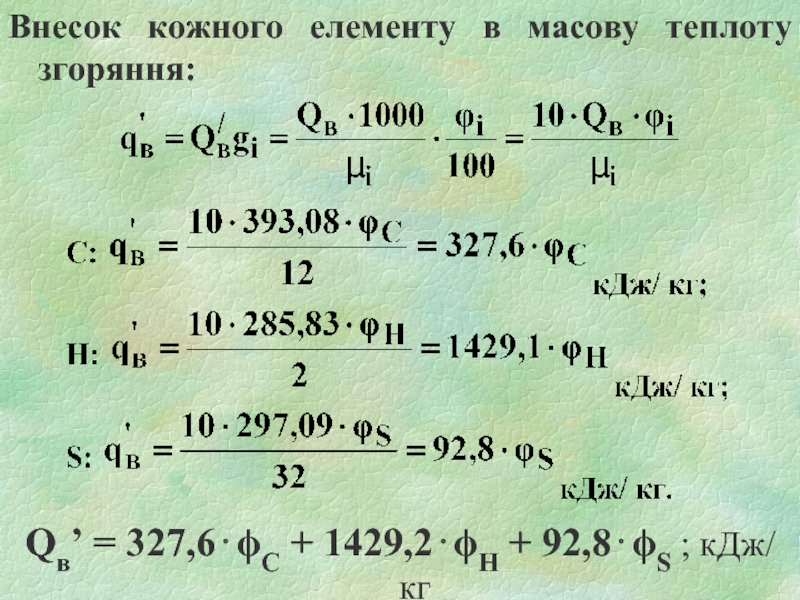Лекція 5
ТЕПЛОТА ЗГОРЯННЯ.
ТЕМПЕРАТУРА ГОРІННЯ.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теплота згоряння. Температура горіння презентация
Содержание
- 1. Теплота згоряння. Температура горіння
- 2. План лекції 1. Тепловий ефект хімічної реакції.
- 3. 1. ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект
- 4. Якщо Eкін 0, реакція супроводжу-ється виділенням тепла
- 5. Стандартна теплота реакції - різниця між стандартними
- 6. 2. ТЕПЛОТА ЗГОРЯННЯ Теплота згоряння - кількість
- 7. 2.1. Види теплоти згоряння Залежно від того,
- 8. Залежно від агрегатного стану Н2О, яка утворилася
- 10. При урахуванні хімічного недопалу, вологості матеріалу, втрати
- 11. 2.2. Розрахунок теплоти згоряння Горюча речовина індивідуального
- 12. Горючі матеріали складного хімічного складу суміш газів
- 13. Внесок кожного елементу в масову теплоту згоряння:
- 14. ФОРМУЛА МЕНДЄЛЄЄВА Враховує наявність в ГР оксигену,
- 15. ПРАКТИЧНЕ ЗНАЧЕННЯ ТЕПЛОТИ ЗГОРЯННЯ 1) Використовують для
- 16. 2) Використовують для визначення горючості речовини.
- 17. 3. ПОНЯТТЯ ТА ВИДИ ТЕМПЕРАТУРИ ГОРІННЯ
- 18. Калориметрична температура горіння - температура, до якої
- 19. Через відсутність тепловтрат і недопалу вважаємо, що
- 20. Якщо горіння відбувається за P=const, Qр=-ΔH.
- 21. Якщо Тгор достатньо висока, то ПГ можуть
- 22. αп=1 Qнед = Qтвт = 0 QнагрПГ= Qн-Qдис
- 23. Адіабатична температура горіння - температура, до якої
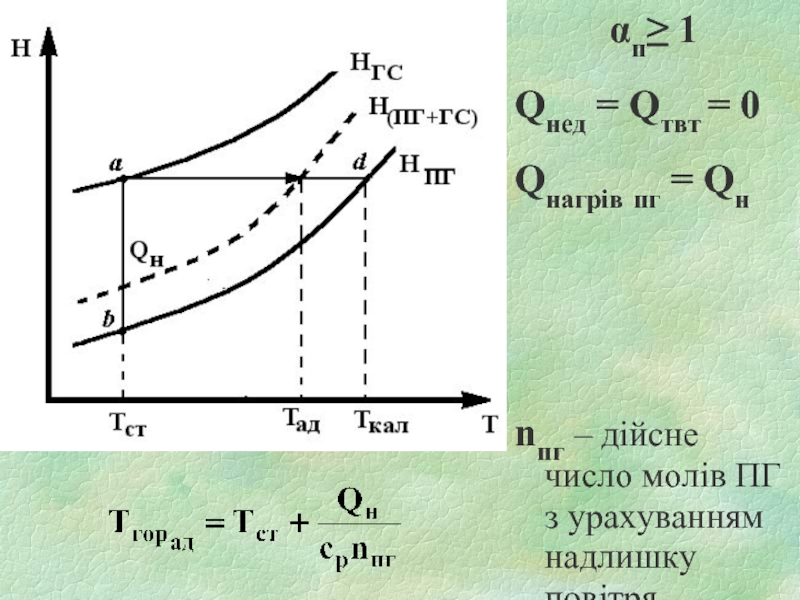
- 24. αп≥ 1 Qнед = Qтвт = 0
- 25. Дійсна температура горіння – температура, до якої
- 26. де Qнедоп - кількість тепла, яка не
- 27. Фактори, що впливають на Тгор: 1.
- 28. Завдання на самопідготовку 1. Вивчити матеріал Демидов,
Слайд 1ТЕМА 2 МАТЕРІАЛЬНИЙ І ТЕПЛОВИЙ БАЛАНС ПРОЦЕСУ
ГОРІННЯ
Слайд 2План лекції
1. Тепловий ефект хімічної реакції.
2. Теплота згоряння. Види теплоти
згоряння. Розрахункове визначення теплоти згоряння
3. Поняття та види температури горіння речовин.
4. Визначення температури горіння речовин та матеріалів.
3. Поняття та види температури горіння речовин.
4. Визначення температури горіння речовин та матеріалів.
Слайд 31. ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ
Тепловий ефект реакції - кількість теплоти, що
виділяється чи поглинається системою при протіканні в ній необоротної хімічної реакції за умови сталості температури й об’єму (Т, V = const) чи температури і тиску (Т, P = const).
Хімічна енергія перетворюється в теплову. Початковий і кінцевий рівні енергії системи різняться між собою на величину теплоти реакції Q.
Eкін – Eпоч = Q
Хімічна енергія перетворюється в теплову. Початковий і кінцевий рівні енергії системи різняться між собою на величину теплоти реакції Q.
Eкін – Eпоч = Q
Слайд 4Якщо Eкін 0, реакція супроводжу-ється виділенням тепла
і зветься екзотермічною.
Якщо Eкін >Eпоч, то Q < 0, реакція супроводжу-ється поглинанням тепла і зветься ендотермічною
Для визначення теплоти реакції застосовують перший закон термодинаміки:
- dQ = dU + PdV = dH – VdP
Якщо горіння відбувається при P =const (dP=0), теплота реакції дорівнює різниці повних ентальпій системи в початковому і кінцевому стані:
Qр = - ∫dH = - ΔH
Якщо горіння відбувається при V =const (dV=0), теплота реакції дорівнює різниці між внутрішньою енергією системи в початковому і кінцевому стані:
Qv = - ∫dU = - ΔU
Якщо Eкін >Eпоч, то Q < 0, реакція супроводжу-ється поглинанням тепла і зветься ендотермічною
Для визначення теплоти реакції застосовують перший закон термодинаміки:
- dQ = dU + PdV = dH – VdP
Якщо горіння відбувається при P =const (dP=0), теплота реакції дорівнює різниці повних ентальпій системи в початковому і кінцевому стані:
Qр = - ∫dH = - ΔH
Якщо горіння відбувається при V =const (dV=0), теплота реакції дорівнює різниці між внутрішньою енергією системи в початковому і кінцевому стані:
Qv = - ∫dU = - ΔU
Слайд 5Стандартна теплота реакції - різниця між стандартними теплотами утворення продуктів реакції
і вихідних речовин.
Qр = - ΔНхр = - (∑nкін ΔНоf кін - ∑nпоч ΔНоf поч ),
Стандартна теплота утворення речовини ΔНоf - теплота реакції, в якій утворюється один моль речовини зі складових його елементів за стандартних умов (Р=101,3 кПа, Т = 298К).
Qр = - ΔНхр = - (∑nкін ΔНоf кін - ∑nпоч ΔНоf поч ),
Стандартна теплота утворення речовини ΔНоf - теплота реакції, в якій утворюється один моль речовини зі складових його елементів за стандартних умов (Р=101,3 кПа, Т = 298К).
Слайд 62. ТЕПЛОТА ЗГОРЯННЯ
Теплота згоряння - кількість тепла, що виділяється під час
повного згоряння одиниці кількості ГР за умови, що вихідна суміш та кінцеві ПГ знаходяться за стандартних умов.
Оскільки ГР 1 моль, а теплота утворення О2 та N2 дорівнює 0, тепловий ефект реакції горіння становить:
Оскільки ГР 1 моль, а теплота утворення О2 та N2 дорівнює 0, тепловий ефект реакції горіння становить:
Слайд 72.1. Види теплоти згоряння
Залежно від того, як визначають одиницю кількості ГР,
розрізняють теплоти згоряння:
молярну Q - кількість тепла, що виділяється при згорянні 1 молю ГР (кДж/моль),
масову Q/ - кількість тепла, що виділяється при згорянні 1 кг ГР (кДж/кг),
об’ємну Q// - кількість тепла, що виділяється при згорянні 1 м3 ГР (кДж/м3).
молярну Q - кількість тепла, що виділяється при згорянні 1 молю ГР (кДж/моль),
масову Q/ - кількість тепла, що виділяється при згорянні 1 кг ГР (кДж/кг),
об’ємну Q// - кількість тепла, що виділяється при згорянні 1 м3 ГР (кДж/м3).
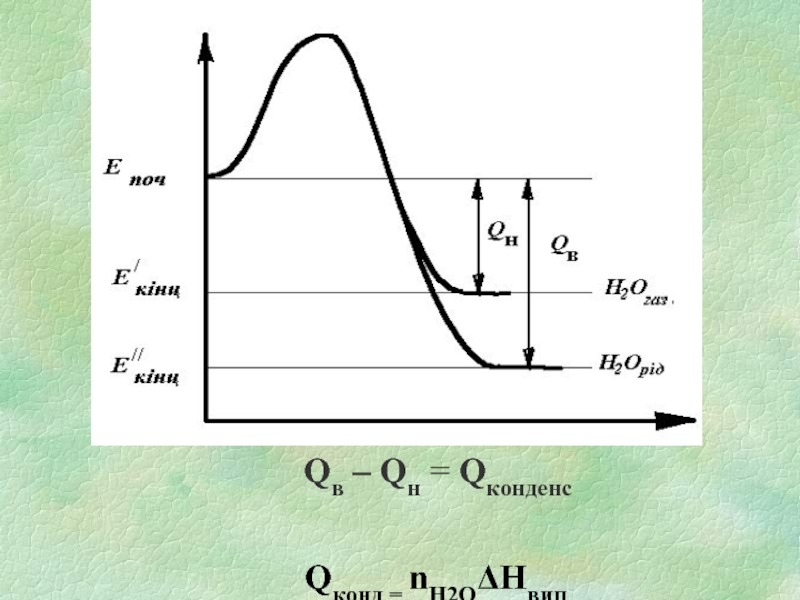
Слайд 8Залежно від агрегатного стану Н2О, яка утворилася під час горіння і
знаходиться в ПГ, розрізняють вищу та нижчу теплоту згоряння.
Вища теплота згоряння Qв - кількість тепла, що виділяється при повному згорянні одиниці кількості ГР за умови, що вода в ПГ знаходиться у рідкому стані.
Нижча теплота згоряння Qн - кількість тепла, що виділяється при повному згорянні одиниці кількості ГР за умови, що вода в ПГ знаходяться в газоподібному стані.
Вища теплота згоряння Qв - кількість тепла, що виділяється при повному згорянні одиниці кількості ГР за умови, що вода в ПГ знаходиться у рідкому стані.
Нижча теплота згоряння Qн - кількість тепла, що виділяється при повному згорянні одиниці кількості ГР за умови, що вода в ПГ знаходяться в газоподібному стані.
Слайд 10При урахуванні хімічного недопалу, вологості матеріалу, втрати на теплове випромінювання, визначають
практичну або робочу теплоту згоряння матеріалу Qнр.
Слайд 112.2. Розрахунок теплоти згоряння
Горюча речовина індивідуального складу
Молярна теплота згоряння
, кДж/моль
масова , кДж/кг
об'ємна , кДж/м3
масова , кДж/кг
об'ємна , кДж/м3
Слайд 12Горючі матеріали складного хімічного складу
суміш газів
тверді або рідкі складні матеріали
Qскл =
ΣQi gi
Ств + (О2 + 3,76 N2) = CO2 + 3,76 N2
Qв(Н)=285,83кДж/моль; Qв(S)= 297,09 кДж/моль
Ств + (О2 + 3,76 N2) = CO2 + 3,76 N2
Qв(Н)=285,83кДж/моль; Qв(S)= 297,09 кДж/моль
Слайд 13Внесок кожного елементу в масову теплоту згоряння:
Qв’ = 327,6⋅ϕС + 1429,2⋅ϕН
+ 92,8⋅ϕS ; кДж/ кг
Слайд 14ФОРМУЛА МЕНДЄЛЄЄВА
Враховує наявність в ГР оксигену, нітрогену та вологи.
Вища теплота згоряння:
Q′в=
339,4ϕС +1256,8ϕН +108,9(ϕS – ϕO – ϕN),
кДж/кг
Нижча теплота згоряння:
Qн / = Qв/ -Qконд
Qн/= 339,4⋅ϕС + 1256,8⋅ϕН + 108,9 (ϕS - ϕO - ϕN) –
– 25,1(9⋅ϕН + W), кДж/ кг
де W – мас. відсоток вологи в ГР
кДж/кг
Нижча теплота згоряння:
Qн / = Qв/ -Qконд
Qн/= 339,4⋅ϕС + 1256,8⋅ϕН + 108,9 (ϕS - ϕO - ϕN) –
– 25,1(9⋅ϕН + W), кДж/ кг
де W – мас. відсоток вологи в ГР
Слайд 15ПРАКТИЧНЕ ЗНАЧЕННЯ ТЕПЛОТИ ЗГОРЯННЯ
1) Використовують для розрахунку пожежної навантаги, що є
характеристикою теплового впливу пожежі на будівельні конструкції.
Пожежна навантага Р - кількість тепла, що може виділитися при згорянні речовин з одиниці поверхні підлоги приміщення.
Розрізняють постійну і тимчасову пожежну навантагу.
Пожежна навантага Р - кількість тепла, що може виділитися при згорянні речовин з одиниці поверхні підлоги приміщення.
Розрізняють постійну і тимчасову пожежну навантагу.
Слайд 162) Використовують для визначення горючості речовини.
Речовини є негорючими, якщо вони
не відносяться до вибухонебезпечних та їх Qн/ менша за 2100 кДж/кг або 1830 кДж/м3.
3) Використовують при розрахунку параметрів пожежної небезпеки речовин, таких як температура горіння, температура вибуху, максимальний тиск вибуху, нижча концентраційна межа поширення полум’я.
3) Використовують при розрахунку параметрів пожежної небезпеки речовин, таких як температура горіння, температура вибуху, максимальний тиск вибуху, нижча концентраційна межа поширення полум’я.
Слайд 173. ПОНЯТТЯ ТА ВИДИ
ТЕМПЕРАТУРИ ГОРІННЯ РЕЧОВИН
Температура горіння - температура, до
якої нагріваються продукти горіння в зоні реакції.
Розрахувати температуру горіння можна знаючи величину теплоти згоряння. Рівняння теплового балансу під час горіння має вигляд:
Qгор– Qнед = Qнагр. пг + Qтвт,
Залежно від умов, в яких протікає процес горіння, розрізняють температури горіння
калориметричну,
теоретичну,
адіабатичну,
дійсну.
Розрахувати температуру горіння можна знаючи величину теплоти згоряння. Рівняння теплового балансу під час горіння має вигляд:
Qгор– Qнед = Qнагр. пг + Qтвт,
Залежно від умов, в яких протікає процес горіння, розрізняють температури горіння
калориметричну,
теоретичну,
адіабатичну,
дійсну.
Слайд 18Калориметрична температура горіння - температура, до якої нагріваються ПГ, якщо виконуються
наступні умови:
1) вихідна система знаходиться за стандартних умов (То=298 К, Ро=101,3 кПа);
2) відбувається повне згоряння ГР, при цьому повітря для горіння надходить у стехіометричному співвідношенні;
3) в процесі утворення ПГ не відбувається їх дисоціація;
4) немає тепловтрат від системи в навколишнє середовище.
1) вихідна система знаходиться за стандартних умов (То=298 К, Ро=101,3 кПа);
2) відбувається повне згоряння ГР, при цьому повітря для горіння надходить у стехіометричному співвідношенні;
3) в процесі утворення ПГ не відбувається їх дисоціація;
4) немає тепловтрат від системи в навколишнє середовище.
Слайд 19Через відсутність тепловтрат і недопалу вважаємо, що все тепло, що виділилося
під час реакції, іде на нагрівання ПГ.
ПГ в зоні реакції мають високу температуру, отже вода в ПГ залишається в газоподібному стані, тому в розрахунках використовують нижчу теплоту згоряння.
Qнед = Qтвт = 0, Qнагрів пг = Qн
ПГ в зоні реакції мають високу температуру, отже вода в ПГ залишається в газоподібному стані, тому в розрахунках використовують нижчу теплоту згоряння.
Qнед = Qтвт = 0, Qнагрів пг = Qн
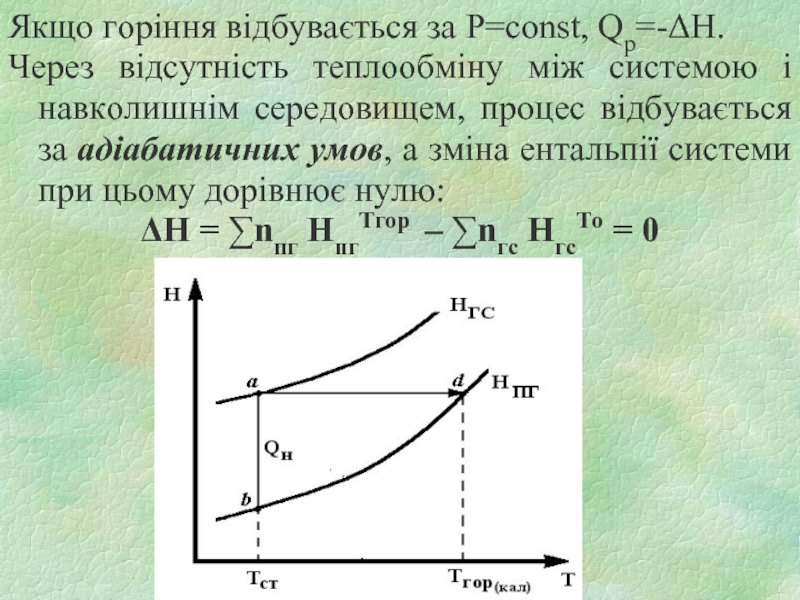
Слайд 20Якщо горіння відбувається за P=const, Qр=-ΔH.
Через відсутність теплообміну між системою
і навколишнім середовищем, процес відбувається за адіабатичних умов, а зміна ентальпії системи при цьому дорівнює нулю:
ΔН = ∑nпг HпгТгор – ∑nгс HгсТо = 0
ΔН = ∑nпг HпгТгор – ∑nгс HгсТо = 0
Слайд 21Якщо Тгор достатньо висока, то ПГ можуть дисоціювати з витратою значної
кількості тепла.
2СО2 = 2СО + О2 – 566 кДж
2Н2О = 2Н2 + О2 – 478 кДж
Теоретична температура горіння - ступінь нагрітості продуктів горіння з урахуванням їх дисоціації, якщо виконуються наступні умови:
1) вихідна ГС знаходиться за стандартних умов;
2) відбувається повне згоряння горючої суміші стехіометричного складу;
3) відбувається суттєва дисоціація ПГ;
4) немає тепловтрат від системи в навколишнє середовище.
2СО2 = 2СО + О2 – 566 кДж
2Н2О = 2Н2 + О2 – 478 кДж
Теоретична температура горіння - ступінь нагрітості продуктів горіння з урахуванням їх дисоціації, якщо виконуються наступні умови:
1) вихідна ГС знаходиться за стандартних умов;
2) відбувається повне згоряння горючої суміші стехіометричного складу;
3) відбувається суттєва дисоціація ПГ;
4) немає тепловтрат від системи в навколишнє середовище.
Слайд 23Адіабатична температура горіння - температура, до якої нагріваються продукти горіння за
умов:
1) вихідна ГС знаходиться за стандартних умов;
2) горіння відбувається з надлишком чи нестачею повітря;
3) дисоціація ПГ не відбувається;
4) немає тепловтрат від системи в навколишнє середовище.
1) вихідна ГС знаходиться за стандартних умов;
2) горіння відбувається з надлишком чи нестачею повітря;
3) дисоціація ПГ не відбувається;
4) немає тепловтрат від системи в навколишнє середовище.
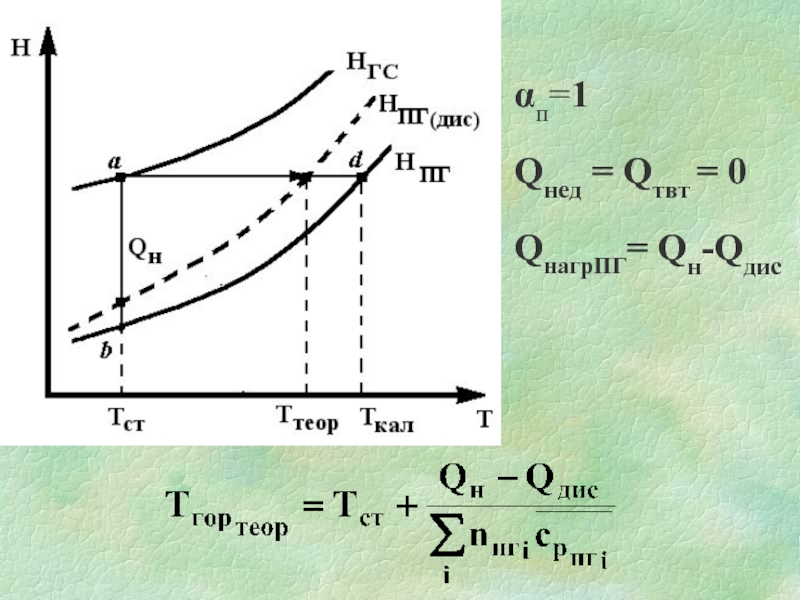
Слайд 24αп≥ 1
Qнед = Qтвт = 0
Qнагрів пг = Qн
nпг – дійсне
число молів ПГ з урахуванням надлишку повітря
Слайд 25Дійсна температура горіння – температура, до якої нагріваються продукти горіння за
реальних умов, при цьому враховується:
1) горіння може проходити з надлишком або нестачею повітря,
2) значні тепловтрати у навколишнє середовище,
3) початкові умови, в яких знаходиться вихідна горюча суміш, можуть відрізнятися від стандартних..
1) горіння може проходити з надлишком або нестачею повітря,
2) значні тепловтрати у навколишнє середовище,
3) початкові умови, в яких знаходиться вихідна горюча суміш, можуть відрізнятися від стандартних..
Слайд 26де Qнедоп - кількість тепла, яка не реалізується в зоні горіння
внаслідок хімічного або фізичного недопалу.
Qнед = (1- η) Qн,
η - коефіцієнт повноти згоряння η = 0,9÷0,75
Qтвт - кількість тепла, що втрачається в навколишнє середовище.
Qнед = (1- η) Qн,
η - коефіцієнт повноти згоряння η = 0,9÷0,75
Qтвт - кількість тепла, що втрачається в навколишнє середовище.
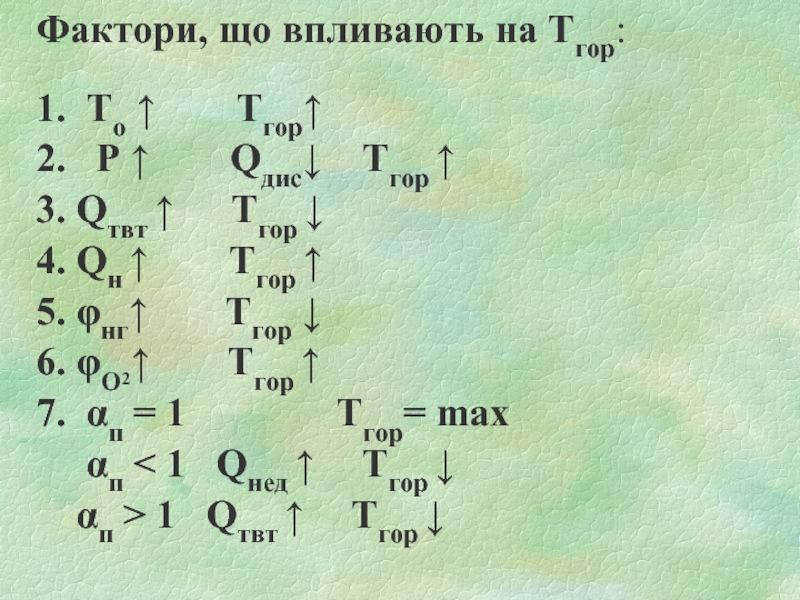
Слайд 27Фактори, що впливають на Тгор:
1. То ↑
Тгор↑
2. Р ↑ Qдис↓ Тгор ↑
3. Qтвт ↑ Тгор ↓
4. Qн ↑ Тгор ↑
5. φнг↑ Тгор ↓
6. φО2↑ Тгор ↑
7. αп = 1 Тгор= max
αп < 1 Qнед ↑ Тгор ↓
αп > 1 Qтвт ↑ Тгор ↓
2. Р ↑ Qдис↓ Тгор ↑
3. Qтвт ↑ Тгор ↓
4. Qн ↑ Тгор ↑
5. φнг↑ Тгор ↓
6. φО2↑ Тгор ↑
7. αп = 1 Тгор= max
αп < 1 Qнед ↑ Тгор ↓
αп > 1 Qтвт ↑ Тгор ↓
Слайд 28Завдання на самопідготовку
1. Вивчити матеріал
Демидов, Шандыба, Щеглов, Горение и свойства горючих
веществ, стор. 29 – 33.
Демидов, Саушев. Горение и свойства горючих веществ, стор. 24-42.
Демидов, Саушев. Горение и свойства горючих веществ, стор. 24-42.