- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория растворов (лекция 1) презентация
Содержание
- 1. Теория растворов (лекция 1)
- 2. Курс лекций по общей химии для
- 3. Рекомендуемая литература: *дадут на семинаре...
- 4. Рекомендуемая литература: *дадут на семинаре...
- 5. Рекомендуемая литература: *надо взять в библиотеке
- 6. 2. Смеси. Классификация по размеру частиц растворенного вещества. Чем отличаются смеси от химических соединений?
- 7. 1. Введение. Особенности химии как науки •
- 8. 2. Смеси. Классификация по размеру частиц растворенного
- 9. 2. Смеси. Классификация по размеру частиц растворенного
- 10. 2. Смеси. Классификация по размеру частиц растворенного вещества. Эффект Тиндаля
- 11. 3. Раствор как частный случай понятия «смесь».
- 12. 4. Растворимость веществ. Насыщенные и ненасыщенные растворы.
- 13. 4. Растворимость веществ. Насыщенные и ненасыщенные растворы.
- 14. 4. Растворимость веществ. Насыщенные и ненасыщенные растворы.
- 15. 5. Способы выражения концентрации растворов. Безразмерные: ω
- 16. 6. Растворы электролитов. Сильные и слабые электролиты.
- 17. 6. Растворы электролитов. Сильные и слабые электролиты.
- 18. 6. Растворы электролитов. Сильные и слабые электролиты.
- 19. 6. Растворы электролитов. Сильные и слабые электролиты.
- 20. 7. Диссоциация сильных электролитов. Понятие «активности»..
- 21. 7. Диссоциация сильных электролитов. Понятие «активности»..
- 22. 8. Диссоциация слабых электролитов. Степень и константа
- 23. 8. Диссоциация слабых электролитов. Степень и константа
- 24. 8. Диссоциация слабых электролитов. Степень и константа
- 25. 8. Диссоциация слабых электролитов. Степень и константа
- 26. 9. Ионное произведение воды. Водородный и гидроксильный
- 27. 9. Ионное произведение воды. Водородный и гидроксильный
- 28. 9. Ионное произведение воды. Водородный и гидроксильный
- 29. 9. Ионное произведение воды. Водородный и гидроксильный
- 30. 9. Ионное произведение воды. Водородный и гидроксильный
- 31. Кислотность растворов Значения pH растворов кислот, солей
- 32. Произведение растворимости: Произведение растворимости
- 33. Произведение растворимости: Как определить
- 34. Условия выпадения и растворения
- 35. Определение рН сильных электролитов: Для
- 36. 9. Ионное произведение воды. Водородный и гидроксильный
- 37. В лекции использованы материалы профессора химического
Слайд 1Лекция 1
Теория растворов
Рассматриваемые вопросы:
- Введение.
- Смеси. Классификация по размеру частиц растворенного
- Раствор как частный случай понятия «смесь». Классификация растворов.
- Растворимость веществ. Насыщенные и ненасыщенные растворы. Концентрация растворов.
- Способы выражения концентрации растворов.
- Растворы электролитов. Сильные и слабые электролиты.
- Диссоциация сильных электролитов. Понятие «активности».
- Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда.
- Ионное произведение воды. Водородный и гидроксильный показатели.
- Расчет рН сильных и слабых кислот и оснований.
- Произведение растворимости.
Слайд 2Курс лекций
по общей химии
для студентов
ФМХФ
читает Болейко Гелена Михайловна
к.б.н.,
Слайд 62. Смеси. Классификация по размеру частиц растворенного вещества.
Чем отличаются смеси от
Слайд 71. Введение.
Особенности химии как науки
• Отсутствие собственных законов
• Многообразие
• Создание собственного предмета для изучения - большинство из 60 млн. веществ не существует в природе
«Никто не сделал так много для улучшения условий жизни людей, как химики, но их заслуги в должной мере не оценены».
Гарольд Крото, Нобелевский лауреат по химии 1996 г. (за открытие фуллеренов в 1985 г.)
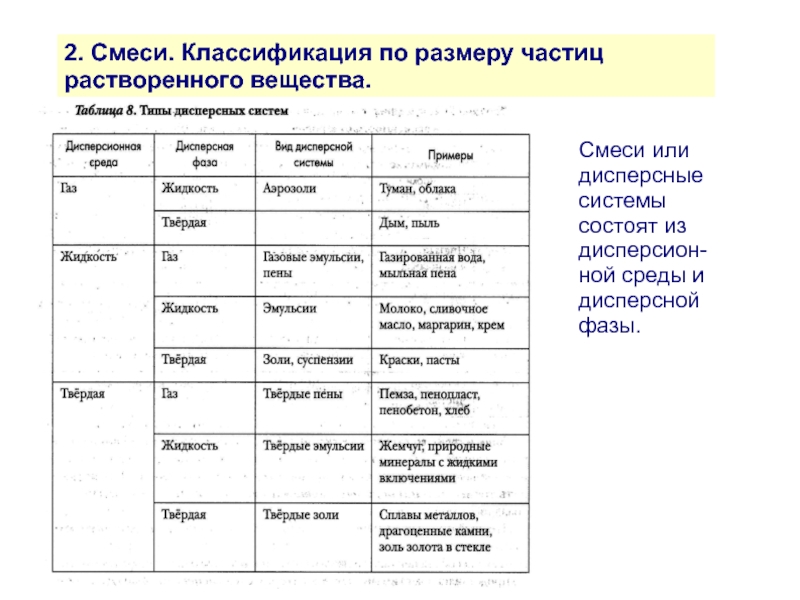
Слайд 82. Смеси. Классификация по размеру частиц растворенного вещества.
Смеси или дисперсные системы
Слайд 92. Смеси. Классификация по размеру частиц растворенного вещества.
По размерам
- механические
(бетон)
- грубодисперсные d ≥ 1000 нм
(взвесь глины в воде)
- микрогетерогенные 100 > d > 1000 нм
(краски, пасты, молоко)
- коллоидные (неистинные) растворы 1 > d > 100 нм
(чай, большинство жидкостей организма)
- истинные растворы d < 1 нм
(раствор соли в воде)
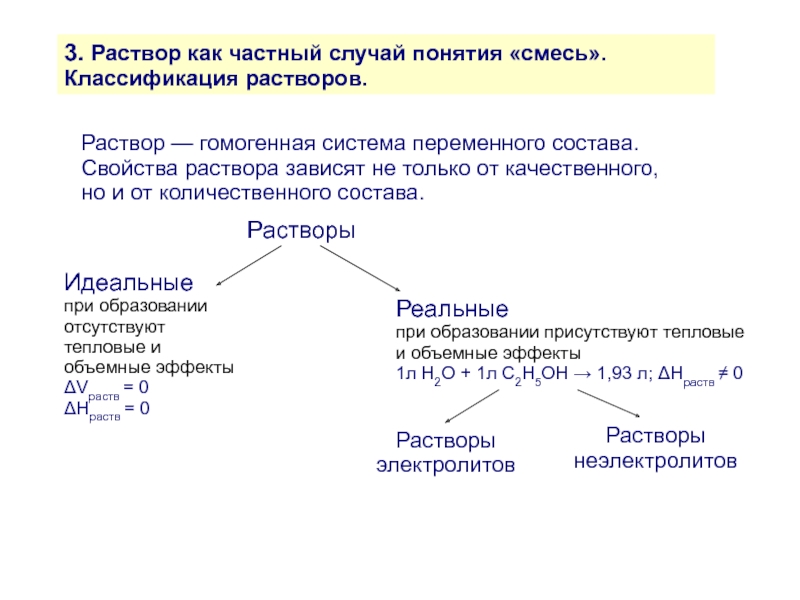
Слайд 113. Раствор как частный случай понятия «смесь». Классификация растворов.
Раствор — гомогенная
Свойства раствора зависят не только от качественного, но и от количественного состава.
Растворы
Идеальные
при образовании отсутствуют тепловые и объемные эффекты
ΔVраств = 0
ΔHраств = 0
Реальные
при образовании присутствуют тепловые и объемные эффекты
1л Н2О + 1л С2Н5ОН → 1,93 л; ΔHраств ≠ 0
Растворы электролитов
Растворы неэлектролитов
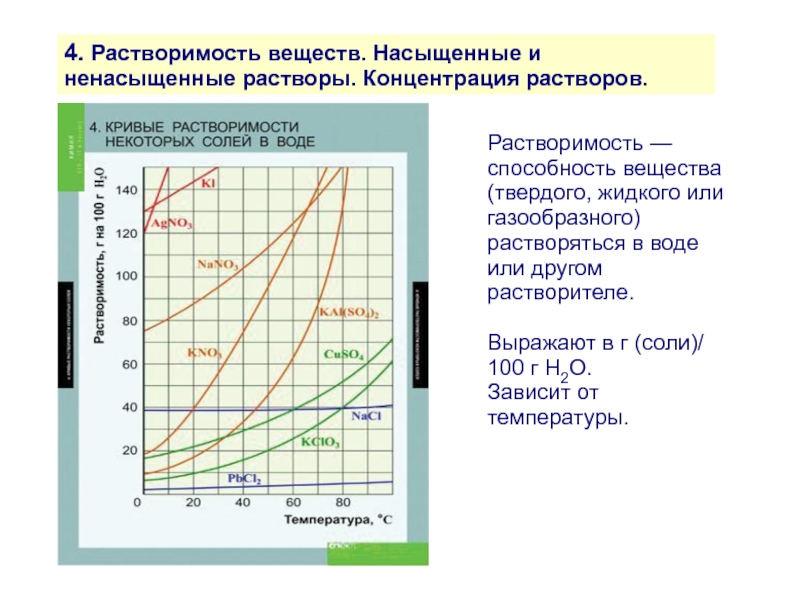
Слайд 124. Растворимость веществ. Насыщенные и ненасыщенные растворы. Концентрация растворов.
Растворимость — способность
Выражают в г (соли)/ 100 г Н2О.
Зависит от температуры.
Слайд 134. Растворимость веществ. Насыщенные и ненасыщенные растворы. Концентрация растворов.
Насыщенный раствор —
Динамическое равновесие:
Vрастворения = Vкристаллизации
Т.о., растворимость — это концентрация насыщенного раствора, т.е. максимально возможная концентрация данного вещества в данном растворителе при данной температуре.
Слайд 144. Растворимость веществ. Насыщенные и ненасыщенные растворы. Концентрация растворов.
Ненасыщенные растворы
Концентрированные
Концентрация раствора — содержание вещества в единице объема или массы раствора.
Слайд 155. Способы выражения концентрации растворов.
Безразмерные:
ω =
φ =
X =
Размерные:
Молярная концентрация
[моль/л]
Молярная концентрация эквивалента
[моль/л]
Моляльная
[моль/кг]
Титр
[г/мл]
Слайд 166. Растворы электролитов. Сильные и слабые электролиты.
Электролиты — это вещества с
Электролитическая диссоциация — процесс распада вещества на ионы.
KA → K+ + A-
Ионы — переносчики заряда 2-го рода, электролит — проводник второго рода.
Справка: переносчики заряда 1-го рода — электроны, проводники 1-го рода — металлы.
Слайд 176. Растворы электролитов. Сильные и слабые электролиты.
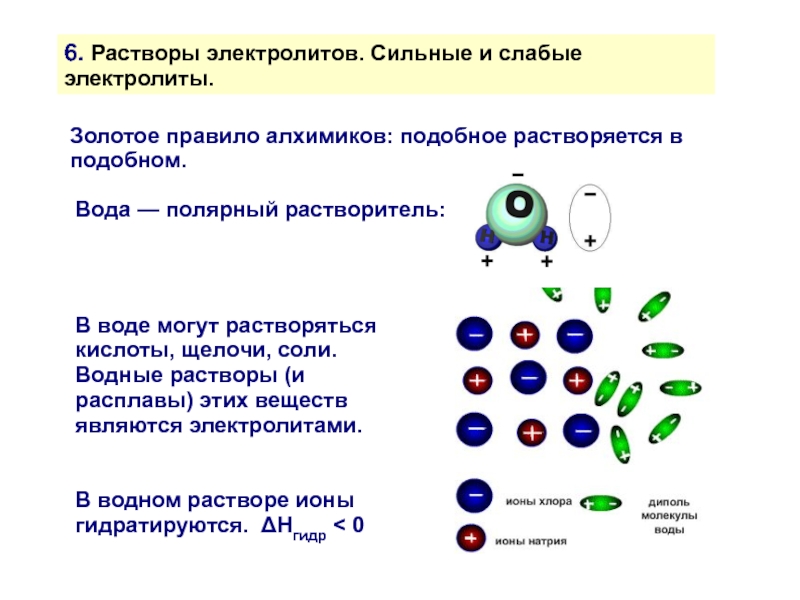
Золотое правило алхимиков: подобное растворяется
Вода — полярный растворитель:
В воде могут растворяться кислоты, щелочи, соли.
Водные растворы (и расплавы) этих веществ являются электролитами.
В водном растворе ионы гидратируются. ΔHгидр < 0
Слайд 186. Растворы электролитов. Сильные и слабые электролиты.
Электролиты
Сильные
диссоциируют
полностью частично
необратимо обратимо
KA → K+ + A- KA <=> K+ + A-
В растворе сильного электролита присутствуют только гидратированные ионы.
В растворе слабого электролита присутствуют и гидратированные ионы, и недиссоциирован-ные молекулы.
При tº = const в растворе слабого электролита устанавливается динамическое равновесие:
Vдиссоциации = Vассоциации
Слайд 196. Растворы электролитов. Сильные и слабые электролиты.
Сильные электролиты:
1. Практически все соли.
2.
бескислородные HСl, HBr, HI
кислородсодержащие: HnЭOn+2 и HnЭOn+3
HNO3, H2SO4, HClO3, HClO4, HMnO4
3. Щелочи: гидроксиды металлов IA и IIA групп (кроме Be и Mg) — NaOH, Ba(OH)2 и пр.
Слабые электролиты:
1. Некоторые соли Zn, Cd и др.
2. Минеральные кислоты:
бескислородные H2S, HCN ...
кислородсодержащие:
HnЭOn и HnЭOn+1
HNO2, H2SO3, HClO, HClO2, H3PO4 …
органические кислоты
3. Основания, в т.ч. NH4OH
Слайд 207. Диссоциация сильных электролитов. Понятие «активности»..
Сильные электролиты диссоциируют полностью и необратимо
- в растворе очень много ионов (гидратированных)
- расстояния между ними малы =>
Подвижность ионов снижается! =>
Снижается активность.
Активность — это эффективная концентрация, в соответствии с которой вещества проявляют себя в реакциях.
Активность — мера концентрации с учетом электростатических ионных взаимодействий.
a = fa·CM;
[моль/л]
где а — активность, [моль/л]
СМ — расчетная (аналитическая) концентрация, [моль/л]
fa — фактор активности (определяется экспериментально либо рассчитывается через ионную силу раствора)
Слайд 217. Диссоциация сильных электролитов. Понятие «активности»..
Уравнения диссоциации сильных электролитов:
HNO3 → H+
Ba(OH)2 → Ba2+ + 2OH-
Al2 (SO4)3 → 2Al3+ + 3SO42-
Na3PO4 → 3Na+ + PO43-
Na2HPO4 → 2Na+ + HPO42-
AlOHCl2 → AlOH2+ + 2Cl-
Слайд 228. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда.
HNO2
многоосновные кислоты диссоциируют ступенчато:
1) H3PO4 ↔ H+ + H2PO4- , КI = 7,1∙10-3
2) H2PO4- ↔ H+ + HPO42- , КII = 6,2∙10-8
3) HPO42- ↔ H+ + PO43- , КIII= 5,0∙10-13 при 25ºС
Каждая ступень диссоциации характеризуется константой равновесия.
Как правило, каждая последующая константа отличается от предыдущей на 5 порядков в меньшую сторону.
Уравнения диссоциации слабых электролитов:
Слайд 238. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда.
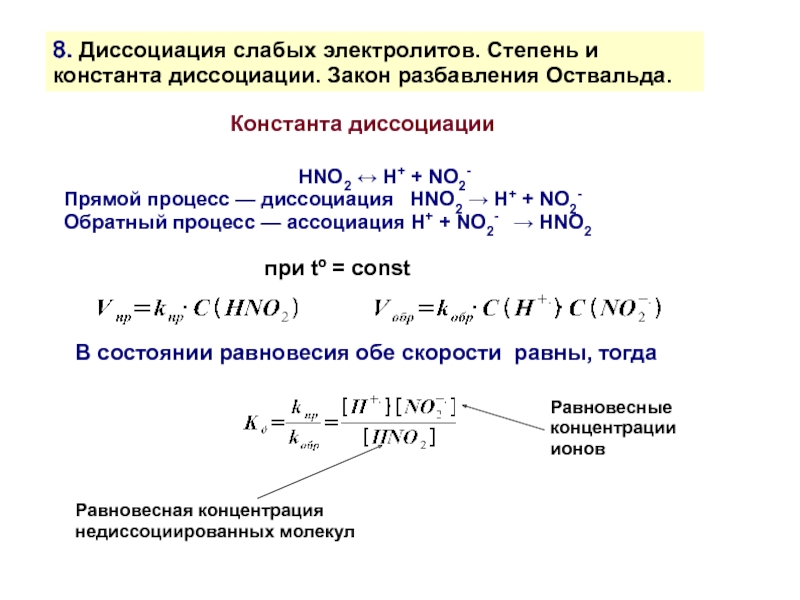
Прямой процесс — диссоциация HNO2 → H+ + NO2-
Обратный процесс — ассоциация H+ + NO2- → HNO2
Константа диссоциации
В состоянии равновесия обе скорости равны, тогда
Равновесная концентрация недиссоциированных молекул
Равновесные концентрации ионов
при tº = const
Слайд 248. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда.
Степень диссоциации
при tº = const
Степень диссоциации зависит:
- от природы растворенного вещества и растворителя;
- от концентрации;
- от температуры.
При бесконечном разбавлении α→1 (к 100%)
Электролиты:
- сильные α > 30%
- средней силы 3% < α < 30%
- слабые α < 3% для 0,1 М р-ров при 25ºС
Слайд 258. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда.
Закон разбавления Оствальда
связывает между собой обе характеристики слабого электролита — степень и константу диссоциации.
при tº = const
Сдисс = α·Собщ = [H+] = [NO2-]
Cнедисс = Собщ — Сдисс = Собщ — α·Собщ = Собщ ·(1-α) = [HNO2]
При α << 1 Кд ≈ α2·Собщ
Слайд 269. Ионное произведение воды. Водородный и гидроксильный показатели.
Вода — слабый амфотерный электролит.
при tº = 25ºС
Практически все молекулы воды находятся в недиссоциированном состоянии,
т.е. [Н2О] = СМ (Н2О) = const при данной tº
СМ (Н2О) = m(H2O) / M(H2O)·V(H2O) = 1000г/18(г/моль)·1л = 55,56 моль
Тогда [H+]·[ОН-] = Кд·[Н2О] = 10-14
Кw = [H+]·[ОН-] = 10-14
Ионное произведение воды
Слайд 279. Ионное произведение воды. Водородный и гидроксильный показатели.
Кw = [H+]·[ОН-] = 10-14
справедливо для любого водного раствора
В чистой дист. воде [H+] = [ОН-] = √10-14 = 10-7 моль/л
В растворе щелочи [H+] < [ОН-], т.е. [H+] < 10-7 моль/л
В растворе кислоты [H+] > [ОН-], т.е. [H+] > 10-7 моль/л
[H+] и [ОН-] - средообразующие ионы!
При увеличении в растворе [H+] или [ОН-] концентрация противоионов уменьшается вследствие смещения равновесия системы в сторону образования молекул Н2О.
Т.о., в кислом или щелочном растворе абсолютные значения ионов [H+] и [ОН-] изменяются, но их произведение остается постоянным!
Слайд 289. Ионное произведение воды. Водородный и гидроксильный показатели.
Кw = [H+]·[ОН-] = 10-14
Вопрос: как изменится Кw при увеличении температуры?
Кw = 55·10-14 при tº = 100ºC
Слайд 299. Ионное произведение воды. Водородный и гидроксильный показатели.
Кw = [H+]·[ОН-] = 10-14
Водородный показатель:
рН = -lg (aH+) или рН = -lg [H+]
Гидроксильный показатель:
рОН = -lg (a ОH-) или рОН = -lg [ОH-]
следовательно, рН + рОН = 14
для любого водного раствора
Слайд 309. Ионное произведение воды. Водородный и гидроксильный показатели.
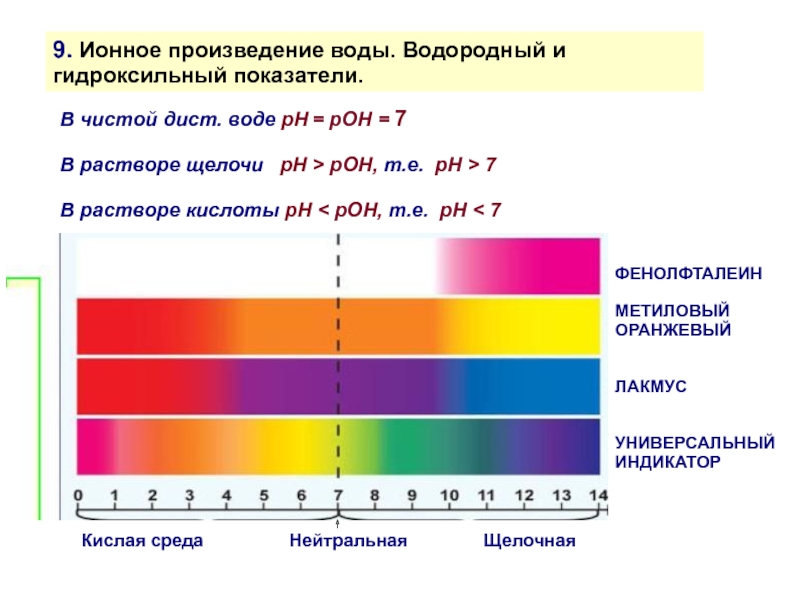
В чистой дист. воде
В растворе щелочи рH > рОН, т.е. рH > 7
В растворе кислоты рH < рОН, т.е. рH < 7
Кислая среда Нейтральная Щелочная
ФЕНОЛФТАЛЕИН
МЕТИЛОВЫЙ
ОРАНЖЕВЫЙ
ЛАКМУС
УНИВЕРСАЛЬНЫЙ ИНДИКАТОР
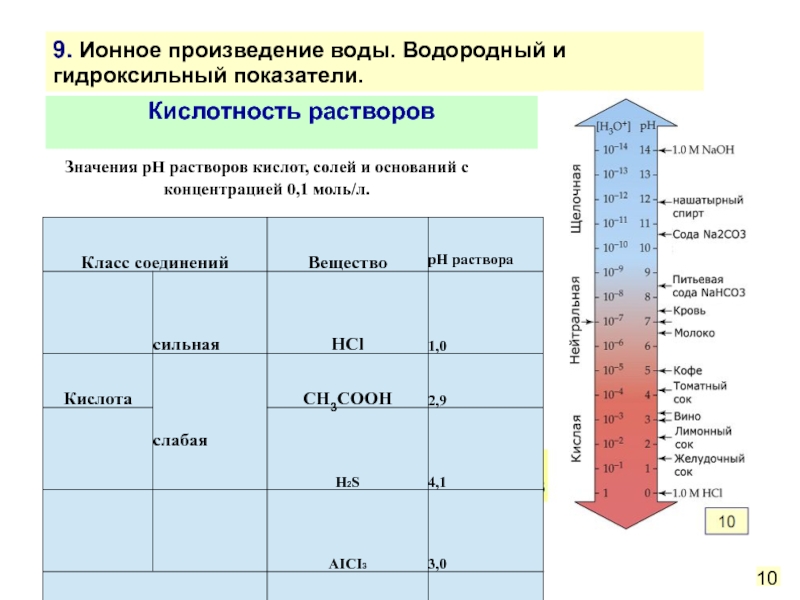
Слайд 31Кислотность растворов
Значения pH растворов кислот, солей и оснований с концентрацией 0,1
10
9. Ионное произведение воды. Водородный и гидроксильный показатели.
Слайд 32
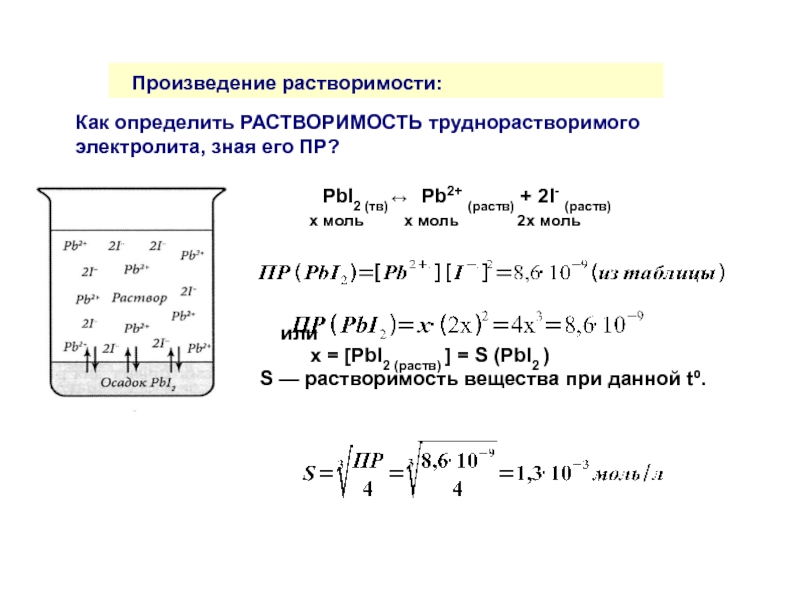
Произведение растворимости:
Произведение растворимости (ПР) — это произведение равновесных концентраций ионов электролита
PbI2 (тв) ↔ Pb2+ (раств) + 2I- (раств)
при tº = const
В насыщенном растворе электролита произведение концентраций его ионов, взятых в степенях их стехиометрических коэффициентов, есть величина постоянная при данной температуре.
Слайд 33
Произведение растворимости:
Как определить РАСТВОРИМОСТЬ труднорастворимого электролита, зная его ПР?
х моль х моль 2х моль
или
х = [PbI2 (раств) ] = S (PbI2 )
S — растворимость вещества при данной tº.
Слайд 34
Условия выпадения и растворения осадков:
Если в некотором произвольном растворе произведение концентраций
Например, образуется ли осадок при сливании равных объемов 0,002 М растворов Pb(NO3)2 и KI?
Pb(NO3)2 + 2KI → PbI2 ↓ + 2KNO3
0,002 моль 0,002 моль
После разбавления в 2 раза 0,001 моль 0,001 моль
Определяем ПК: ПК = [Pb2+]∙[I-]2 = 10-3∙(10-3)2 = 10-9
10-9 < 8,6·10-9
ПК < ПР
Следовательно, осадок не образуется.
Слайд 35
Определение рН сильных электролитов:
Для сильных электролитов активность средообразующих ионов равна активности
1. Записываем диссоциацию электролита.
2. Определяем средообразующие ионы.
3. Для сильных кислот
ан+ = fa·CM(кислоты)
Для сильных оснований (щелочей)
аОн- = fa·CM(основания)
4. Берем -lg от этой величины и находим соответствующий показатель: рН или рОН.
5. Для определения рН щелочи производим еще одно действие:
рН = 14 - рОН
Слайд 369. Ионное произведение воды. Водородный и гидроксильный показатели.
ЗАДАЧИ:
1. Определите рН 0,05М
2. Определите рН 0,05М раствора NaOH.
3. Определите рН 0,05М раствора HNO2.
4. рН 0,05М раствора NH4OH.
Вариации:
- при известном рН или рОН определить [H+] или [ОН-] в растворе;
- сравнить содержание [H+] в разных растворах: кислоты и щелочи, слабой и сильной кислоты, кислоты или щелочи до и после разбавления.
Задача для подумать:
рН в растворе NaOH равен 8. Каким будет рН раствора после разбавления в 100 раз?
Слайд 37
В лекции использованы материалы профессора химического факультета МГУ им. Ломоносова
Еремина Вадима
Спасибо
за внимание!











![5. Способы выражения концентрации растворов.Безразмерные:ω =φ =X =Размерные:Молярная концентрация[моль/л]Молярная концентрация эквивалента[моль/л]Моляльная концентрация[моль/кг]Титр[г/мл]](/img/tmb/5/443034/93eff30b2b1a39848b6ada0ddf923b4b-800x.jpg)