- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория химического строения Бутлерова. Предмет органической химии. Первое положение теории Бутлерова презентация
Содержание
- 1. Теория химического строения Бутлерова. Предмет органической химии. Первое положение теории Бутлерова
- 2. Предмет органической химии Органическая химия – химия соединений углеводородов и их производных.
- 3. Особенности органических веществ: Многообразие в природе:
- 4. Основные положения теории
- 5. Основные положения теории А. М. Бутлерова
- 6. Четырехвалентность атома углерода: метан этилен
- 7. Формулы: молекулярная C6H6 полная структурная сокращенная
- 8. Различают первичные, вторичные, третичные, четвертичные
- 9. Степень окисления атома углерода
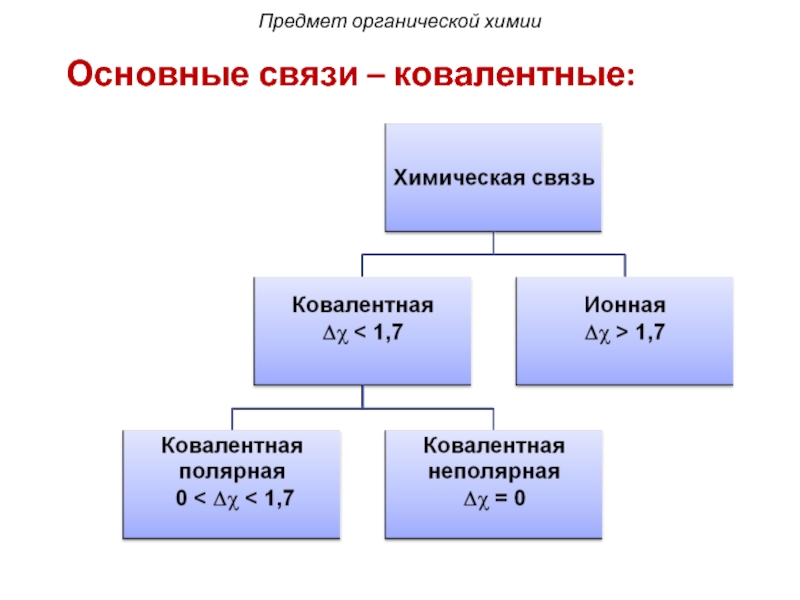
- 10. Предмет органической химии Основные связи – ковалентные:
- 11. С-С – неполярные ковалентные связи;
- 12. По симметрии орбиталей различают: σ-Cвязь – ковалентная
- 13. π-связь – ковалентная связь, возникающая при боковом
- 14. По порядку связи различают: Одинарные
- 15. Только σ-связи имеются в молекулах: Тесты
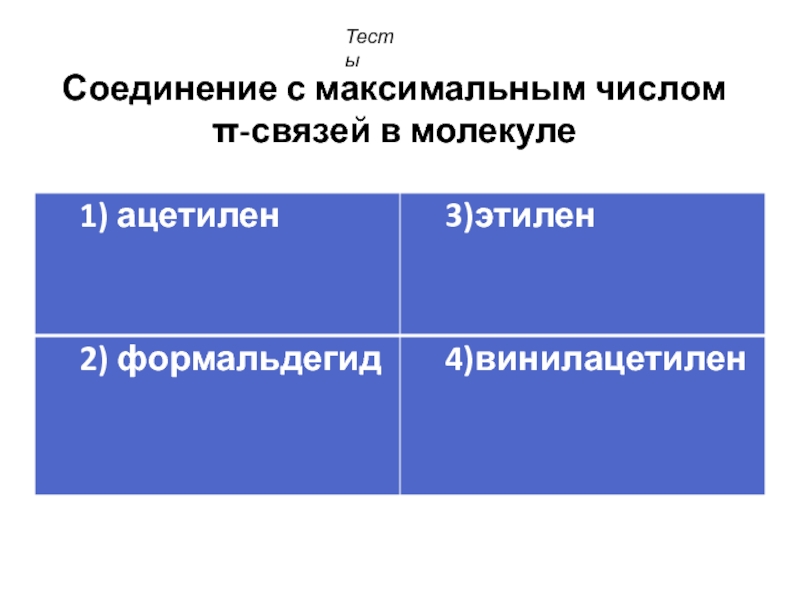
- 16. Соединение с максимальным числом π-связей в молекуле Тесты
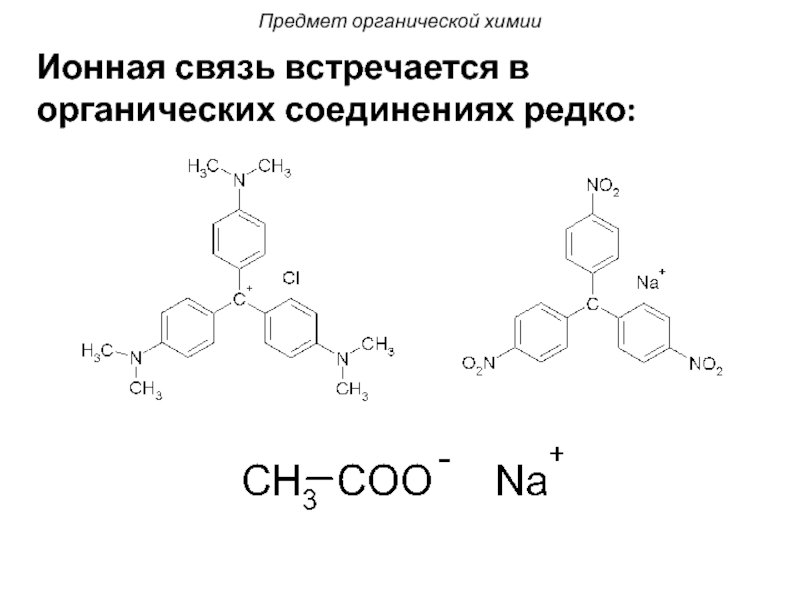
- 17. Ионная связь встречается в органических соединениях редко: Предмет органической химии
- 18. В α-структуре белков каждый первый
- 19. Водородные связи между комплементарными
- 20. В основном органические вещества
- 21. Атом углерода образует связи
- 22. Гибридизация – процесс выравнивания энергии
- 23. Предмет органической химии sp-гибридизация sp2-гибридизация sp3-гибридизация
- 24. sp3-Гибридизация. В этом случае выравниваются энергии одной
- 25. sp2-Гибридизация. Энергии одной 2s и двух 2p-орбиталей
- 26. Гибридные орбитали отталкиваются друг от
- 27. Три sp2-гибридные орбитали участвуют
- 28. p-орбиталь σ- Связь p-орбитали перекрываются Предмет органической химии ЭТИЛЕН
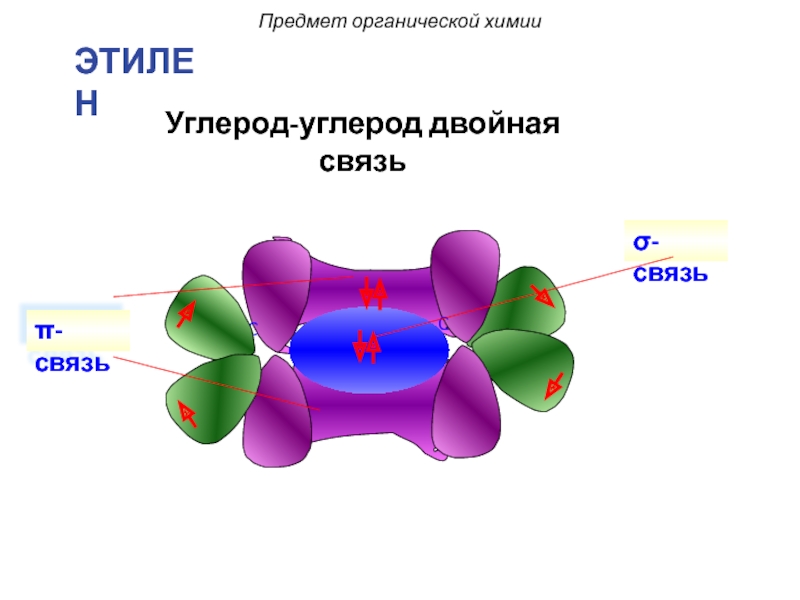
- 29. σ-связь π-связь Углерод-углерод двойная связь Предмет органической химии ЭТИЛЕН
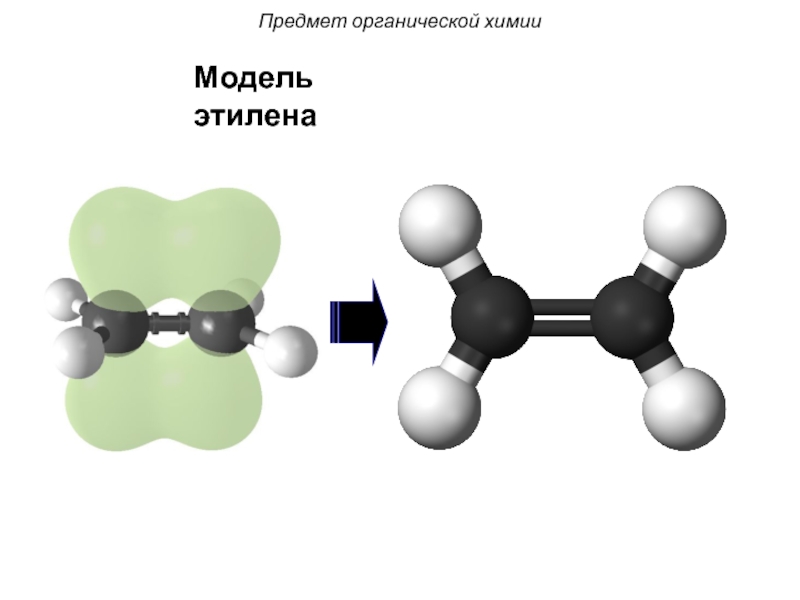
- 30. Модель этилена Предмет органической химии
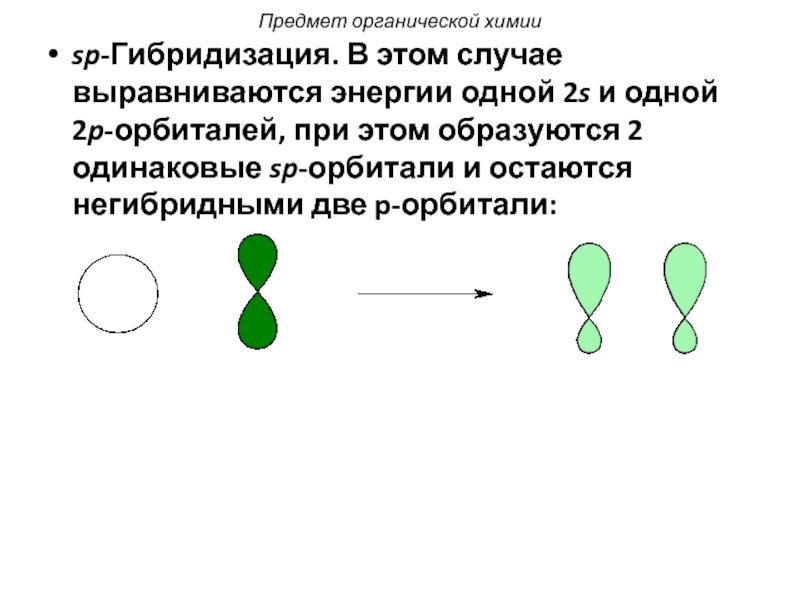
- 31. sp-Гибридизация. В этом случае выравниваются энергии одной
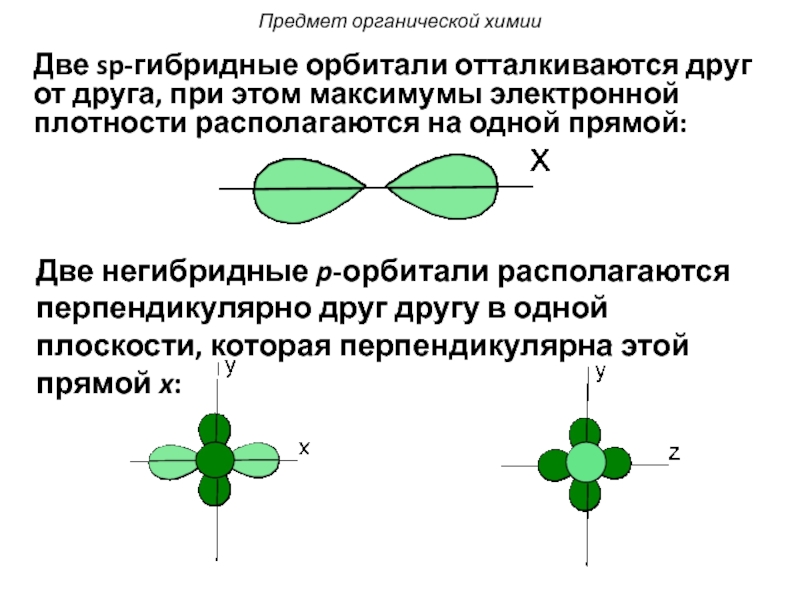
- 32. Две sp-гибридные орбитали отталкиваются друг от друга,
- 33. Молекула ацетилена содержит атомы углерода в
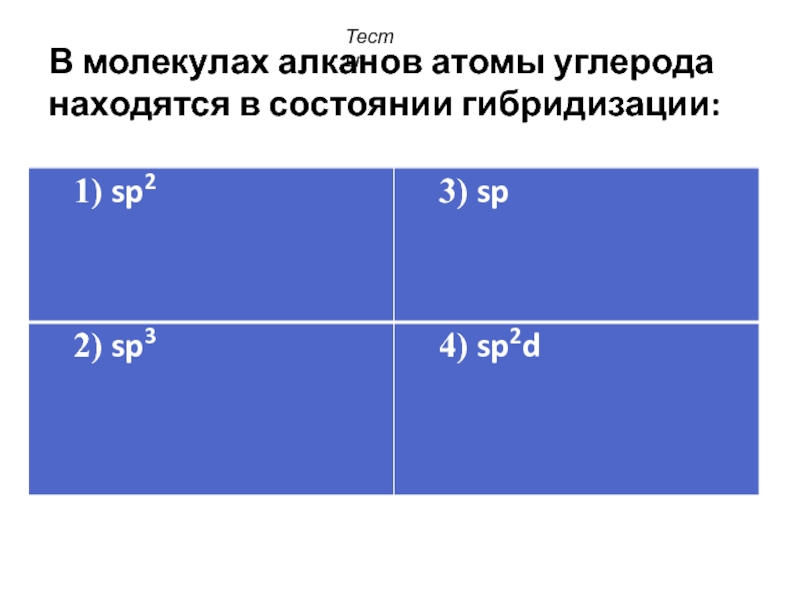
- 34. В молекулах алканов атомы углерода находятся в состоянии гибридизации: Тесты
- 35. Атомов углерода в состоянии
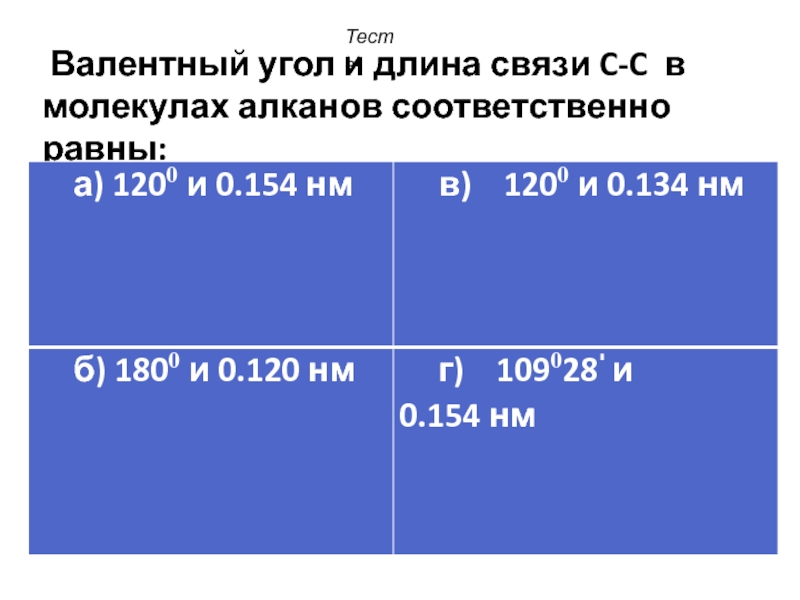
- 36. Валентный угол и длина связи C-C в молекулах алканов соответственно равны: Тесты
- 38. Классификация органических соединений I. Классификация органических
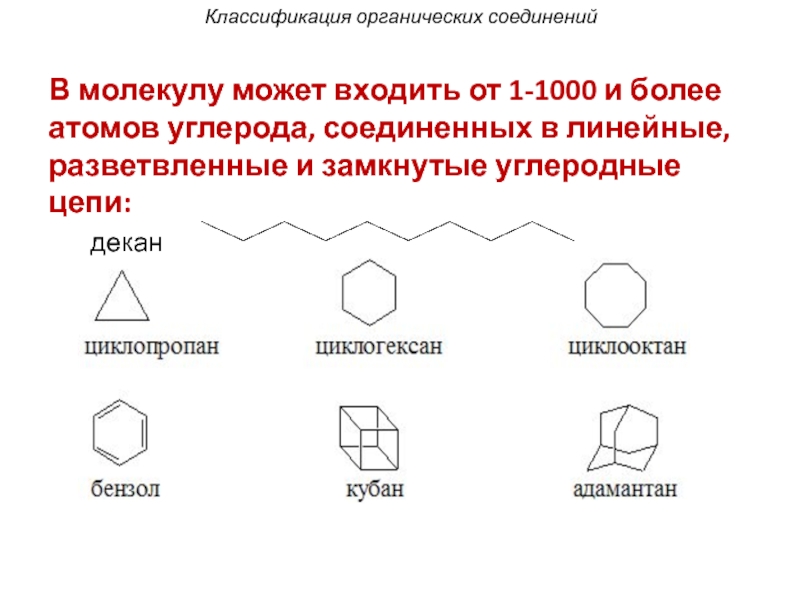
- 39. Классификация органических соединений В молекулу может входить
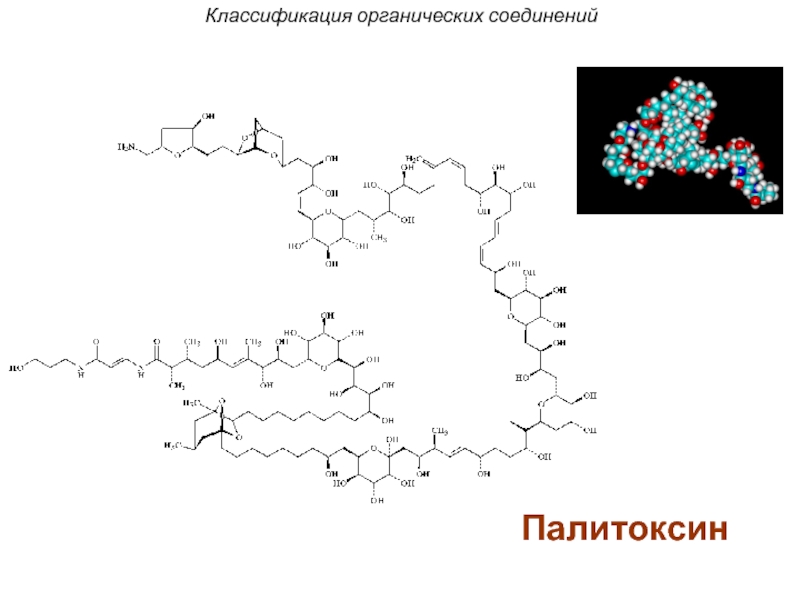
- 40. Палитоксин Классификация органических соединений
- 41. Соединения, содержащие в цикле кроме углерода атомы других элементов называют: Тесты
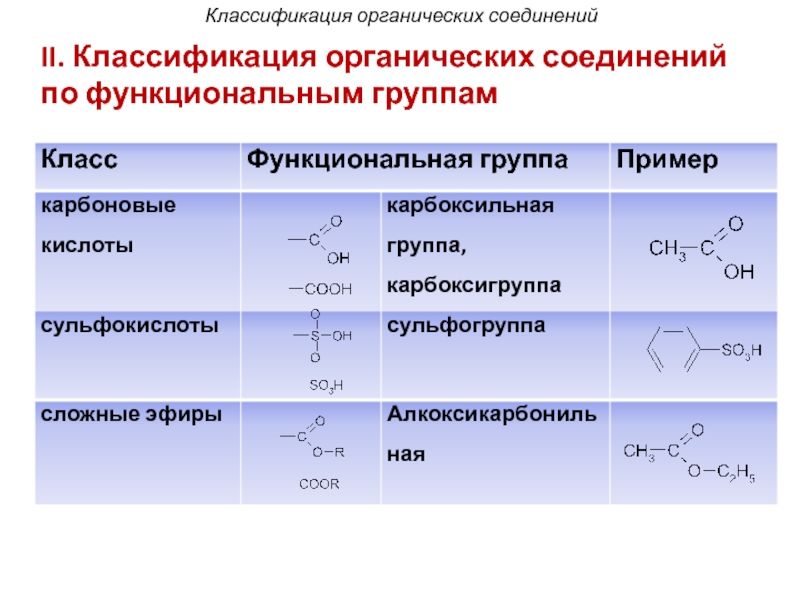
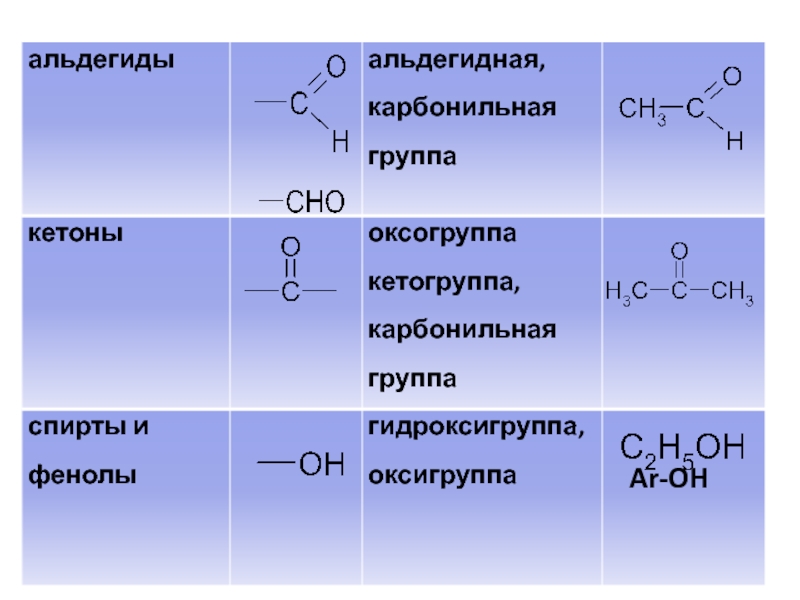
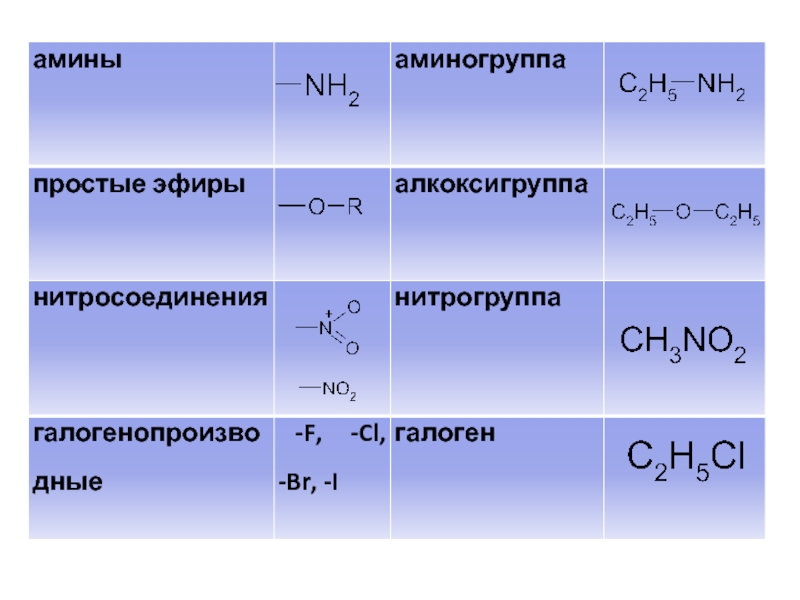
- 42. II. Классификация органических соединений по функциональным группам Классификация органических соединений
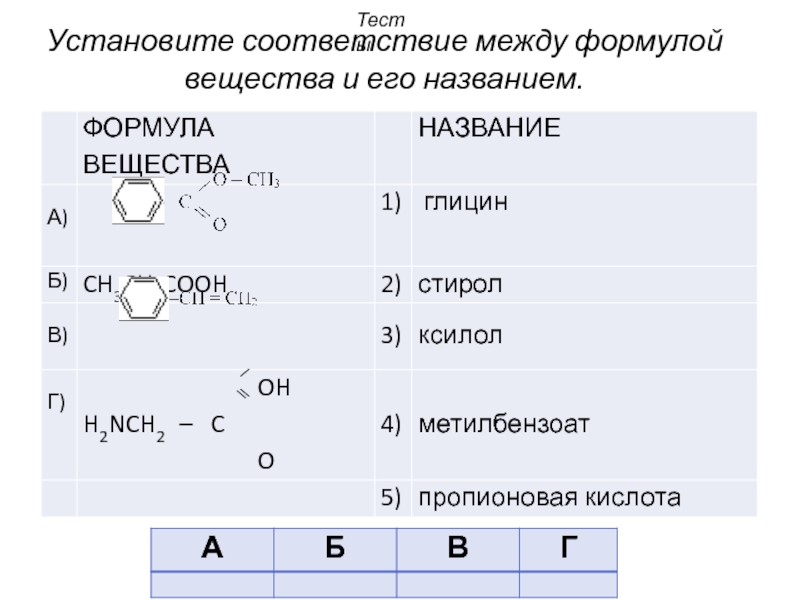
- 45. Установите соответствие между формулой вещества и его названием. Тесты
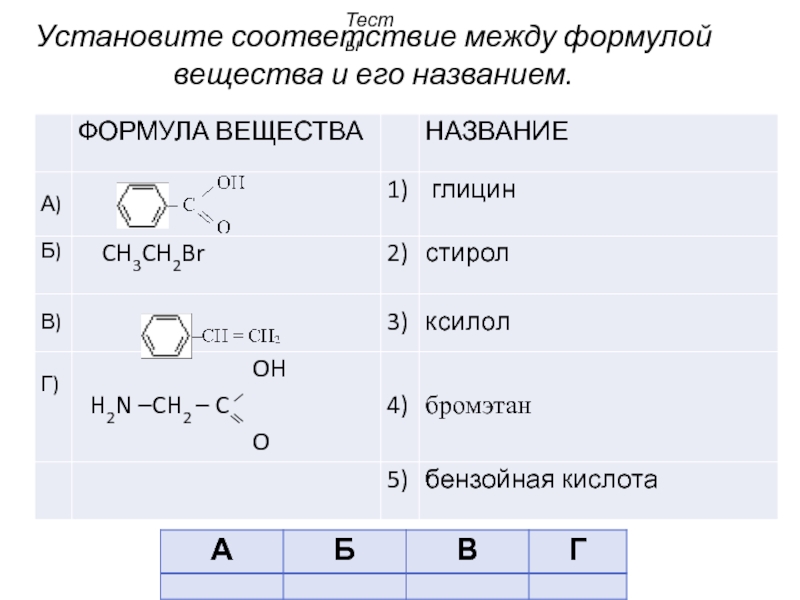
- 46. Установите соответствие между формулой вещества и его названием. Тесты
- 47. Установите соответствие между формулой вещества и классом соединения. Тесты
- 48. Установите соответствие между формулой вещества и классом соединения. Тесты
- 49. Установите соответствие между формулой вещества и классом соединения. Тесты
- 50. СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
Слайд 1ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
ЦЕНТР ДОВУЗОВСКОЙ ПОДГОТОВКИ И ПРОФОРИЕНТАЦИИ
КАФЕДРА ХИМИИ
Теория химического строения
Предмет органической химии.
Первое положение теории А. М. Бутлерова.
Составитель: доктор биологических наук, профессор, зав. кафедрой химии Степанова Ирина Петровна
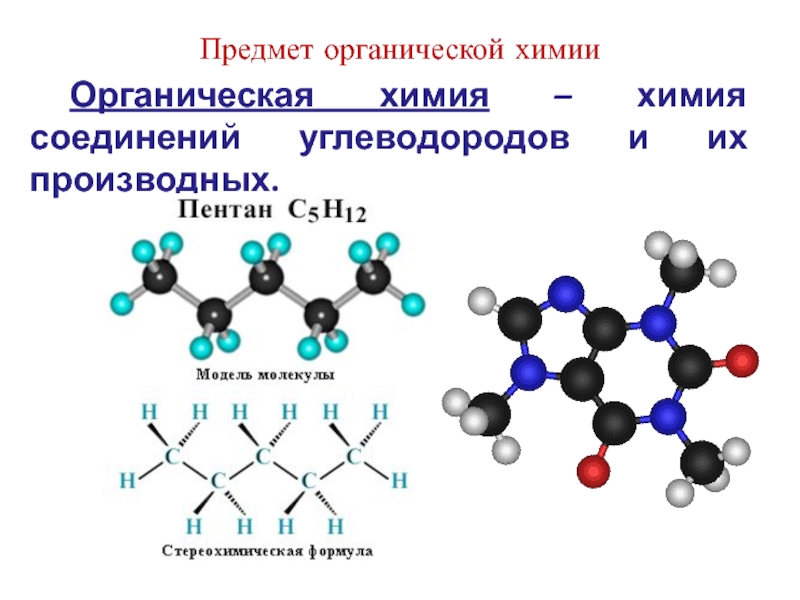
Слайд 2Предмет органической химии
Органическая химия – химия соединений углеводородов и их производных.
Слайд 3Особенности органических веществ:
Многообразие в природе: около 27 млн (неорганических веществ –
Образуются небольшим количеством атомов-неметаллов, которые получили названия органогены: С, Н, О, N (реже S, Р, галогены).
Предмет органической химии
Слайд 5Основные положения теории А. М. Бутлерова
Атомы в составе молекулы
Атом углерода четырехвалентен:
С
Химическая связь (общая электронная пара) изображается черточкой.
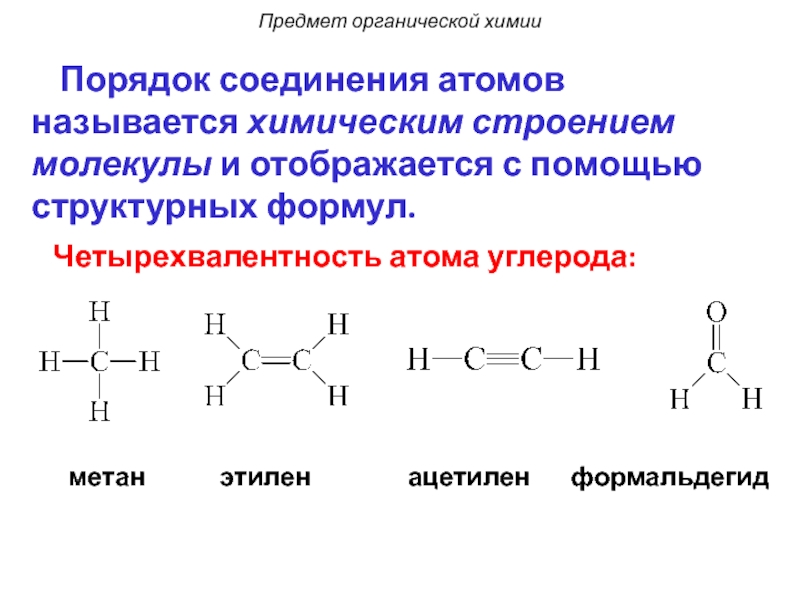
Слайд 6Четырехвалентность атома углерода:
метан
этилен
ацетилен
формальдегид
Порядок соединения
Предмет органической химии
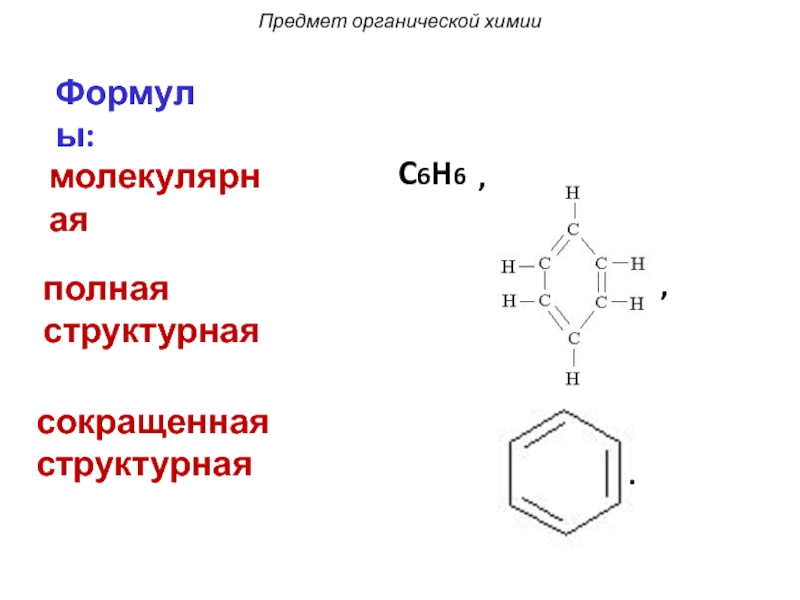
Слайд 7Формулы:
молекулярная
C6H6
полная структурная
сокращенная структурная
,
,
.
Предмет органической химии
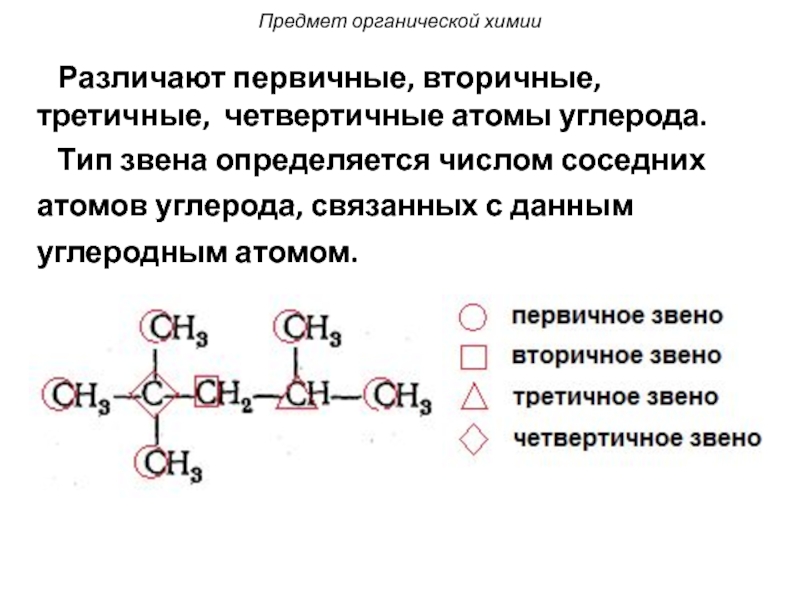
Слайд 8 Различают первичные, вторичные, третичные, четвертичные атомы углерода.
атомов углерода, связанных с данным
углеродным атомом.
Предмет органической химии
Слайд 9 Степень окисления атома углерода лежит в интервале значений
Например:
CH4, C3H8, HCHO, HCOOH,
CCl4
Предмет органической химии
-4
-8/3
0
+4
+2
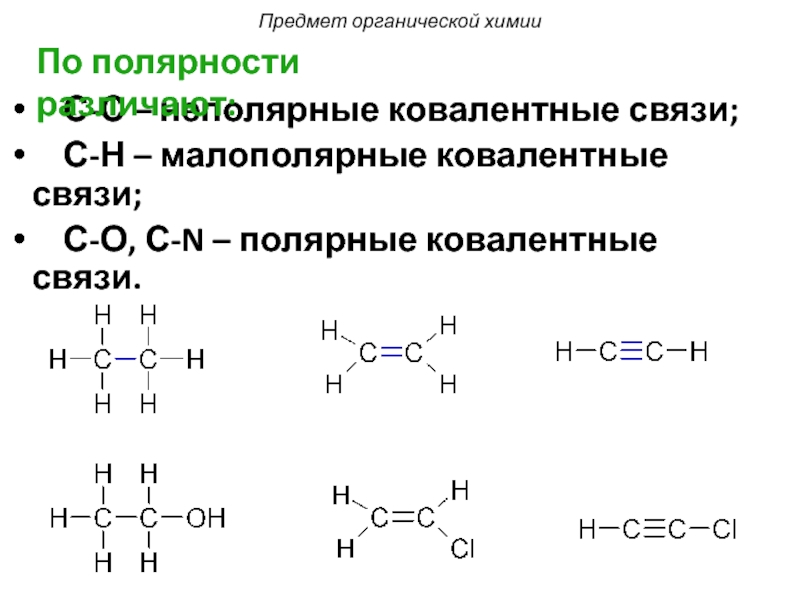
Слайд 11 С-С – неполярные ковалентные связи;
С-Н – малополярные
С-О, С-N – полярные ковалентные связи.
По полярности различают:
Предмет органической химии
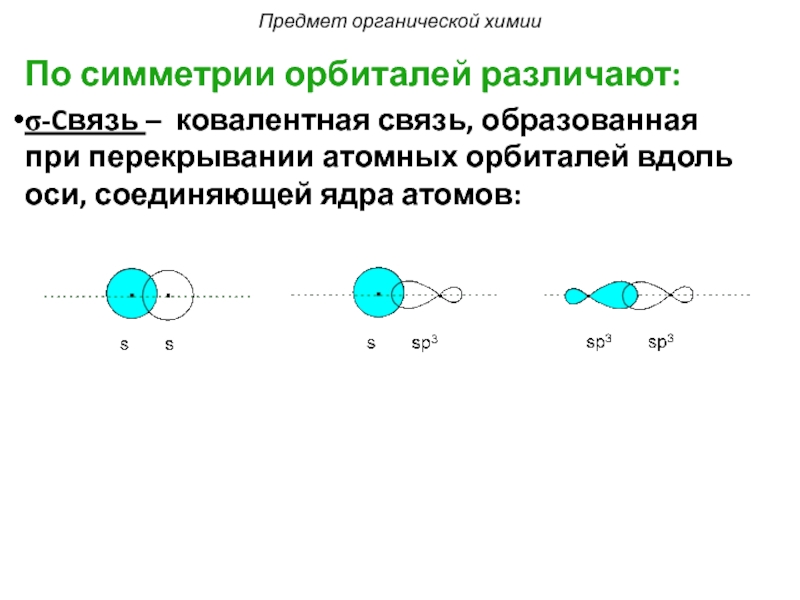
Слайд 12По симметрии орбиталей различают:
σ-Cвязь – ковалентная связь, образованная при перекрывании атомных
Предмет органической химии
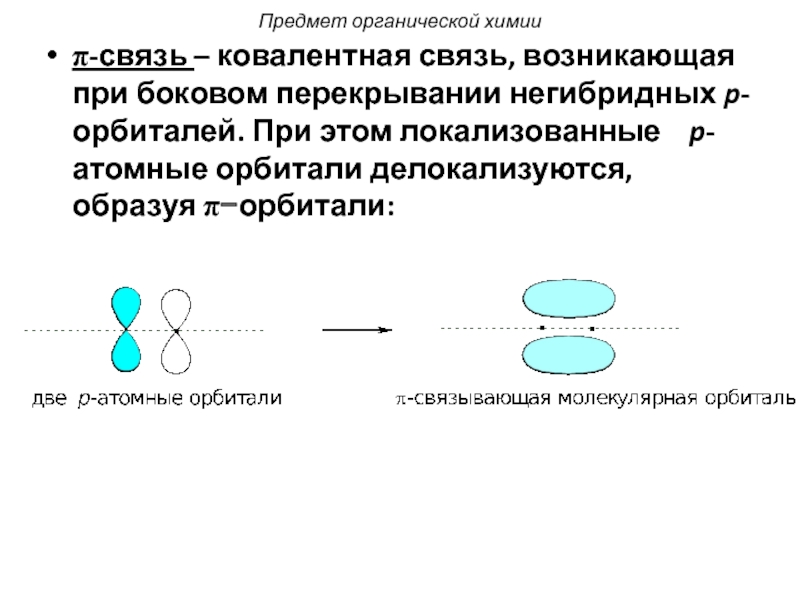
Слайд 13π-связь – ковалентная связь, возникающая при боковом перекрывании негибридных p-орбиталей. При
Предмет органической химии
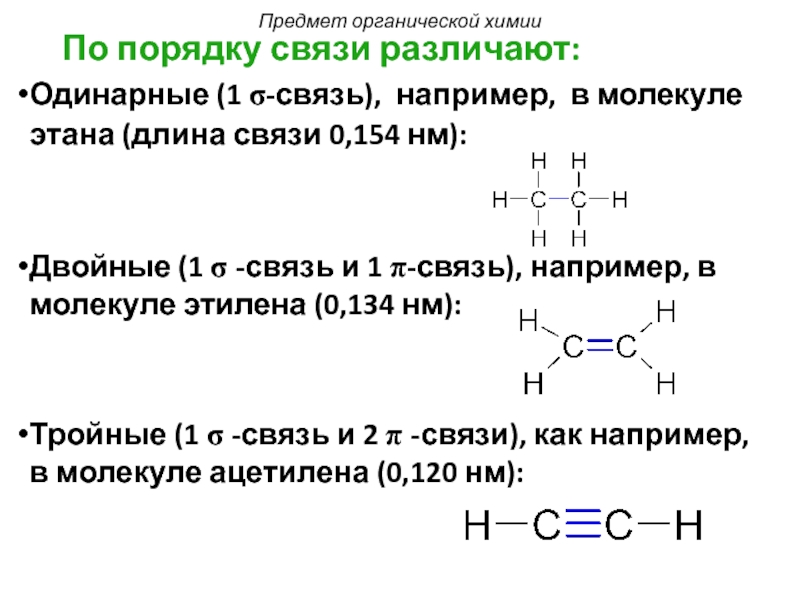
Слайд 14 По порядку связи различают:
Одинарные (1 σ-связь), например, в молекуле
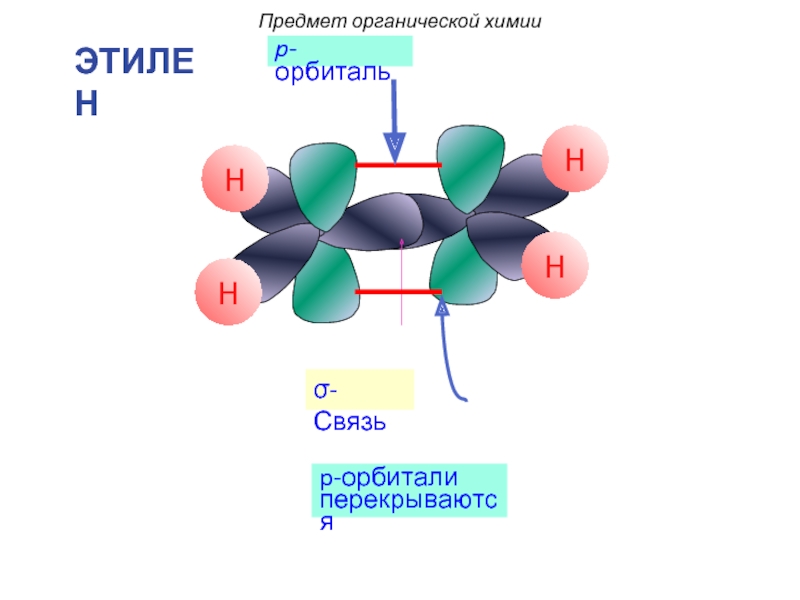
Двойные (1 σ -связь и 1 π-связь), например, в молекуле этилена (0,134 нм):
Тройные (1 σ -связь и 2 π -связи), как например, в молекуле ацетилена (0,120 нм):
Предмет органической химии
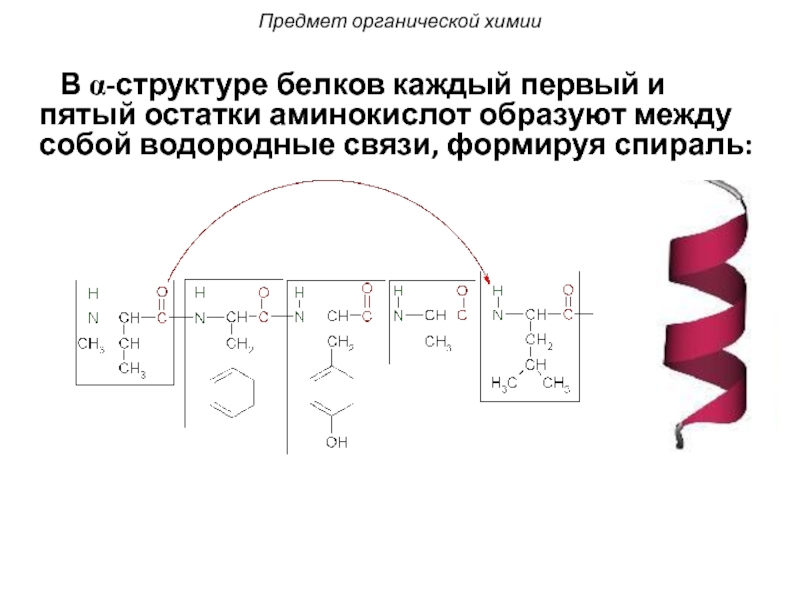
Слайд 18 В α-структуре белков каждый первый и пятый остатки аминокислот
Предмет органической химии
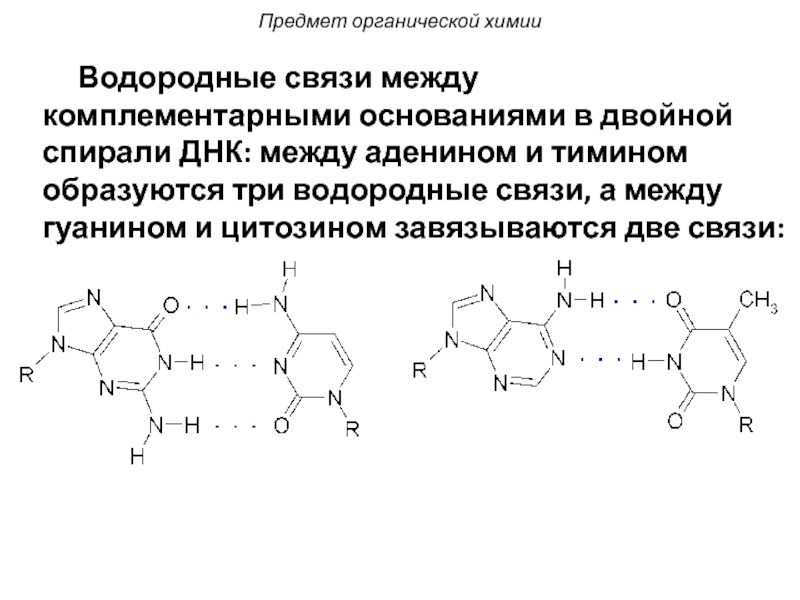
Слайд 19 Водородные связи между комплементарными основаниями в двойной спирали
Предмет органической химии
Слайд 20
В основном органические вещества
имеют молекулярное строение.
Для
Предмет органической химии
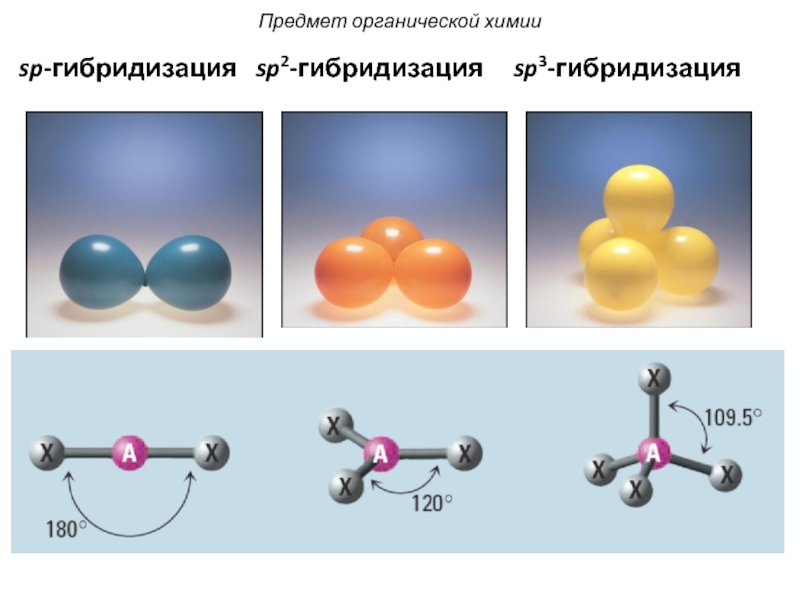
Слайд 21 Атом углерода образует связи в состоянии:
sp3-гибридизации (характерна для
sp2-гибридизации (характерна для алкенов): С=С;
sp-гибридизации (характерна для алкинов): С≡С.
Предмет органической химии
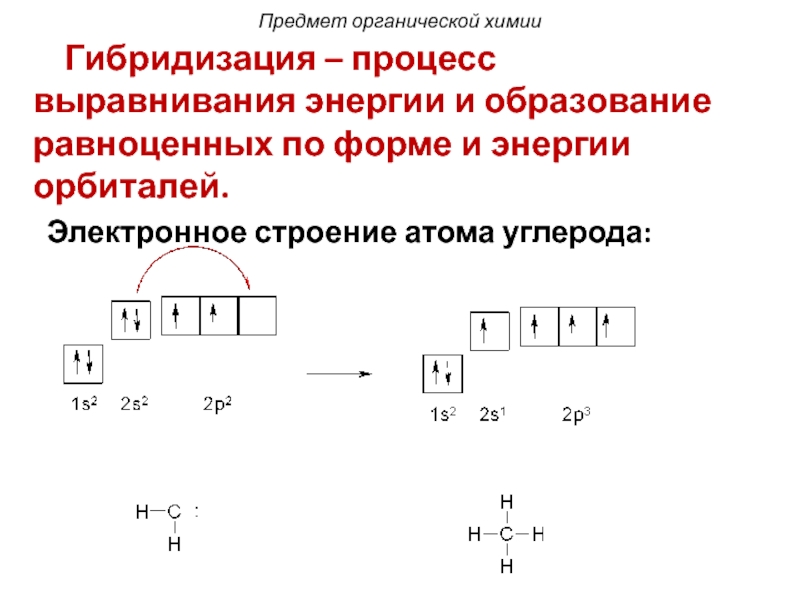
Слайд 22 Гибридизация – процесс выравнивания энергии и образование равноценных по
Электронное строение атома углерода:
Предмет органической химии
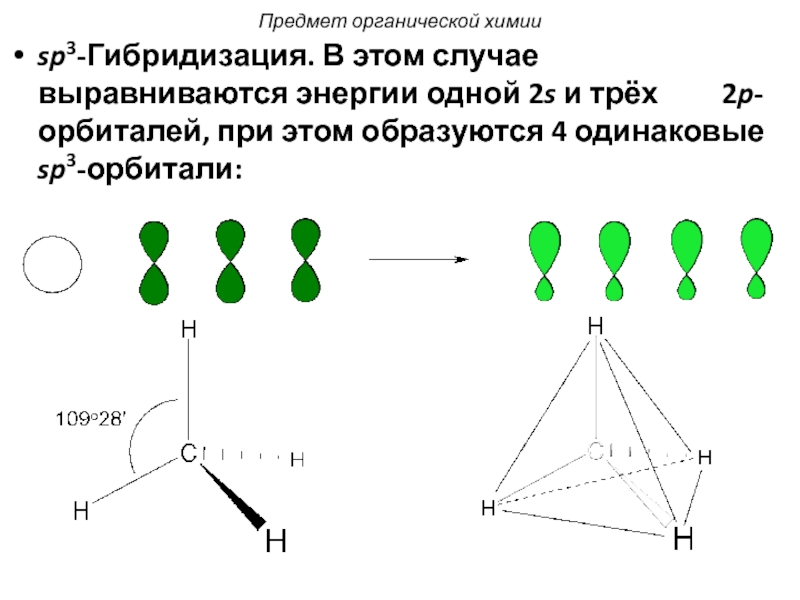
Слайд 24sp3-Гибридизация. В этом случае выравниваются энергии одной 2s и трёх
Предмет органической химии
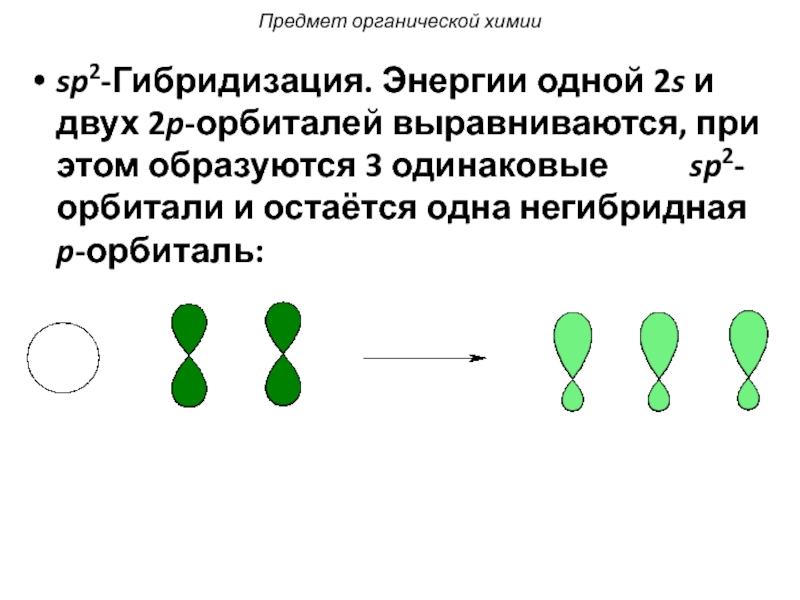
Слайд 25sp2-Гибридизация. Энергии одной 2s и двух 2p-орбиталей выравниваются, при этом образуются
Предмет органической химии
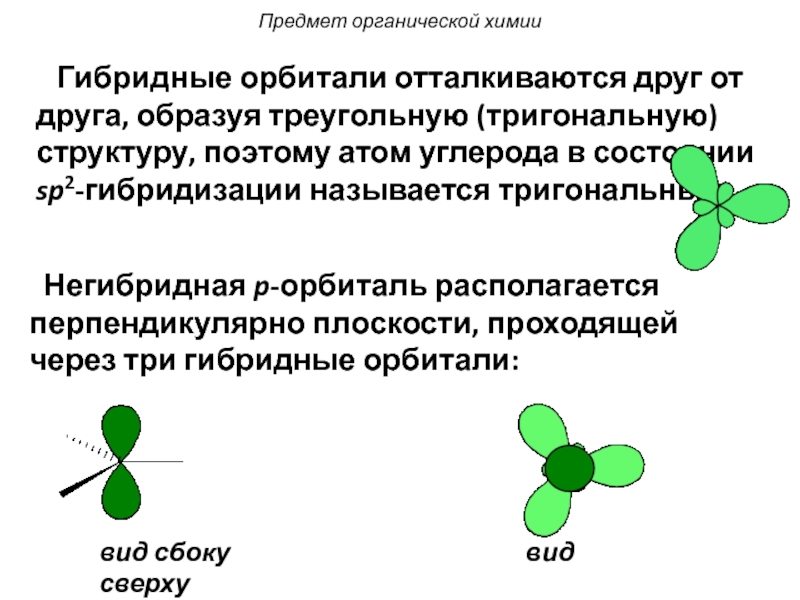
Слайд 26 Гибридные орбитали отталкиваются друг от друга, образуя треугольную (тригональную)
Негибридная p-орбиталь располагается перпендикулярно плоскости, проходящей через три гибридные орбитали:
вид сбоку вид сверху
Предмет органической химии
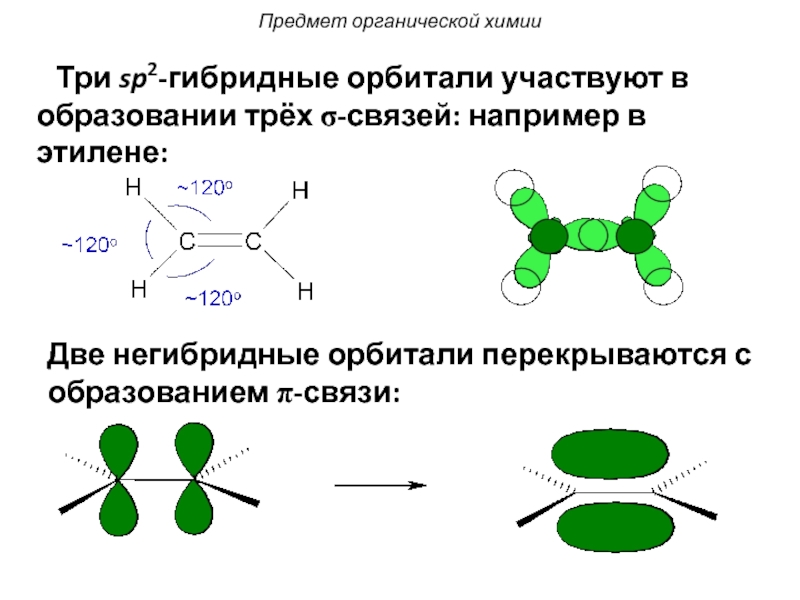
Слайд 27 Три sp2-гибридные орбитали участвуют в образовании трёх σ-связей:
Две негибридные орбитали перекрываются с образованием π-связи:
Предмет органической химии
Слайд 31sp-Гибридизация. В этом случае выравниваются энергии одной 2s и одной 2p-орбиталей,
Предмет органической химии
Слайд 32Две sp-гибридные орбитали отталкиваются друг от друга, при этом максимумы электронной
Две негибридные p-орбитали располагаются перпендикулярно друг другу в одной плоскости, которая перпендикулярна этой прямой x:
Предмет органической химии
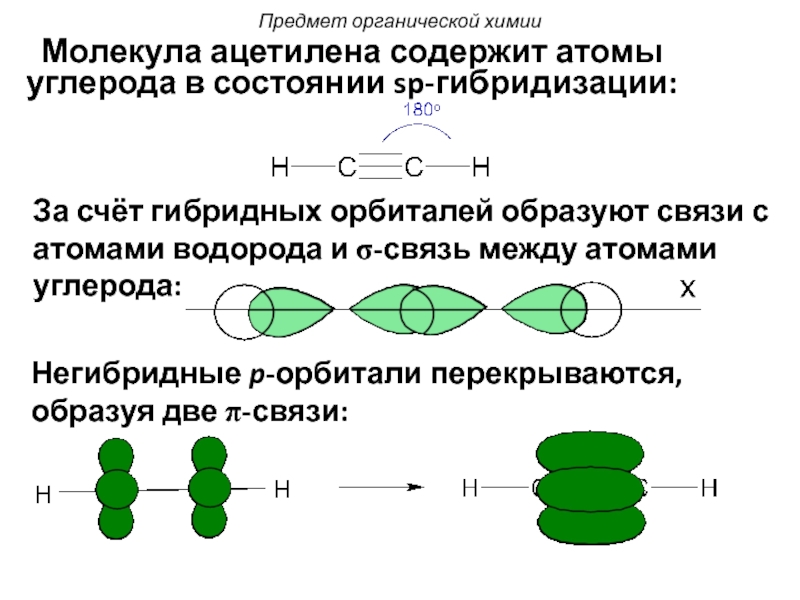
Слайд 33 Молекула ацетилена содержит атомы углерода в состоянии sp-гибридизации:
За счёт гибридных
Негибридные p-орбитали перекрываются, образуя две π-связи:
Предмет органической химии
Слайд 37 Какие из приведенных утверждений об алкенах и их
Тесты
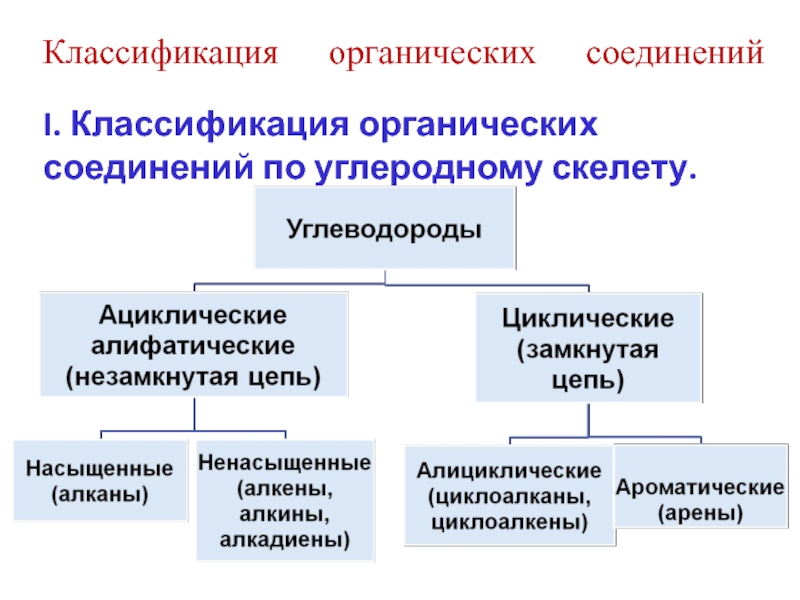
Слайд 38Классификация органических соединений
I. Классификация органических соединений по углеродному скелету.
Слайд 39Классификация органических соединений
В молекулу может входить от 1-1000 и более атомов
декан