- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория химического строения А. М. Бутлерова. Часть III презентация
Содержание
- 1. Теория химического строения А. М. Бутлерова. Часть III
- 2. Взаимное влияние атомов
- 3. Взаимное влияние может осуществляться
- 4. –I эффект проявляют заместители,
- 5. Мезомерный эффект – смещение
- 6. - М-эффект проявляют заместители, которые
- 7. +М-эффектом
- 8. π, π -сопряжение возникает тогда,
- 9. π, π −сопряжение в бутадиене: Основные положения теории А. М. Бутлерова
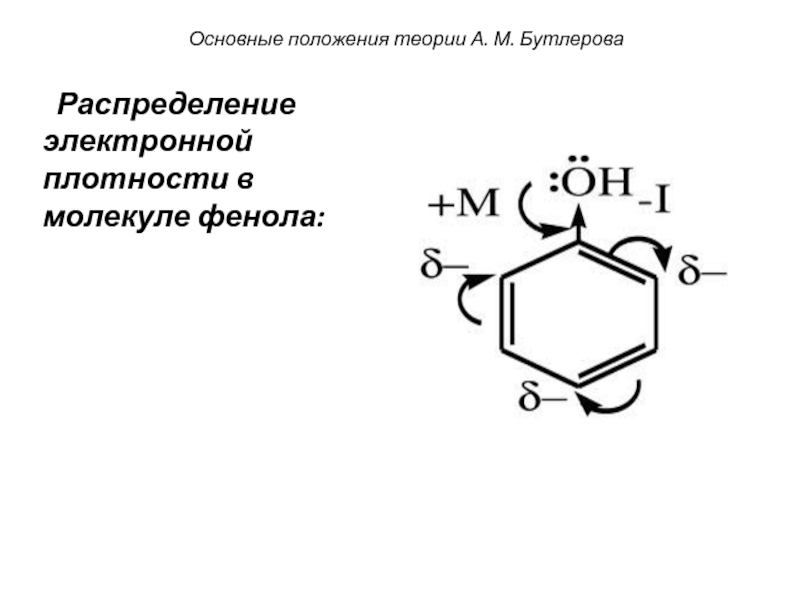
- 10. Основные положения теории А. М. Бутлерова Распределение электронной плотности в молекуле фенола:
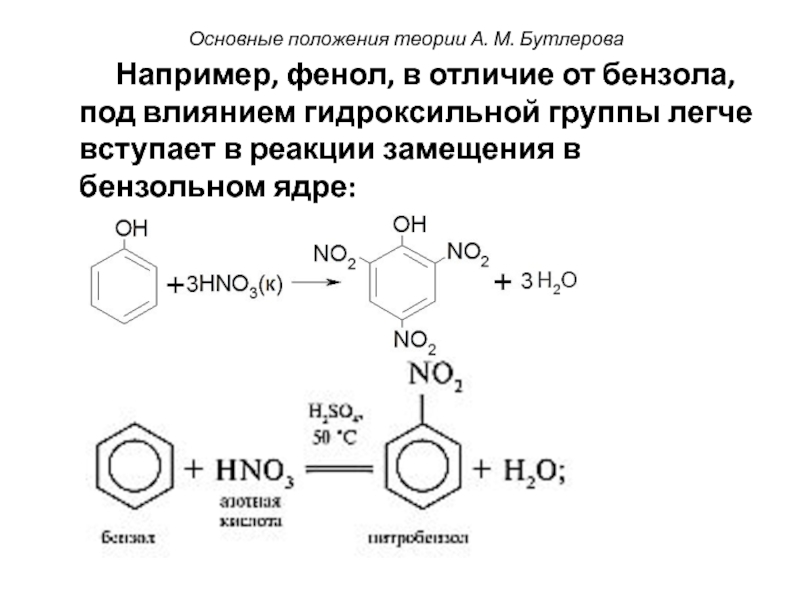
- 11. Например, фенол, в отличие
- 12. С другой стороны, под
- 13. Теория строения органических соединений: объяснила неясности и
- 14. Выбор главной углеродной цепи (родоначальной структуры). Нумерация
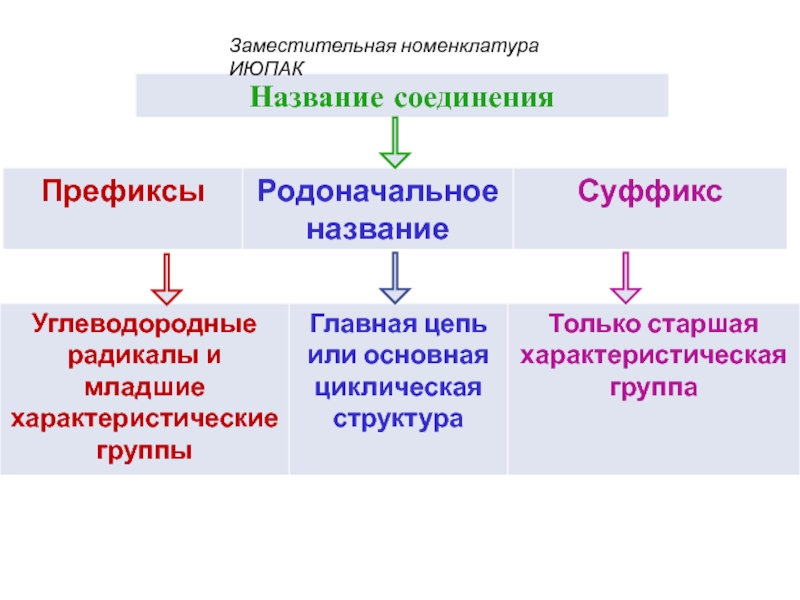
- 15. Заместительная номенклатура ИЮПАК
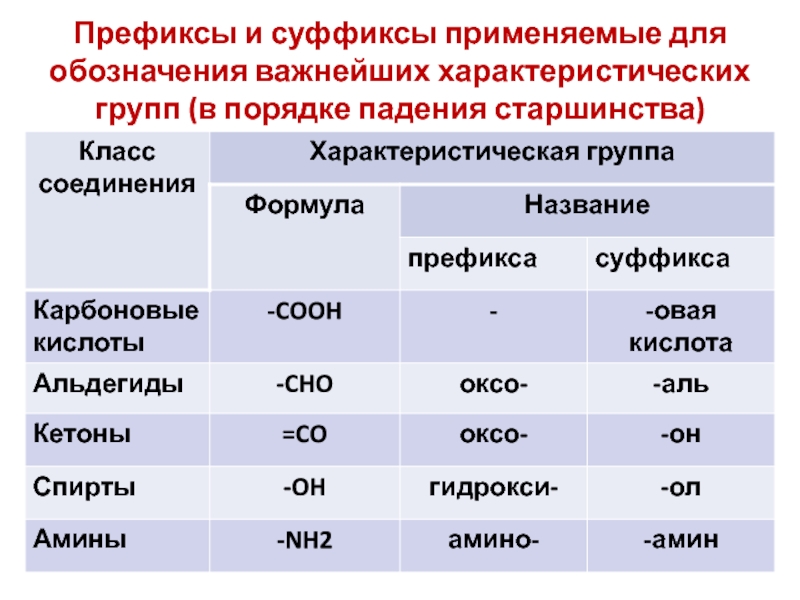
- 16. Префиксы и суффиксы применяемые для обозначения важнейших характеристических групп (в порядке падения старшинства)
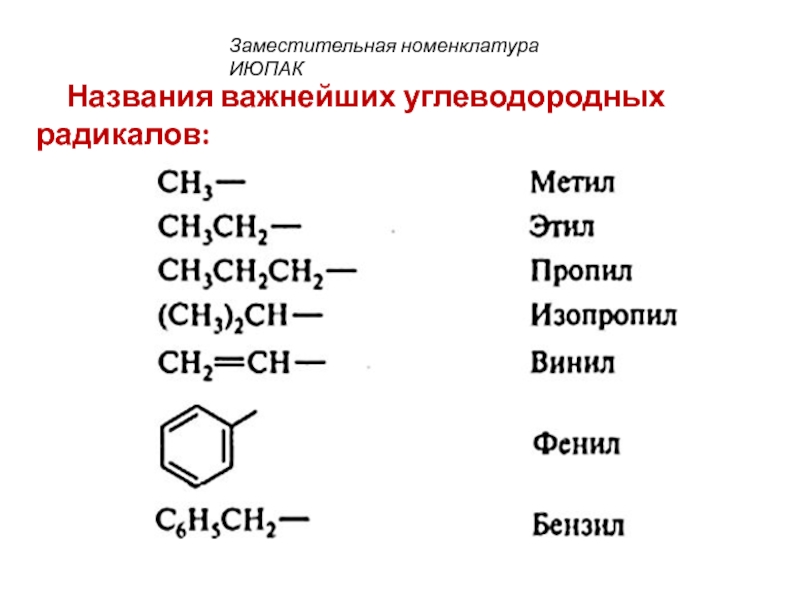
- 17. Названия важнейших углеводородных радикалов: Заместительная номенклатура ИЮПАК
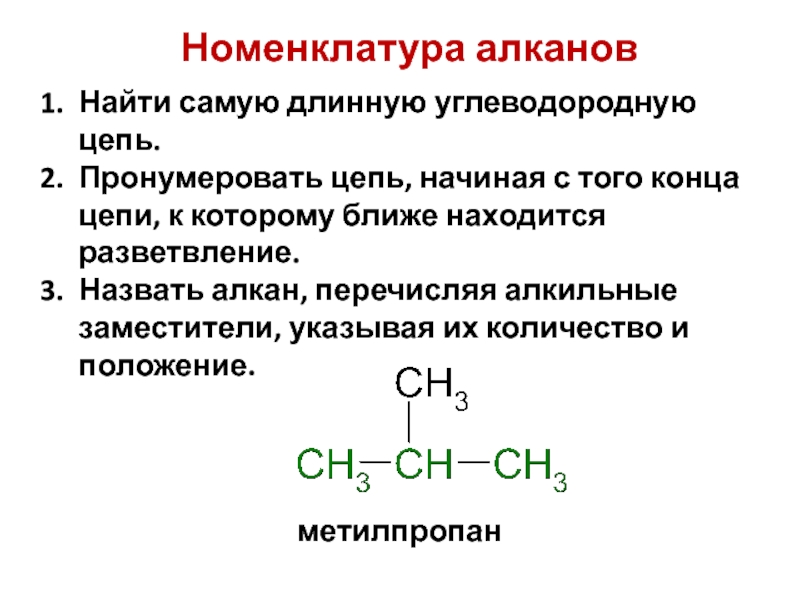
- 18. Номенклатура алканов Найти самую длинную углеводородную
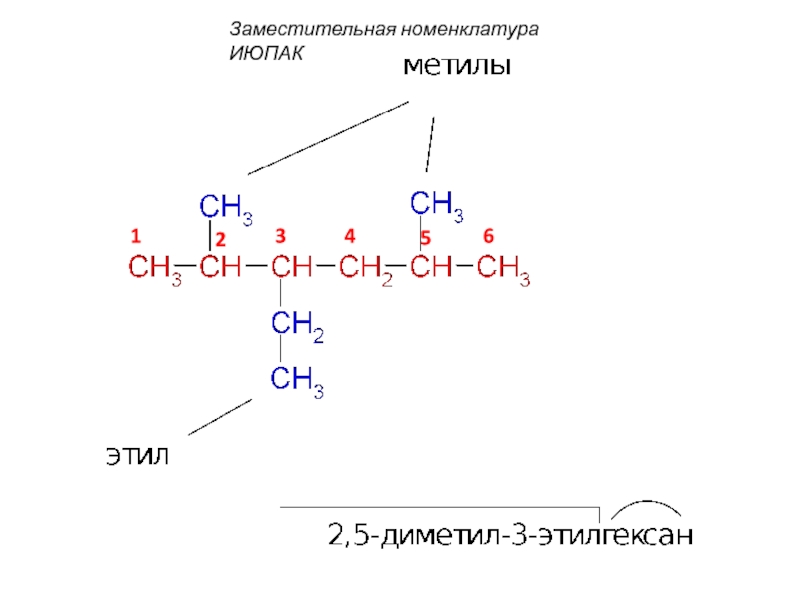
- 19. Заместительная номенклатура ИЮПАК 1 2 3 4 5 6
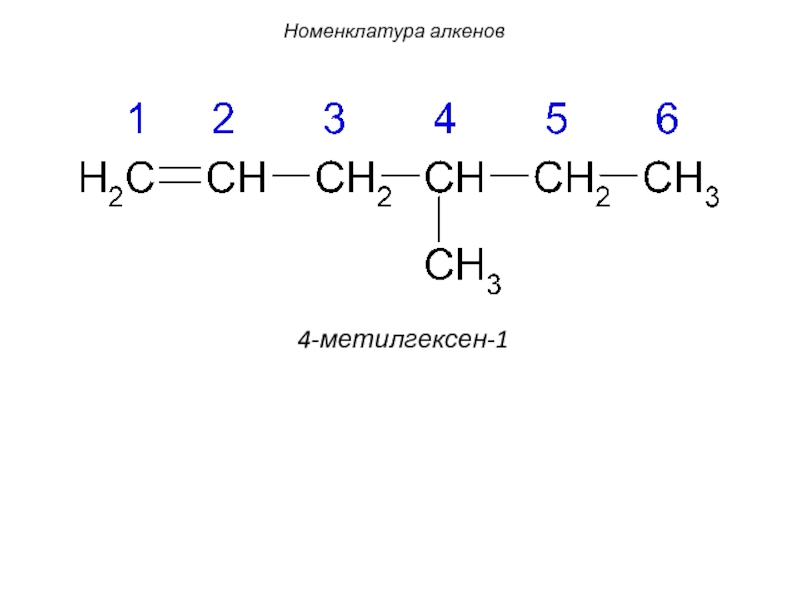
- 20. Номенклатура алкенов
- 21. 4-метилгексен-1 Номенклатура алкенов
- 22. Механизмы химических реакций Типы разрыва ковалентной связи электрофил нуклеофил
- 23. Механизмы химических реакций
- 24. Способ разрыва ковалентной связи с образованием свободных радикалов называется Тесты
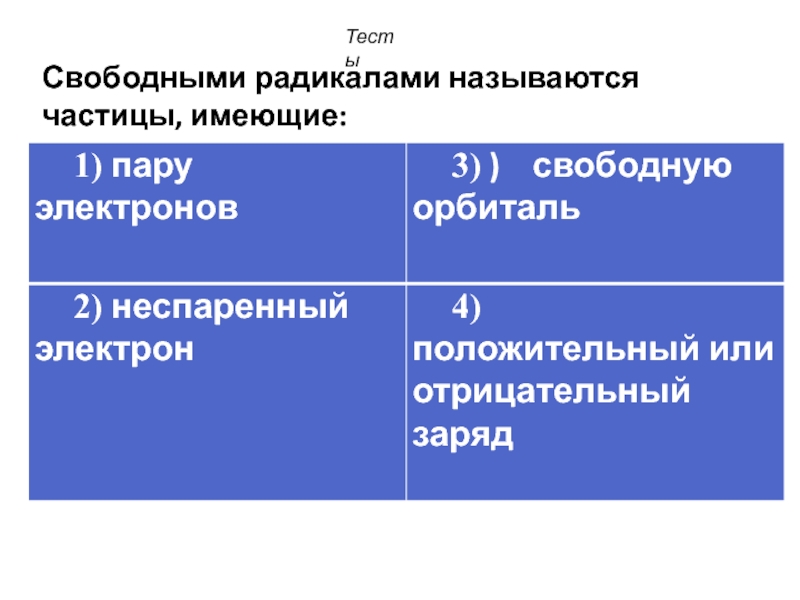
- 25. Свободными радикалами называются частицы, имеющие: Тесты
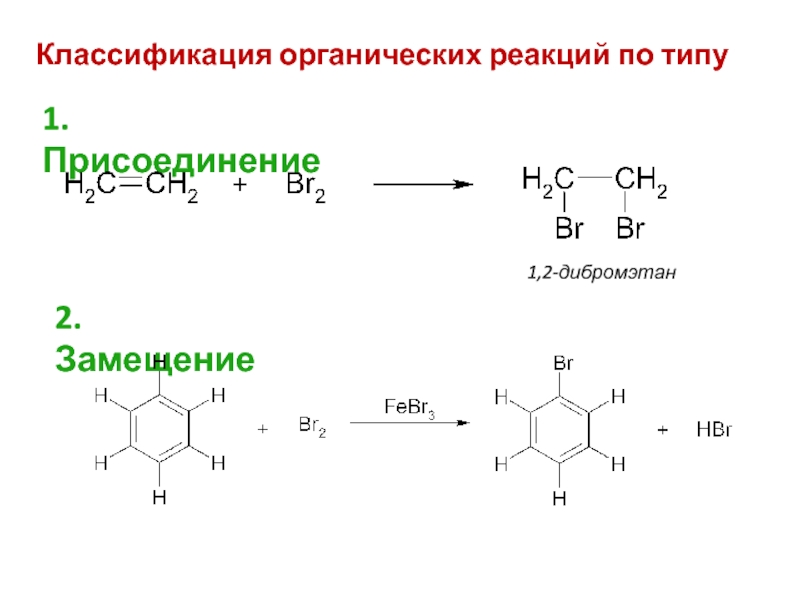
- 26. Классификация органических реакций по типу 1. Присоединение 1,2-дибромэтан 2. Замещение
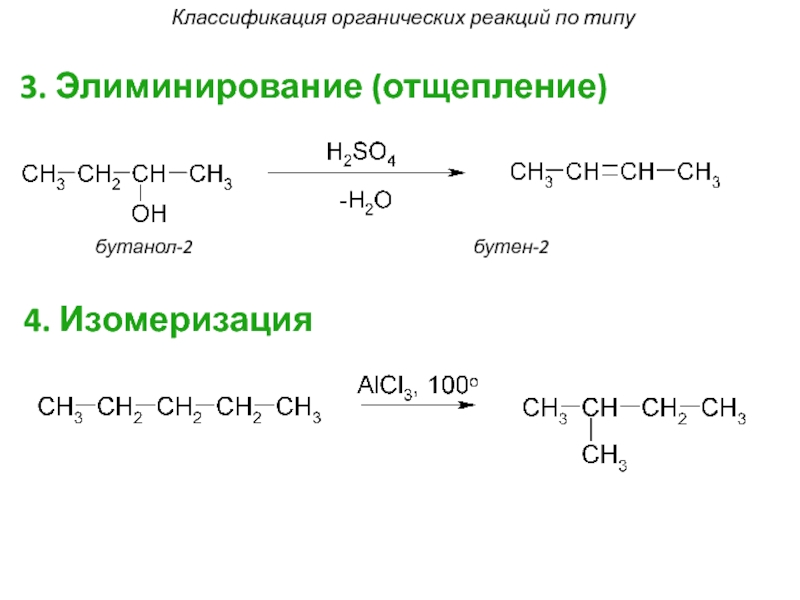
- 27. 3. Элиминирование (отщепление) бутанол-2
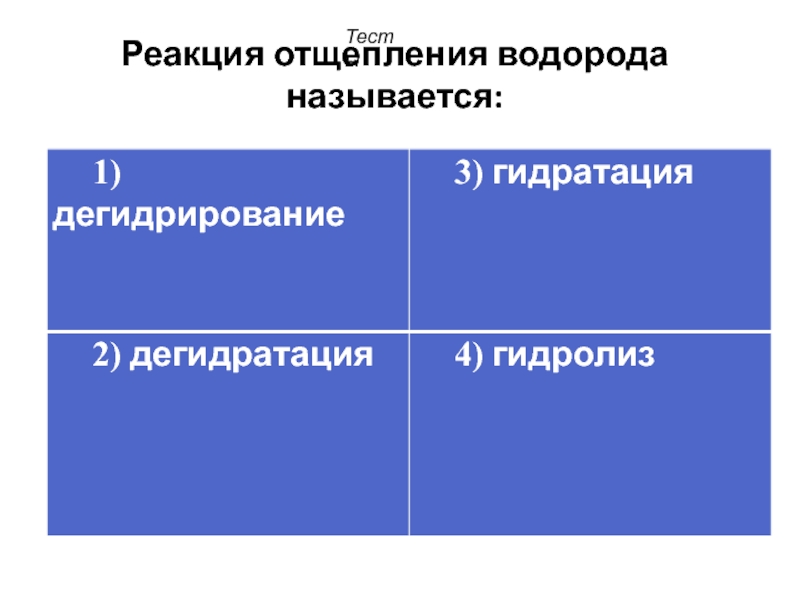
- 28. Реакция отщепления водорода называется: Тесты
- 29. СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
Слайд 1ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
ЦЕНТР ДОВУЗОВСКОЙ ПОДГОТОВКИ И ПРОФОРИЕНТАЦИИ
КАФЕДРА ХИМИИ
Теория химического строения
Третье положение теории А. М. Бутлерова.
Заместительная номенклатура ИЮПАК.
Механизмы химических реакций.
Составитель: доктор биологических наук, профессор, зав. кафедрой химии Степанова Ирина Петровна
Слайд 2 Взаимное влияние атомов обусловлено
смещением электронной плотности
атомов к другим. При этом на атомах
появляется частичный заряд: δ- или δ+
(дельта минус или дельта плюс).
Третье положение теории А. М. Бутлерова
Атомы или группы атомов, входящие в состав молекулы, взаимно влияют друг на друга, что сказывается на реакционной способности молекулы в целом.
Слайд 3 Взаимное влияние может осуществляться по системе σ-связей (индуктивный
Основные положения теории А. М. Бутлерова
Индуктивный эффект (I-эффект) – смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях атомов:
Слайд 4 –I эффект проявляют заместители, которые содержат атомы с
+I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: металлы (-Mg, -Li); насыщенные углеводородные радикалы (-CH3, -C2H5) и т.п.
Основные положения теории А. М. Бутлерова
Слайд 5 Мезомерный эффект – смещение электронной плотности по цепи
Сопряжение связей – взаимодействие между орбиталями отдельных фрагментов молекулы.
Основные положения теории А. М. Бутлерова
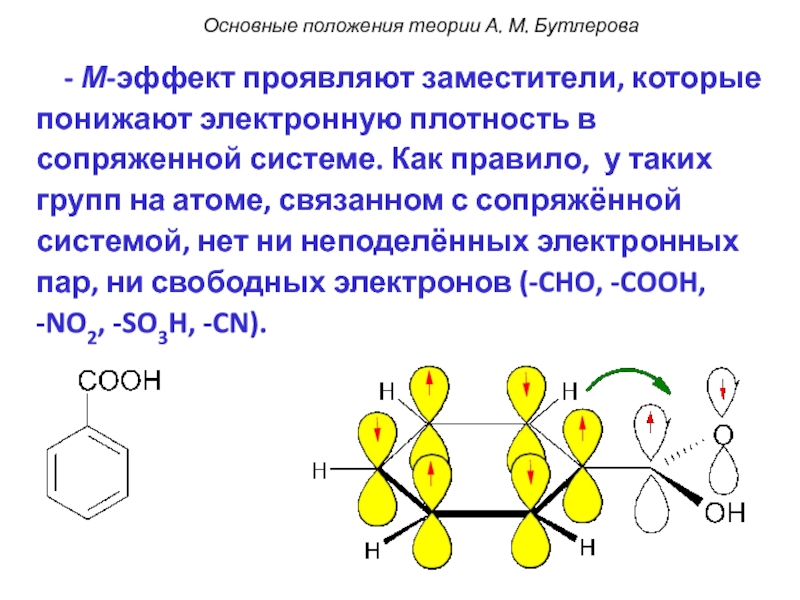
Слайд 6 - М-эффект проявляют заместители, которые понижают электронную плотность в
Основные положения теории А. М. Бутлерова
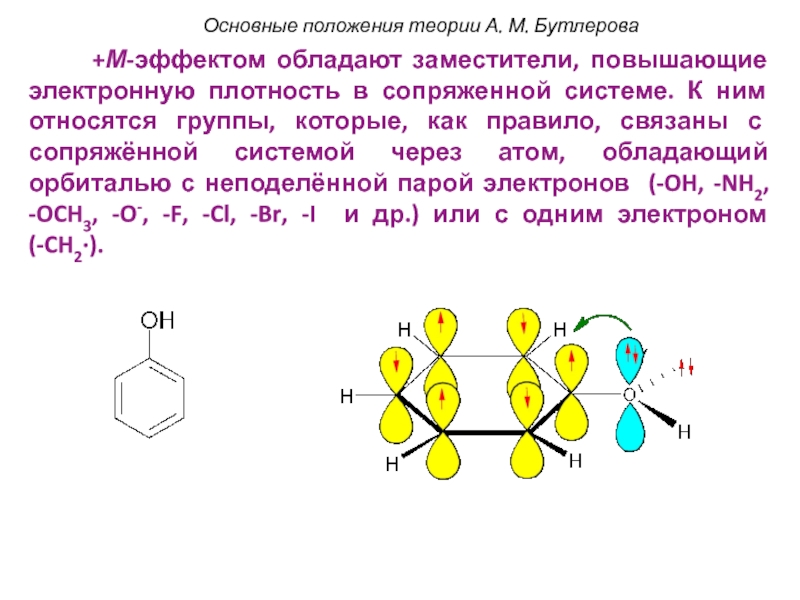
Слайд 7 +М-эффектом обладают заместители, повышающие электронную
Основные положения теории А. М. Бутлерова
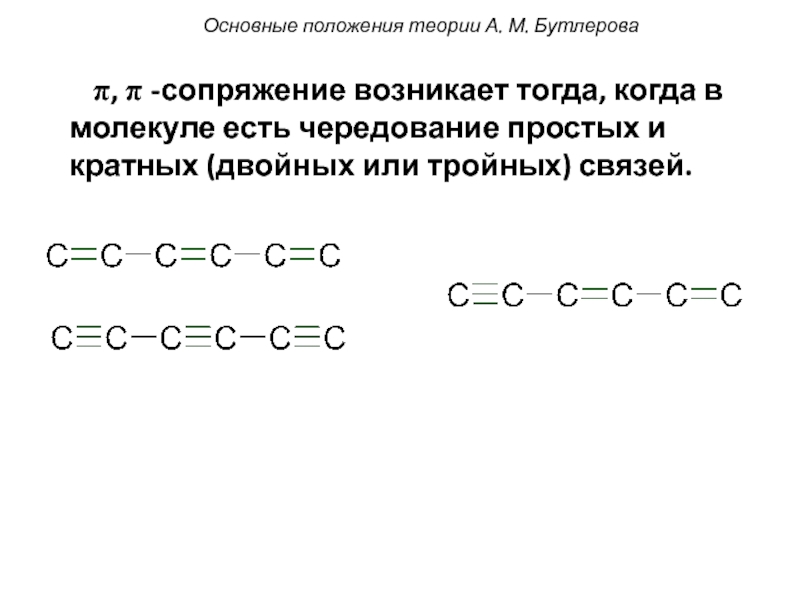
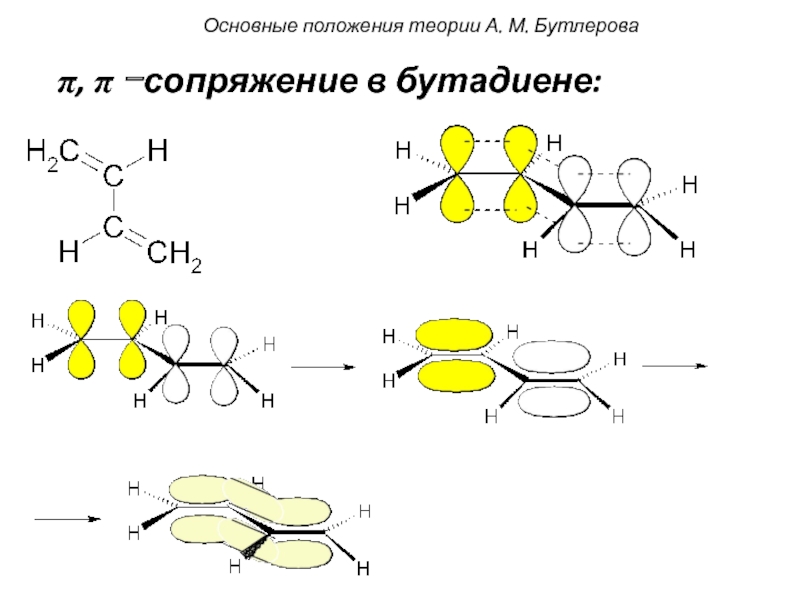
Слайд 8 π, π -сопряжение возникает тогда, когда в молекуле есть
Основные положения теории А. М. Бутлерова
Слайд 10Основные положения теории А. М. Бутлерова
Распределение
электронной плотности в молекуле
Слайд 11 Например, фенол, в отличие от бензола, под влиянием
Основные положения теории А. М. Бутлерова
Слайд 12 С другой стороны, под влиянием акцепторных свойств бензольного
Основные положения теории А. М. Бутлерова
Слайд 13 Теория строения органических соединений:
объяснила неясности и противоречия в знаниях об органических
творчески обобщила достижения в области химии,
определила качественно новый подход к пониманию строения соединений,
стала основой для объяснения и прогнозирования свойств органических веществ,
открыла путь для синтеза новых органических соединений.
Основные положения теории А. М. Бутлерова
Слайд 14Выбор главной углеродной цепи (родоначальной структуры).
Нумерация цепи.
Составление названия.
Характеристическая (функциональная)
Заместительная номенклатура ИЮПАК
Слайд 16Префиксы и суффиксы применяемые для обозначения важнейших характеристических групп (в порядке
Слайд 18Номенклатура алканов
Найти самую длинную углеводородную цепь.
Пронумеровать цепь, начиная с того конца
Назвать алкан, перечисляя алкильные заместители, указывая их количество и положение.
метилпропан
Слайд 20
Номенклатура алкенов
этан
пропан → пропен (пропилен)
1. Главная цепь обязательно должна включать в себя двойную связь, поэтому она может быть и не самой длинной.
2.Нумерацию начинают с того конца цепи, который ближе к двойной связи. Цифра, обозначающая положение двойной связи, ставится после суффикса -ен.
Слайд 273. Элиминирование (отщепление)
бутанол-2
4. Изомеризация
Классификация органических реакций по типу