- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома. (8 класс) презентация
Содержание
- 1. Строение атома. (8 класс)
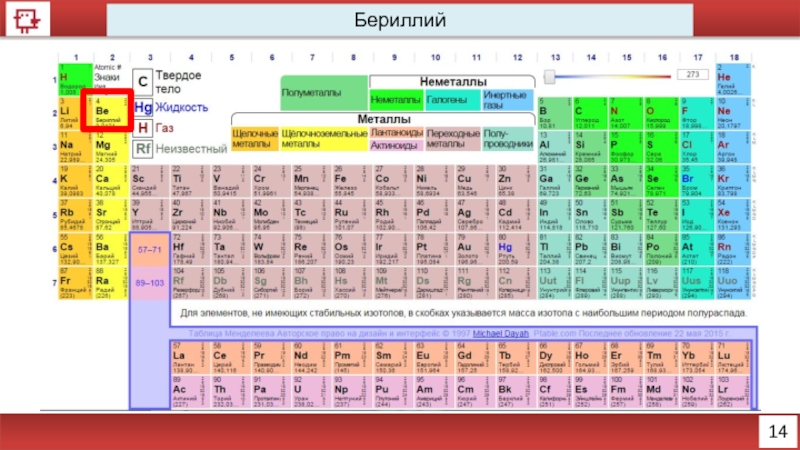
- 2. 14 Бериллий
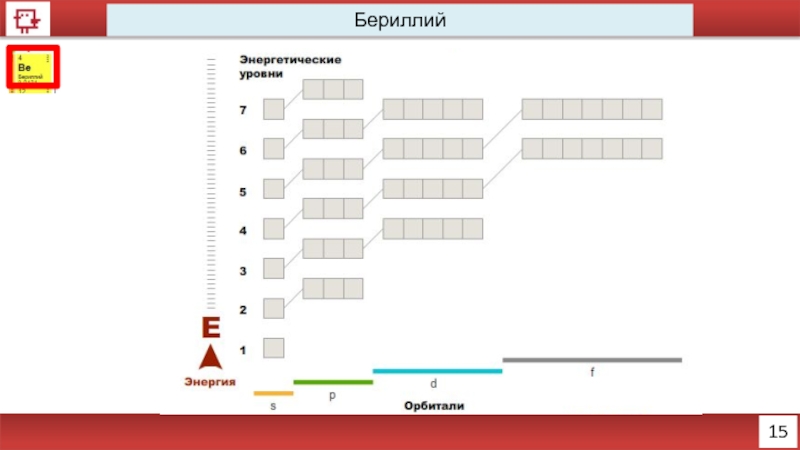
- 3. 15 Бериллий
- 4. 16 Бериллий Количество электронов
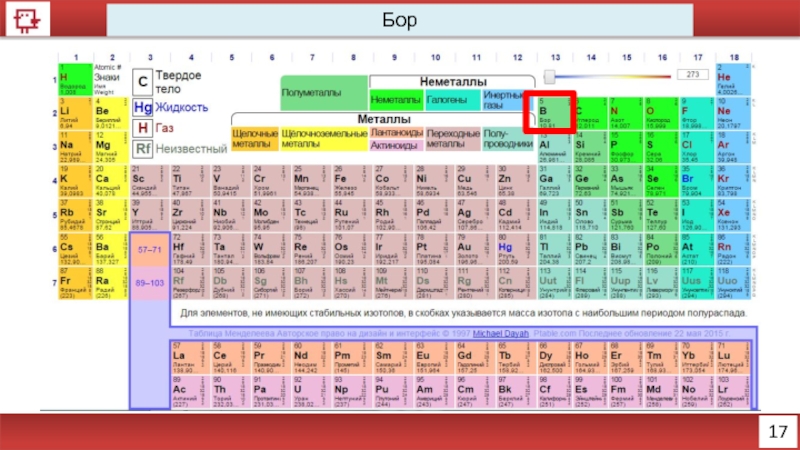
- 5. 17 Бор
- 6. 18 Бор
- 7. 19 Бор Количество электронов
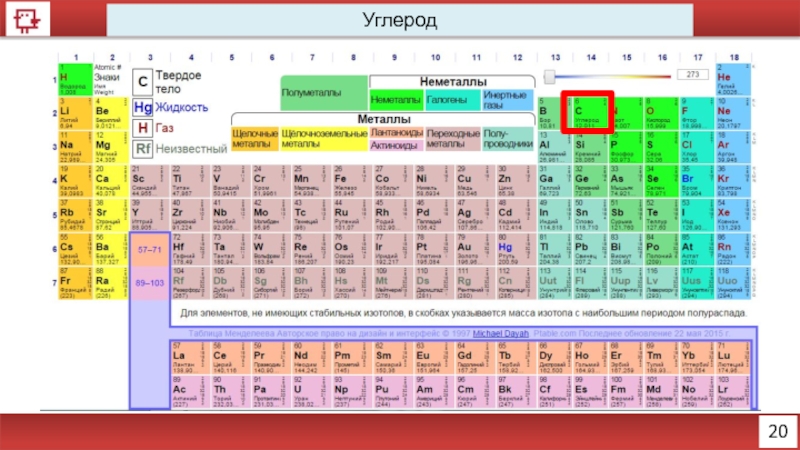
- 8. 20 Углерод
- 9. 21 Углерод
- 10. 22 Углерод Количество электронов
- 11. 23 Азот
- 12. 24 Азот
- 13. Азот Количество электронов на
- 14. Азот
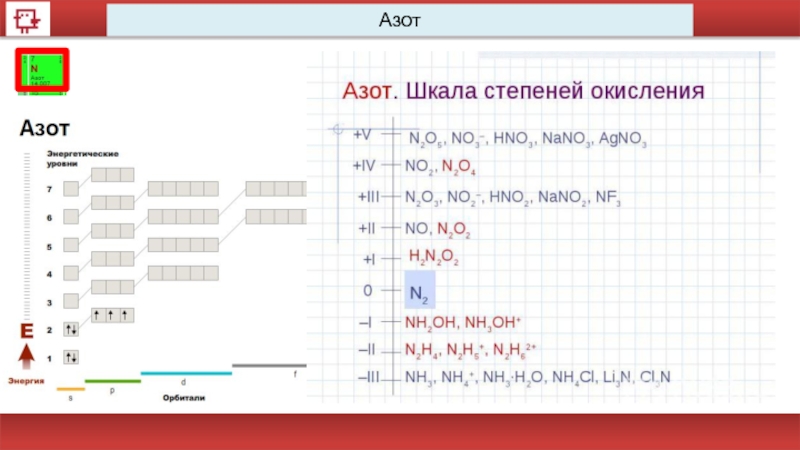
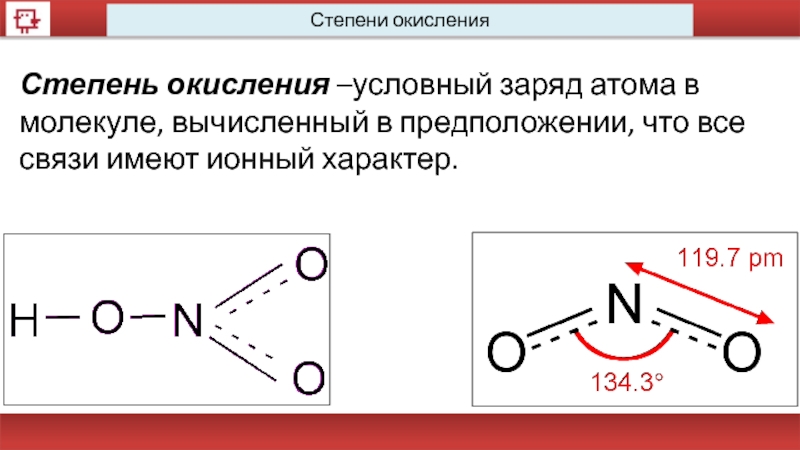
- 15. Степени окисления Степень окисления
- 16. Азот
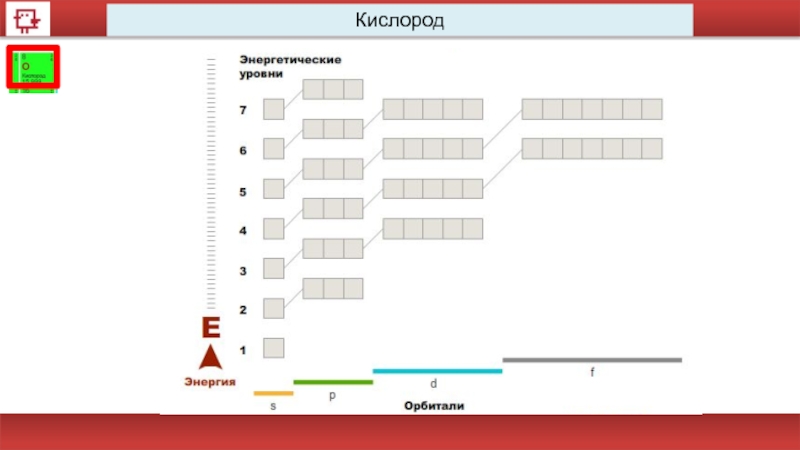
- 17. Кислород
- 18. Кислород Количество электронов на
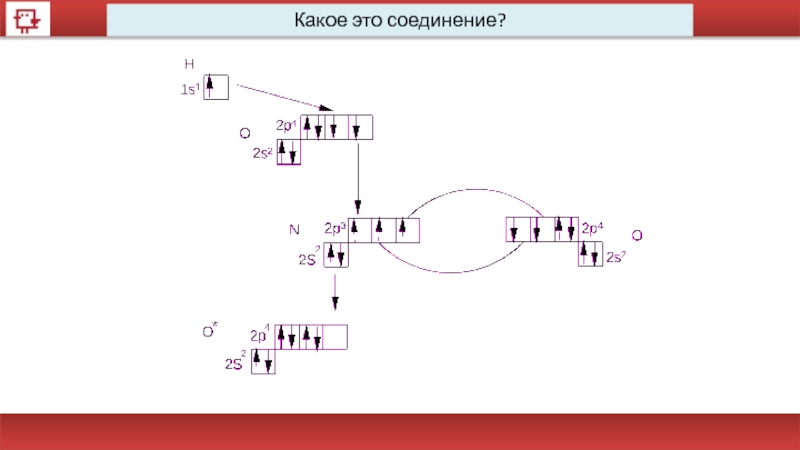
- 19. Какое это соединение?
- 20. 31 Фтор
- 21. 32 Фтор
- 22. 33 Фтор Количество электронов
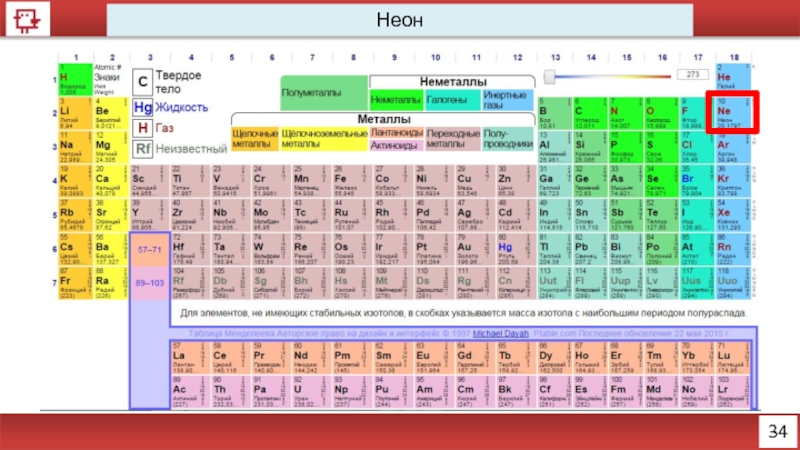
- 23. 34 Неон
- 24. 35 Неон
- 25. 36 Неон Количество электронов
- 26. 37 Неон
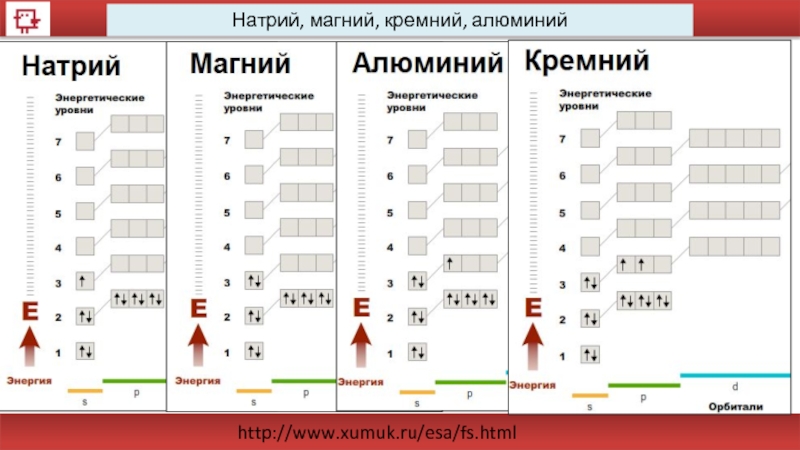
- 27. 38 Натрий
- 28. 39 Магний
- 29. 40 Алюминий
- 30. 41 Кремний
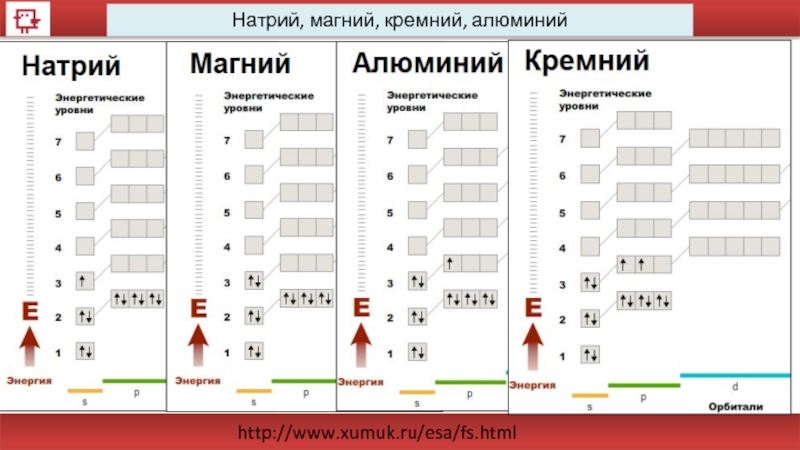
- 31. Натрий, магний, кремний, алюминий http://www.xumuk.ru/esa/fs.html
- 32. Урок 8 класса Типы химической связи.
- 33. Натрий, магний, кремний, алюминий http://www.xumuk.ru/esa/fs.html
- 34. Химическая связь Химическая связь
- 35. Химическая связь Наиболее сильными
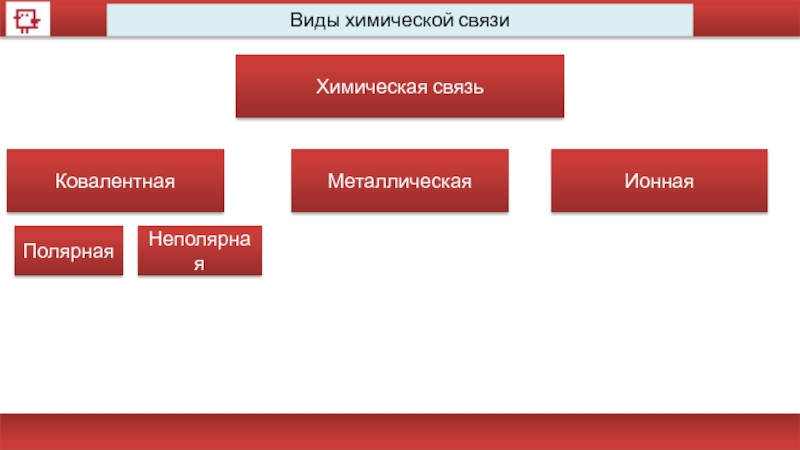
- 36. Виды химической связи Химическая связь Ковалентная Металлическая Ионная Полярная Неполярная
- 37. Виды химической связи Химическая
- 38. Виды химической связи Химическая
- 39. Электроотрицательность Электроотрицательность – свойство
- 40. Виды химической связи Химическая
- 41. Ковалентная связь Химическая
- 42. Ковалентная связь Ковалентная
- 43. Ковалентная связь При
- 44. Ковалентная связь
- 45. Ковалентная связь O O
- 46. Ковалентная связь H H
- 47. Ковалентная связь Химическая
- 48. Ковалентная связь Химическая
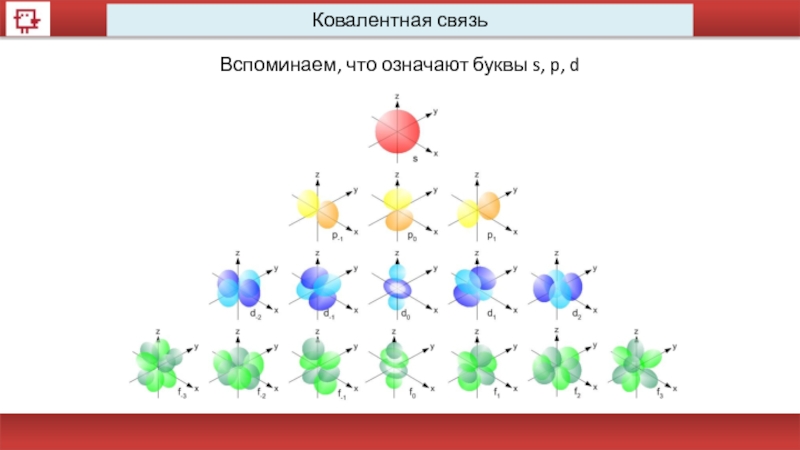
- 49. Ковалентная связь Вспоминаем, что означают буквы s, p, d
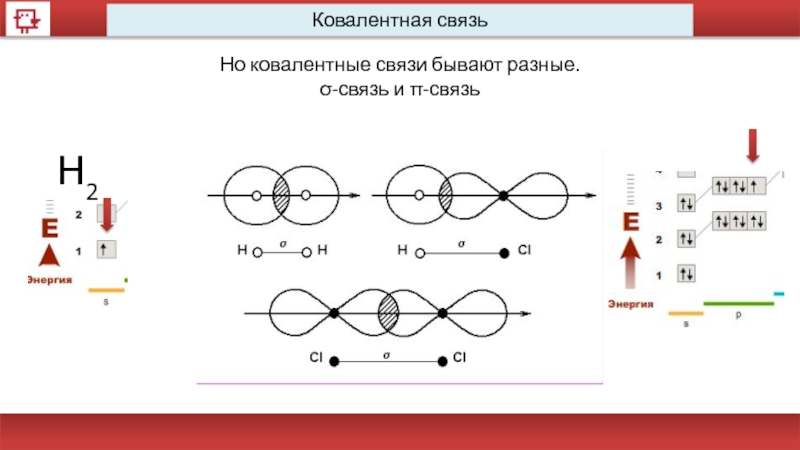
- 50. Ковалентная связь Но
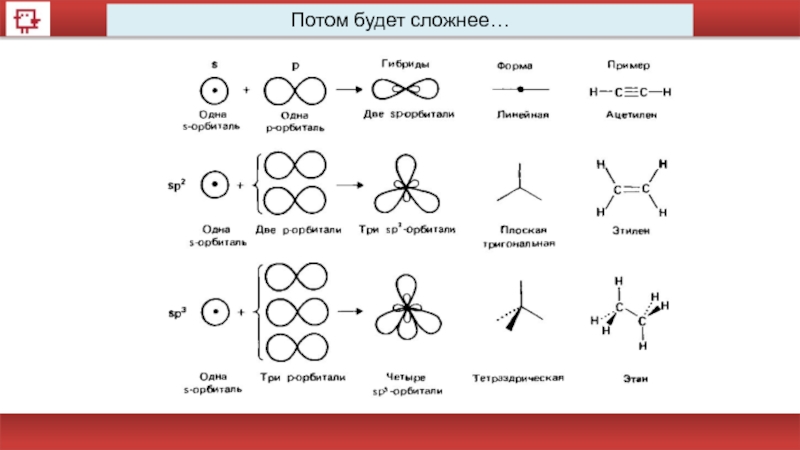
- 51. Потом будет сложнее…
- 52. Полярная и неполярная… Ковалентную
- 53. Валентность Валентность – способность атомов
- 54. Ковалентная связь Химическая
- 55. Ионная связь. Ионы
- 56. Ионная связь. Ионная
- 57. Ионная связь. Ионная
- 58. Ионная связь. Химическую
- 59. Степени окисления Степень окисления
- 60. Ковалентная связь Химическая
- 61. Металлическая связь Металлическая связь
Слайд 4
16
Бериллий
Количество электронов на внешнем уровне - 1
Радиус - 112 пм
Валентность -
Х.с.:
Be+ 2NaOH + 2H2O = Na2[Be(OH)4]
Ф.с. – относительно твёрдый, но хрупкий металл серебристо-белого цвета.
Слайд 7
19
Бор
Количество электронов на внешнем уровне - 3
Радиус - 98 пм
Валентность -
Х.с.:
B2O3 + 3H2O = H3BO3
4H3BO3 + NaOH = Na2B4O7
Ф.с. – бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество
Слайд 10
22
Углерод
Количество электронов на внешнем уровне - 4
Радиус - 91 пм
Валентность –
Х.с.:
С+1/2О2 = СО; СО + 1/2О2 = СО2
CO2 + H2O = H2CO3
Ф.с. – Матово-чёрный (графит), либо прозрачный (алмаз)
Слайд 13
Азот
Количество электронов на внешнем уровне - 5
Радиус - 92 пм
Валентность –
Х.с.:
N2O5 + H2O = 2HNO3
N2O3 + H2O = 2HNO2
Ф.с. – газ без цвета, вкуса и запаха.
Слайд 15
Степени окисления
Степень окисления –условный заряд атома в молекуле, вычисленный в предположении,
Слайд 18
Кислород
Количество электронов на внешнем уровне - 6
Радиус - 92 пм
Валентность –
Х.с.:
2H2+ O2 = 2H2O
Ф.с. – газ без цвета, вкуса и запаха.
Слайд 22
33
Фтор
Количество электронов на внешнем уровне - 7
Радиус - 73 пм
Валентность –
Х.с.:
H2 + F2 = 2HF
Xe + F2 = XeF2
Ф.с. – бесцветный газ
Слайд 25
36
Неон
Количество электронов на внешнем уровне - 8
Радиус – 38 (?) пм
Валентность
Х.с. - отсутствуют
Ф.с. – Инертный газ без цвета, вкуса и запаха
Слайд 34
Химическая связь
Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или
Принадлежность элементов к металлам и неметаллам определяется их способностью отдавать или присоединять электроны при химических реакциях
Начало периода
Середина периода
Конец периода
Металлы, легко отдают валентные электроны.
Элементы, атомы которых труднее отдают валентные электроны.
Элементы, атомы кторых энергично присоединяют валентные электроны.
Слайд 35
Химическая связь
Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко
Наоборот, неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны.
Слайд 37
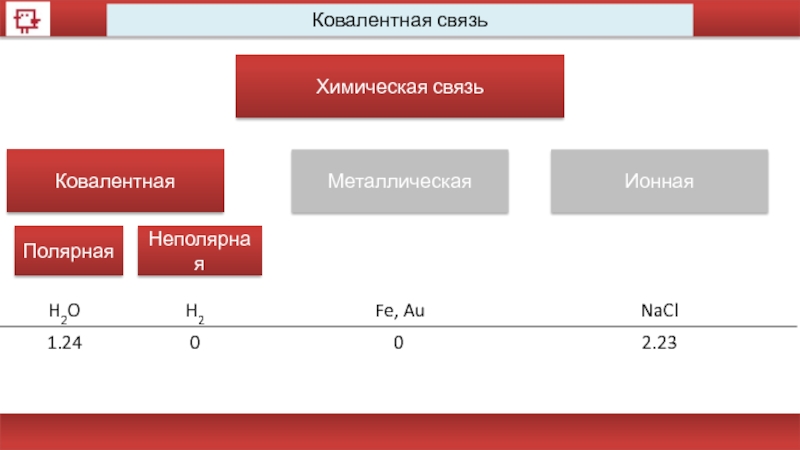
Виды химической связи
Химическая связь
Ковалентная
Металлическая
Ионная
Полярная
Неполярная
H2O
H2
Fe, Au
NaCl
Слайд 38
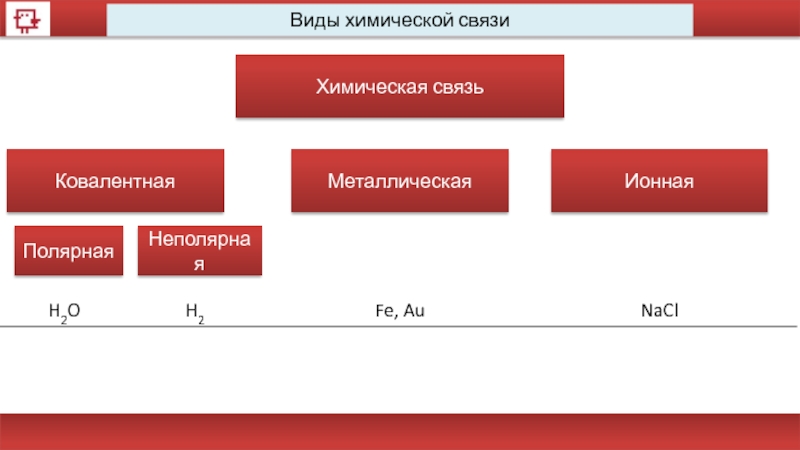
Виды химической связи
Химическая связь
Ковалентная
Металлическая
Ионная
Полярная
Неполярная
H2O
H2
Fe, Au
NaCl
Чем они отличаются?
Слайд 39
Электроотрицательность
Электроотрицательность – свойство атомов данного элемента оттягивать на себя электроны от
Слайд 40
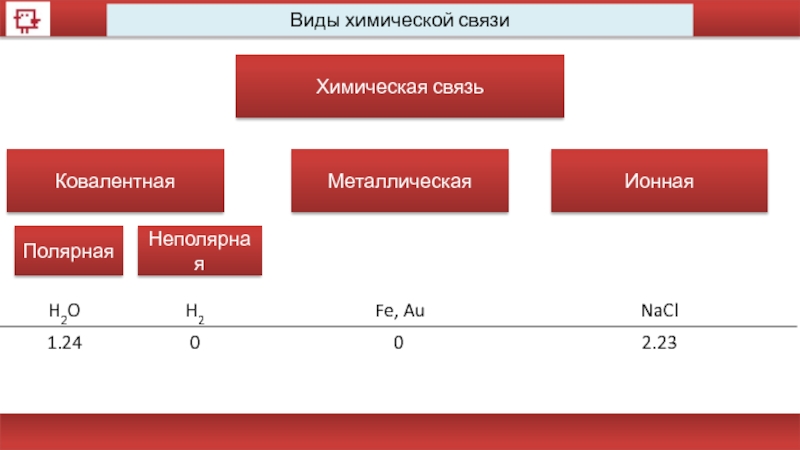
Виды химической связи
Химическая связь
Ковалентная
Металлическая
Ионная
Полярная
Неполярная
H2O
H2
Fe, Au
NaCl
1.24
0
0
2.23
Слайд 41
Ковалентная связь
Химическая связь
Ковалентная
Металлическая
Ионная
Полярная
Неполярная
H2O
H2
Fe, Au
NaCl
1.24
0
0
2.23
Слайд 42
Ковалентная связь
Ковалентная связь – это связь, образующуюся между атомами с
В слове «ковалентный» приставка «ко» означает «совместное участие», а «валентный» - способность.
H2, N2, O2, F2, Cl2
H2O, HCl
Слайд 43
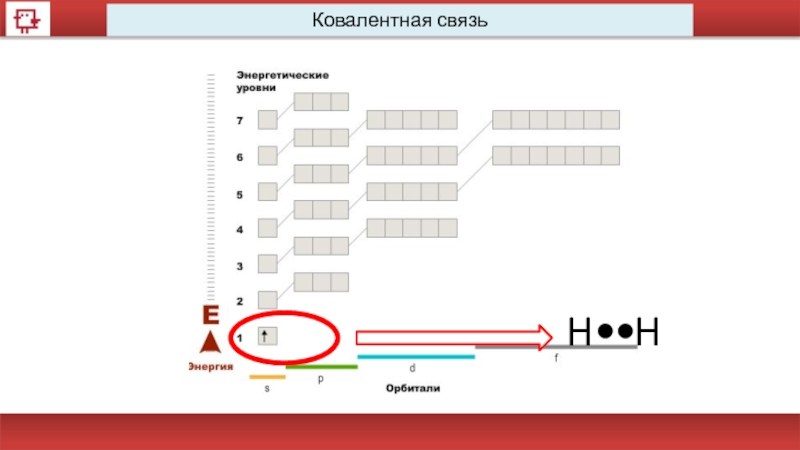
Ковалентная связь
При образовании ковалентной связи атомы объединяют свои электроны в
Эта новая оболочка содержит по возможности завершённое
число электронов и заменяет атомам их собственные незавершённые атомные оболочки.
Слайд 47
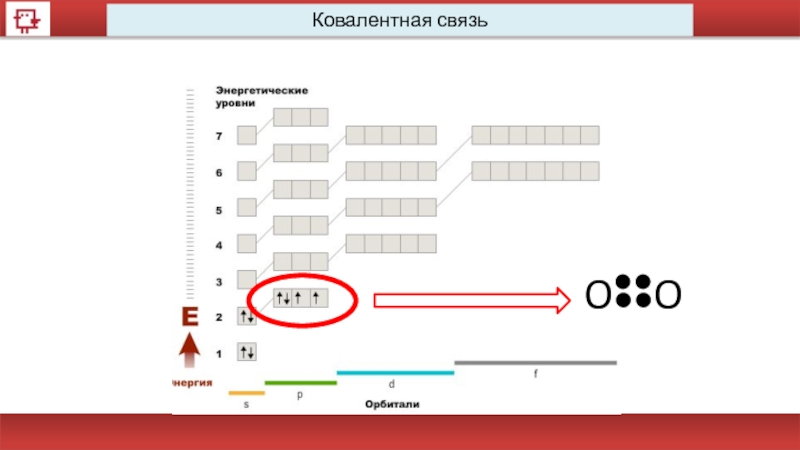
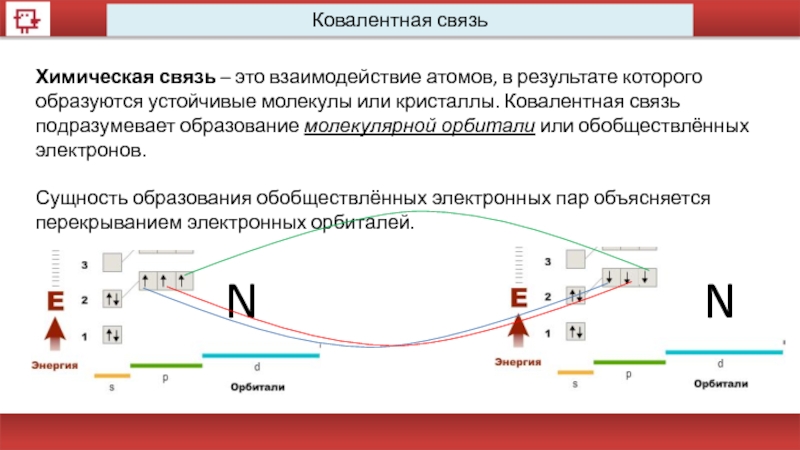
Ковалентная связь
Химическая связь – это взаимодействие атомов, в результате которого
Сущность образования обобществлённых электронных пар объясняется перекрыванием электронных орбиталей.
N
N
Слайд 48
Ковалентная связь
Химическая связь – это взаимодействие атомов, в результате которого
Сущность образования обобществлённых электронных пар объясняется перекрыванием электронных орбиталей.
N
N
Слайд 52
Полярная и неполярная…
Ковалентную химическую связь, которая образуется между атомами с одинаковой
Химическую связь, образованную атомами, электроотрицательности которых отличаются, но незначительно, называют ковалентной полярной связью. HCl, H2O, CH4.
Слайд 53
Валентность
Валентность – способность атомов химических элементов вступать в химические соединения с атомами
Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
Слайд 55
Ионная связь.
Ионы – это заряженные частицы, в которые превращаются атомы
e-, p+, H+, (OH)-, Na+, Ca2+, (NO3)-
Слайд 56
Ионная связь.
Ионная связь образуется при взаимодействии атомов элементов, электроотрицательности которых
Электроны почти полностью переходят от одного атома к другому.
Na+
Cl-
e-
Na F
Слайд 57
Ионная связь.
Ионная связь образуется при взаимодействии атомов элементов, электроотрицательности которых
Электроны почти полностью переходят от одного атома к другому.
Na+
Cl-
e-
Na F
Слайд 58
Ионная связь.
Химическую связь, возникающую между ионами в результате действия электростатических
NaCl, KF, LiCl.
Na+
Cl-
e-
Na F
Слайд 59
Степени окисления
Степень окисления –условный заряд атома в молекуле, вычисленный в предположении,
электроотрицательность элементов влияет на распределение электронов между взаимодействующими атомами.
Слайд 61
Металлическая связь
Металлическая связь — химическая связь между атомами в металлическом кристалле,
В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами.