- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома презентация
Содержание
- 1. Строение атома
- 2. Демокрит (460 - 379 г до
- 3. Дж. Дальтон (1766-1844) Открыл закон парциальных давлений
- 4. Атомистическая теория строения вещества Дальтона Все
- 5. 2.2.Природа электрона, протона, нейтрона. Модели атома Томпсона,
- 6. 1813 - 1834 г. Г.Дэви и М.Фарадей
- 7. В 1903 г. Дж.Томсон предложил одну из
- 8. В 1886 г. Э.Гольдштейн впервые регистрирует поток
- 9. В 1911 г. Эрнст Резерфорд предложил первую
- 10. Величина заряда ядра получила название порядкового номера
- 11. В 1913 г. Н.Бор предложил модель атома,
- 12. 2.3. Современная квантово-механическая модель атома. Положение электрона
- 13. В 1926 г. Шредингер предложил математическую модель
- 14. Энергетическая диаграмма электронов в атоме и так
- 15. l – орбитальное квантовое число, определяет форму
- 16. m – магнитное квантовое число, характеризует
- 17. s- спиновое квантовое число. При каждом заданном
- 18. Принципы построения электронных орбиталей Принцип запрета Паули:
- 20. Принцип минимальной энергии: орбитали заполняются электронами в
- 21. Принцип максимальной мультиплетности (правило Гунда): устойчивому состоянию
- 22. Дифференцирующим называется электрон, который отличает электронную оболочку
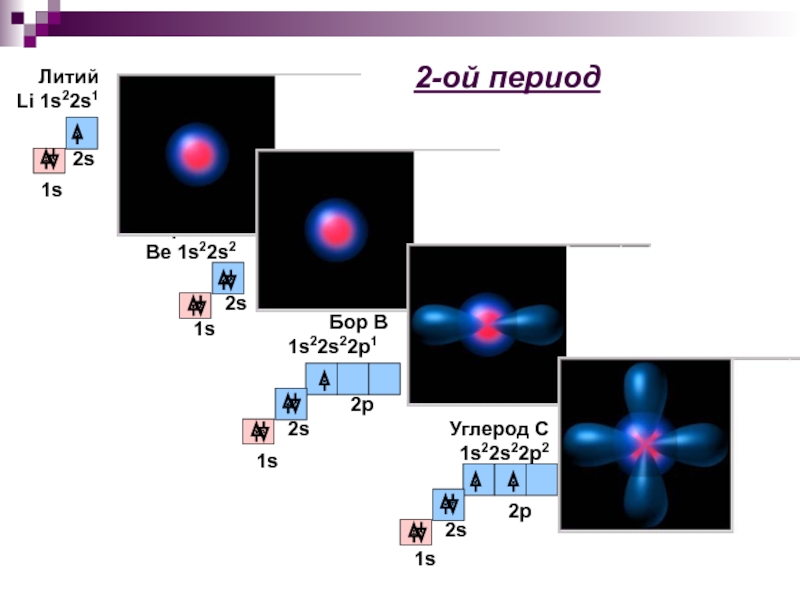
- 23. 2-ой период Литий Li 1s22s1 2s
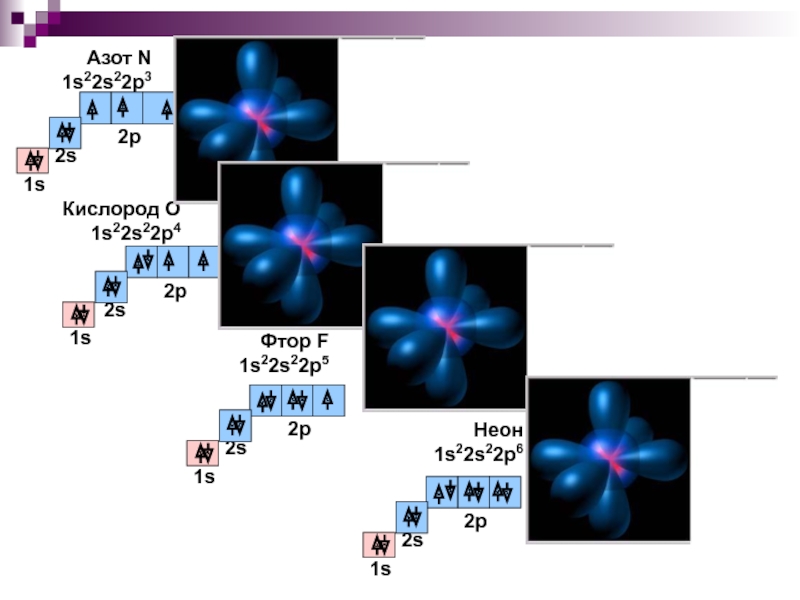
- 24. Азот N 1s22s22p3 Кислород О 1s22s22p4 Фтор F 1s22s22p5 Неон 1s22s22p6
- 25. Если дифференцирующий электрон находится на s-подуровне, то
Слайд 2Демокрит
(460 - 379 г до н.э.)
Создал атомистическую теорию строения вещества
Создал
Создал гипотезу о происхождении культуры, ремесел, искусств и языка
Слайд 3Дж. Дальтон
(1766-1844)
Открыл закон парциальных давлений газов
Открыл закон кратных отношений
Составил первую
Создал одну из первых систем символов химических элементов
Автор монографии «Новая система химической философии», в которой развита атомистическая теория строения вещества
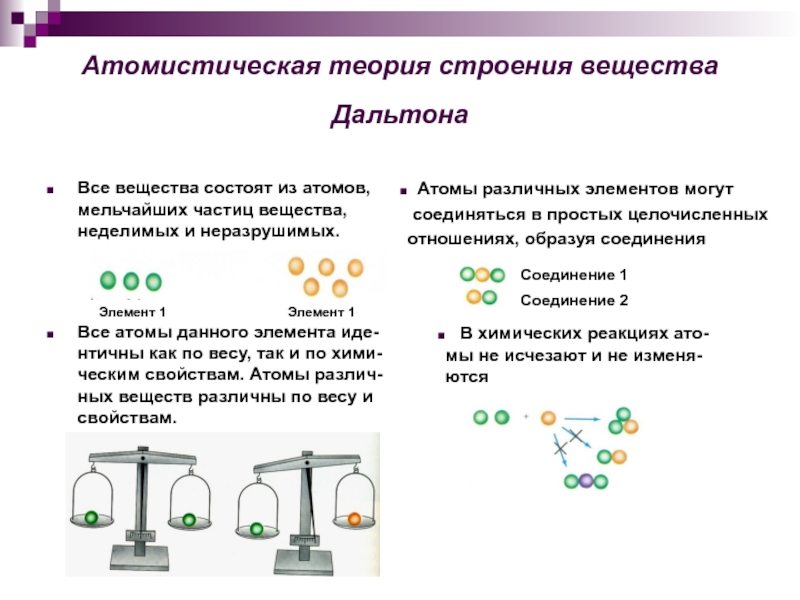
Слайд 4Атомистическая теория строения вещества Дальтона
Все вещества состоят из атомов, мельчайших
Все атомы данного элемента иде-нтичны как по весу, так и по хими-ческим свойствам. Атомы различ-ных веществ различны по весу и свойствам.
Атомы различных элементов могут
соединяться в простых целочисленных
отношениях, образуя соединения
В химических реакциях ато-мы не исчезают и не изменя-ются
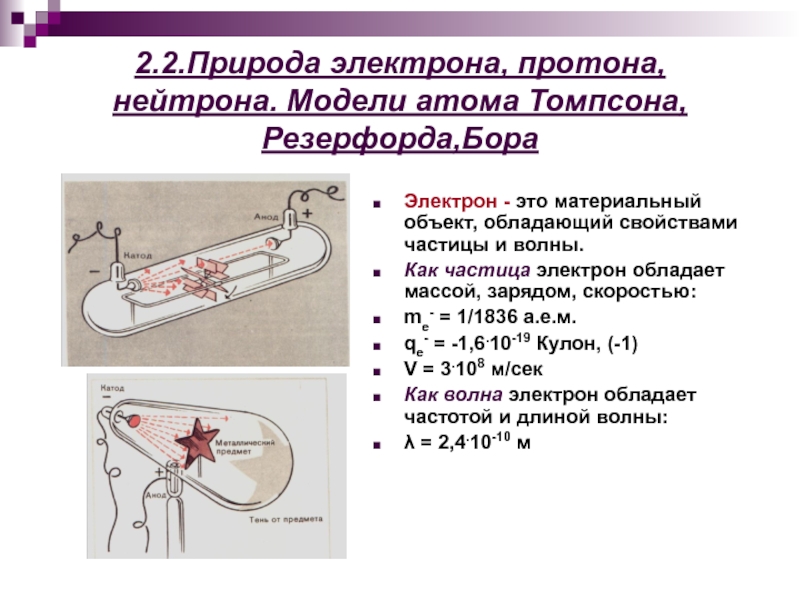
Слайд 52.2.Природа электрона, протона, нейтрона. Модели атома Томпсона, Резерфорда,Бора
Электрон - это материальный
Как частица электрон обладает массой, зарядом, скоростью:
me- = 1/1836 а.е.м.
qe- = -1,6.10-19 Кулон, (-1)
V = 3.108 м/сек
Как волна электрон обладает частотой и длиной волны:
λ = 2,4.10-10 м
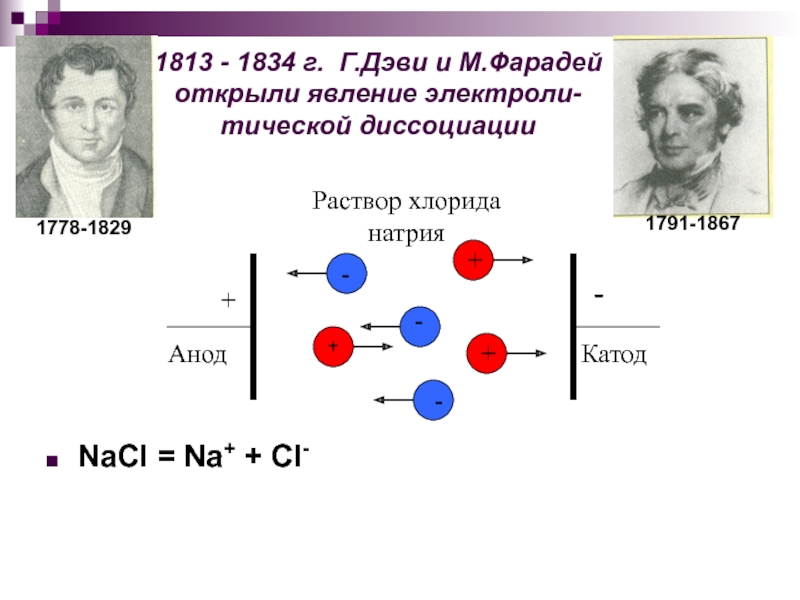
Слайд 61813 - 1834 г. Г.Дэви и М.Фарадей открыли явление электроли-
тической диссоциации
NaCl
+
Раствор хлорида натрия
Слайд 7В 1903 г. Дж.Томсон предложил одну из первых моделей строения атома,
По Томсону атом пред-ставлял собой «море положительного электри-чества» с колеблющими-ся в нем электронами. Суммарный отрицатель-ный заряд электронов атома приравнивался суммарному положитель-ному заряду.
Слайд 8В 1886 г. Э.Гольдштейн впервые регистрирует поток положительно заряженных лучей в
Протон - материальный объект со следующими характеристиками:
mp = 1 а.е.м.
qp = +1,6.10-19 Кулон, (+1)
Нейтрон - материальный объект со следующими характеристиками:
mn = 1 а.е.м.
qn = 0 Кулон.
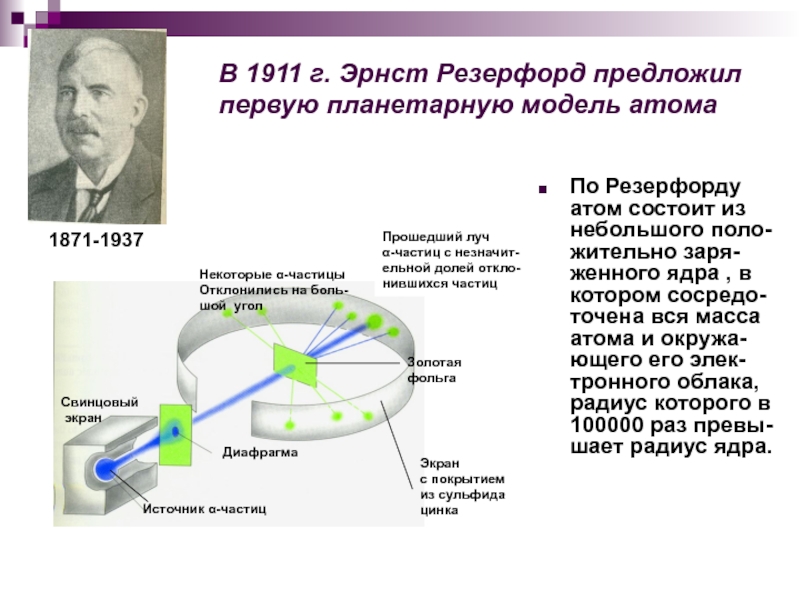
Слайд 9В 1911 г. Эрнст Резерфорд предложил первую планетарную модель атома
По Резерфорду
Слайд 10Величина заряда ядра получила название порядкового номера элемента.
Атомы одного элемента с
Ядро атома – это центральная его часть, которая имеет положительный заряд, равный порядковому номеру элемента, и массу, практически равную массе атома элемента. Масса ядра равна сумме масс протонов и нейтронов, входящих в его состав.
Слайд 11В 1913 г. Н.Бор предложил модель атома, учитывающую дискретность спектров излучения
1. Из бесконечного чис-ла орбит , возможных с точки зрения класси-ческой механики, до-пустимы лишь опреде-ленные дискретные орбиты, по которым электрон движется, не испуская и не поглощая энергию.
2. При переходе с одной такой орбиты на другую электрон приобретает или теряет энергию только целочисленными квантами: E2 –E1 = hν
Слайд 122.3. Современная квантово-механическая модель атома. Положение электрона в атоме.
В качестве модели
Слайд 13В 1926 г. Шредингер предложил математическую модель , описывающую положение электронов
d2ψ/dx 2 + d2ψ/dy 2 + d2ψ/dz 2 + (8πme/h)[E-V(x,y,z)] V(x,y,z) = 0
Каждому решению уравнения Шредингера отвечает одна электронная орбиталь, которая определяет энергию и распределение электрона в пространстве.
Для решения уравнения Шредингера приходится ввести три постоянные: n, l и m, которые получили название квантовых чисел. Каждому набору квантовых чисел соответствует одно решение уравнения Шредингера и соответственно одна орбиталь.
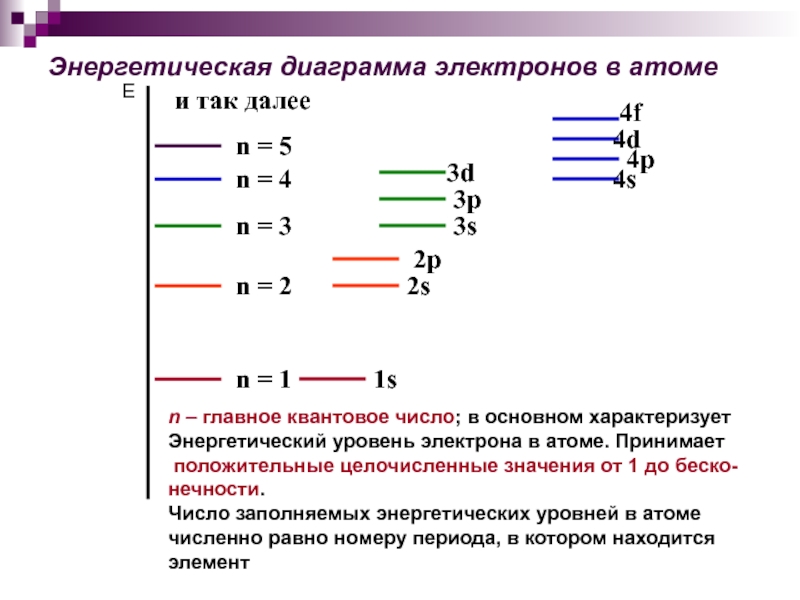
Слайд 14Энергетическая диаграмма электронов в атоме
и так далее
n – главное квантовое число;
Энергетический уровень электрона в атоме. Принимает
положительные целочисленные значения от 1 до беско-
нечности.
Число заполняемых энергетических уровней в атоме
численно равно номеру периода, в котором находится
элемент
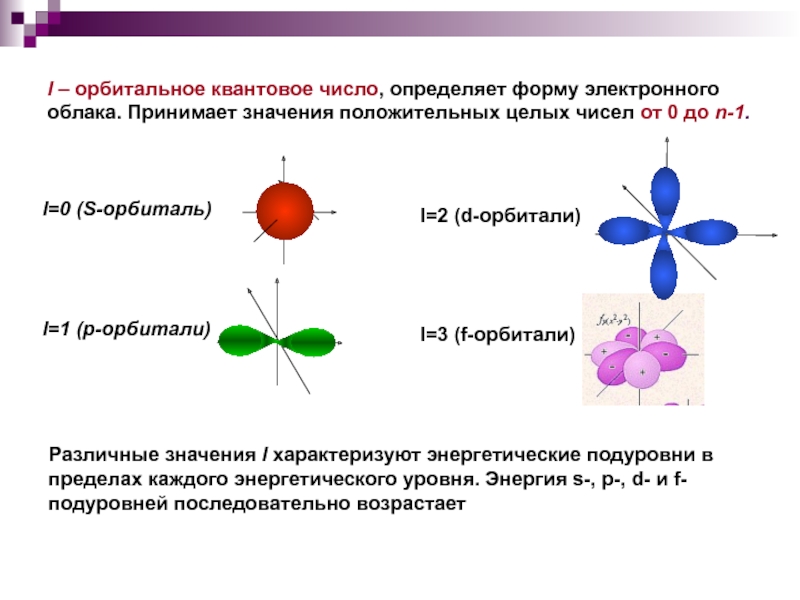
Слайд 15l – орбитальное квантовое число, определяет форму электронного облака. Принимает значения
l=0 (S-орбиталь)
l=1 (р-орбитали)
l=2 (d-орбитали)
Различные значения l характеризуют энергетические подуровни в пределах каждого энергетического уровня. Энергия s-, p-, d- и f-подуровней последовательно возрастает
Слайд 16
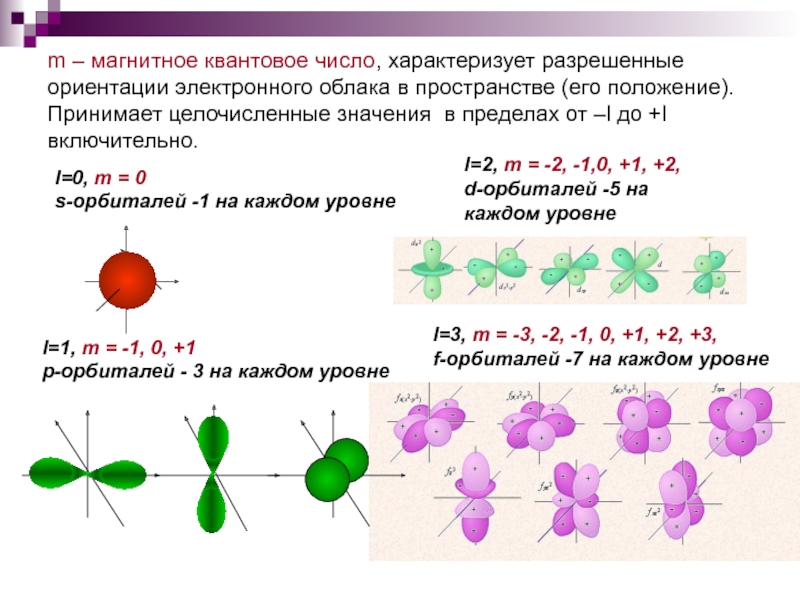
m – магнитное квантовое число, характеризует разрешенные ориентации электронного облака в
l=0, m = 0
s-орбиталей -1 на каждом уровне
l=1, m = -1, 0, +1
р-орбиталей - 3 на каждом уровне
l=2, m = -2, -1,0, +1, +2,
d-орбиталей -5 на каждом уровне
l=3, m = -3, -2, -1, 0, +1, +2, +3,
f-орбиталей -7 на каждом уровне
Слайд 17s- спиновое квантовое число. При каждом заданном значении m спиновое квантовое
Слайд 18Принципы построения электронных орбиталей
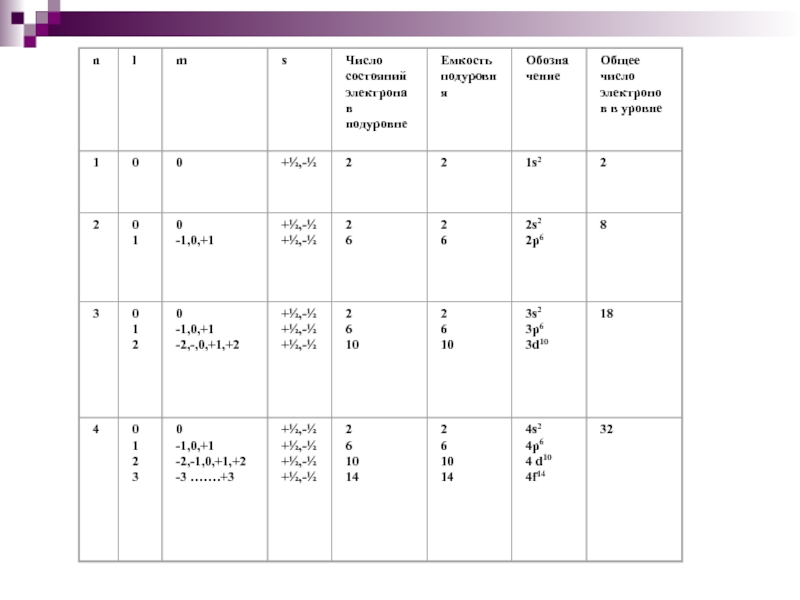
Принцип запрета Паули: в атоме не может быть
1-ый уровень: 2е-
2-ой уровень: 8 е-
3-ий уровень: 18 е-
4-ый уровень: 32е-
N = 2n2
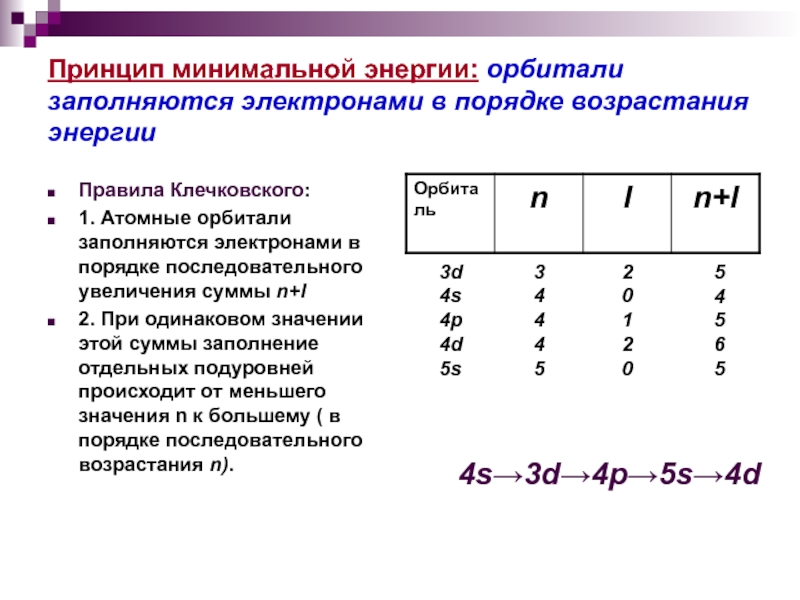
Слайд 20Принцип минимальной энергии: орбитали заполняются электронами в порядке возрастания энергии
Правила Клечковского:
1. Атомные орбитали заполняются электронами в порядке последовательного увеличения суммы n+l
2. При одинаковом значении этой суммы заполнение отдельных подуровней происходит от меньшего значения n к большему ( в порядке последовательного возрастания n).
4s→3d→4p→5s→4d
3d
4s
4p
4d
5s
3
4
4
4
5
2
0
1
2
0
5
4
5
6
5
Слайд 21Принцип максимальной мультиплетности (правило Гунда): устойчивому состоянию атома соответствует такое распределение
Σ|s| = | ½ + ½ + ½| = 1 ½
Σ|s| = | -½ +½ - ½| = ½
Σ|s| = | ½ + ½ - ½| = ½
Слайд 22Дифференцирующим называется электрон, который отличает электронную оболочку данного элемента от электронной
1-ый период
Водород
Н
Гелий
He
1s1
1s2