- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли в свете ТЭД презентация
Содержание
- 1. Соли в свете ТЭД
- 2. Тема урока: соли в свете ТЭД
- 3. Определение Соли – сложные вещества,
- 4. Диссоциация
- 5. H H SO4 Na Na
- 6. Название средних солей
- 7. H H SO4 Na NaHSO4
- 8. Название кислых солей Гидро+ название кислотного
- 9. Ca OH OH Cl CaOHCl
- 10. Название основных солей Гидроксо+ название кислотного
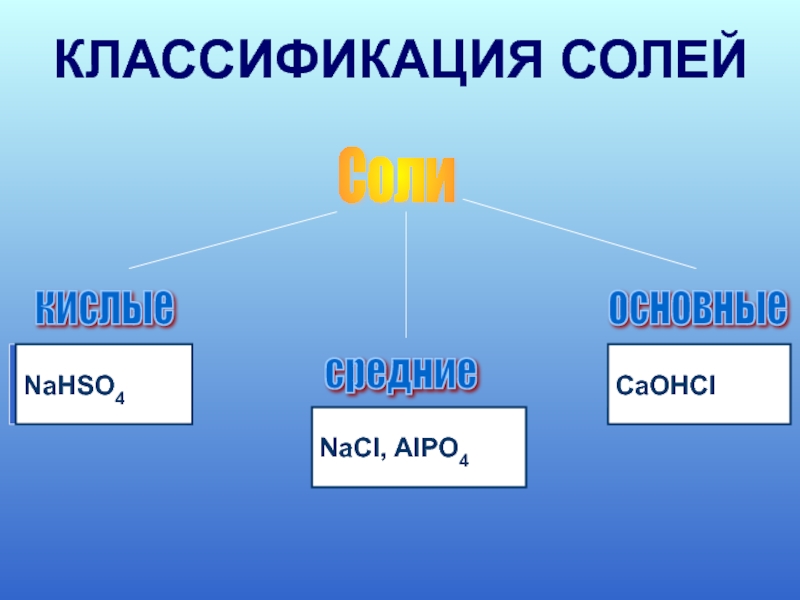
- 11. Соли кислые средние
- 12. Лабораторная работа 1. соль1 + соль2
- 13. Лабораторная работа 2. соль + щелочь =
- 14. Лабораторная работа 3. соль +кислота = другая
- 15. Лабораторная работа 4. соль +
- 16. С какими из перечисленных веществ будет реагировать
- 17. С какими из перечисленных веществ будет реагировать
- 18. Выписать из предложенных веществ формулы солей. Назвать
- 19. Выписать из предложенных веществ формулы солей. Назвать
Слайд 3Определение
Соли – сложные вещества, молекулы который состоят из атомов
Соли – электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка
Слайд 4Диссоциация
Fe2 (SO4)3 =2 Fe3+
AgNO3 = Ag + + NO3–
NaCl= Na + + Cl–
Ba(NO3)2 = Ba 2+ +2 NO3 –
K2SO4= 2K + + SO4 2–
2–
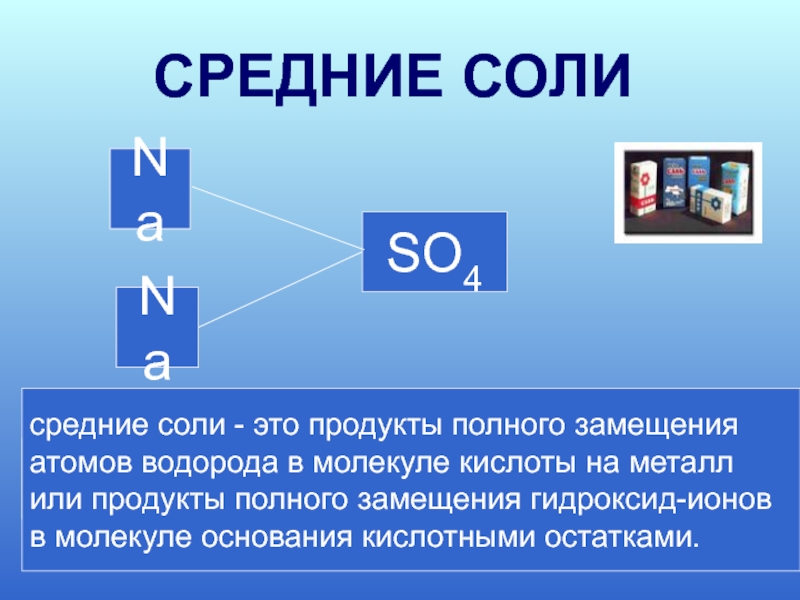
Слайд 5
H
H
SO4
Na
Na
Na2SO4 2Na+ +SO42-
средние соли - это
атомов водорода в молекуле кислоты на металл
или продукты полного замещения гидроксид-ионов
в молекуле основания кислотными остатками.
СРЕДНИЕ СОЛИ
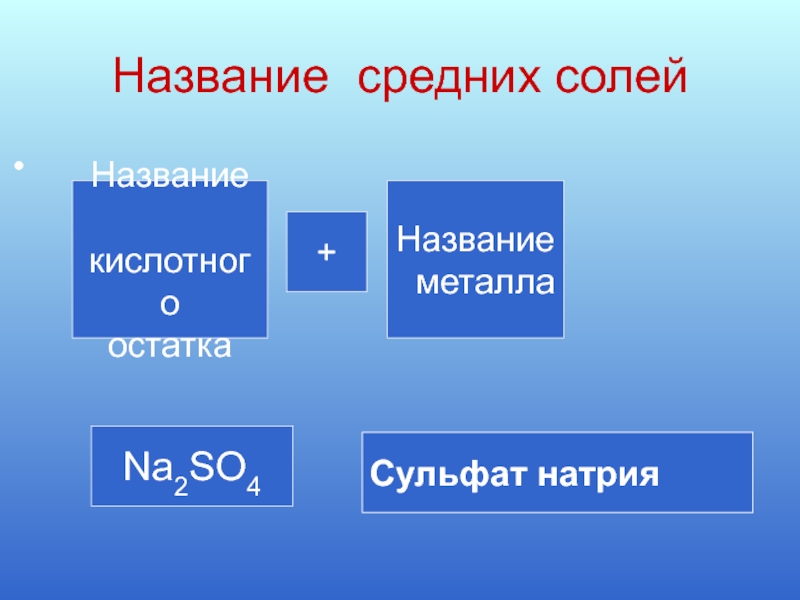
Слайд 6Название средних солей
Название
кислотного
остатка
Название
металла
+
Na2SO4
Сульфат натрия
Cульфат натрия
Слайд 7
H
H
SO4
Na
NaHSO4 Na+ + HSO4-
кислые соли – это
замещения атомов водорода в
молекулах многоосновных кислот на
металл.
КИСЛЫЕ СОЛИ
Слайд 8Название кислых солей
Гидро+
название
кислотного
остатка
+
Название
металла
NaHSO4
Гидросульфат натрия
Гидросульфат натрия
Слайд 9
Ca
OH
OH
Cl
CaOHCl CaOH+ + Cl-
основные соли – это
замещения гидроксид-ионов в молекулах
многокислотных оснований кислотными
остатками.
ОСНОВНЫЕ СОЛИ
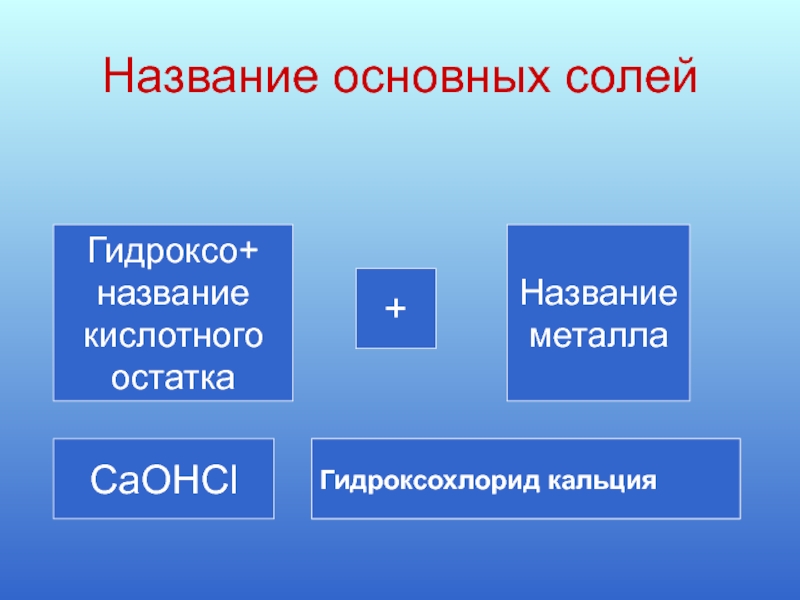
Слайд 10Название основных солей
Гидроксо+
название
кислотного
остатка
+
Название
металла
CaOHCl
Гидроксохлорид кальция
Гидроксохлорид кальция
Слайд 12Лабораторная работа
1. соль1 + соль2 = соль3 + соль4
Условие
А) Растворы солей можно определять по аниону, для этого нужно подобрать реактив с катионом способным осадить определяемый анион.
Б) Реактивом могут быть растворимые соли.
В) Растворы солей реагируют с растворами солей, если в результате образуется осадок.
Слайд 13Лабораторная работа
2. соль + щелочь = другая соль + другое основание
Условие
А) растворы солей можно определить по цвету катиона, катионы Cu2+ придают раствору синий цвет, катионы Fe2+ - желтоватый.
Б)некоторые катионы можно обнаружить, осаждая их гидроксид ионами, при этом получаются осадки различных цветов:
Cu(OH)2 – голубой, Fe(OH)2 – болотный, Al (OH)3 – белый, желеобразный.
В) соли реагируют со щелочами сообразованием новой соли и нерастворимого основания.
Слайд 14Лабораторная работа
3. соль +кислота = другая соль + другая кислота
Условие протекания:
А) типичная реакция обмена, протекает только в том случае ,если образуется осадок или газ.
Слайд 15Лабораторная работа
4. соль + металл = другая соль
Условия протекания:
А) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.
Б)Обе соли( и реагирующая , и образующаяся в результате реакции) должны быть растворимыми.
В) Металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II групп Периодической системы Д.И.Менделеева –щелочные и щелочноземельные –не вытесняют другие металлы из растворов солей.
Слайд 16С какими из перечисленных веществ будет реагировать хлорид железа (II):
Аg, KOH,
Fe(OH)2, HCl,
Na2CO3 , CO2.
Слайд 17С какими из перечисленных веществ будет реагировать хлорид железа (II):
2 KOH+
Na2CO3 + FeCl2= FeCO3 +2 NaCl
Слайд 18Выписать из предложенных веществ формулы солей. Назвать их и для одной
K2SO3 , Na2CO3, Na2SiO3,
NaNO3, H2SO4, HCl,
HNO3, NaCl, Сu, Pb,
Fe, NaOH , FeSO4, СuSO4,
Fe2 (SO4)3 , AgNO3 ,
NaCl, (NH4)2SO4, Ba(NO3)2,
KOH, K2SO4, Cu3(PO4)2.
Слайд 19Выписать из предложенных веществ формулы солей. Назвать их и для одной
K2SO3 , Na2CO3, Na2SiO3,
NaNO3, NaCl, FeSO4, СuSO4, Fe2 (SO4)3 , AgNO3 ,
NaCl, (NH4)2SO4, Ba(NO3)2,
K2SO4, Cu3(PO4)2.