- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сложные вещества кислоты презентация
Содержание
- 1. Сложные вещества кислоты
- 2. «Считай несчастным тот день или
- 3. Что нас объединяет?
- 4. Кислый вкус лимону придает лимонная кислота, яблоку
- 5. Кислотами называются сложные вещества, молекулы которых состоят
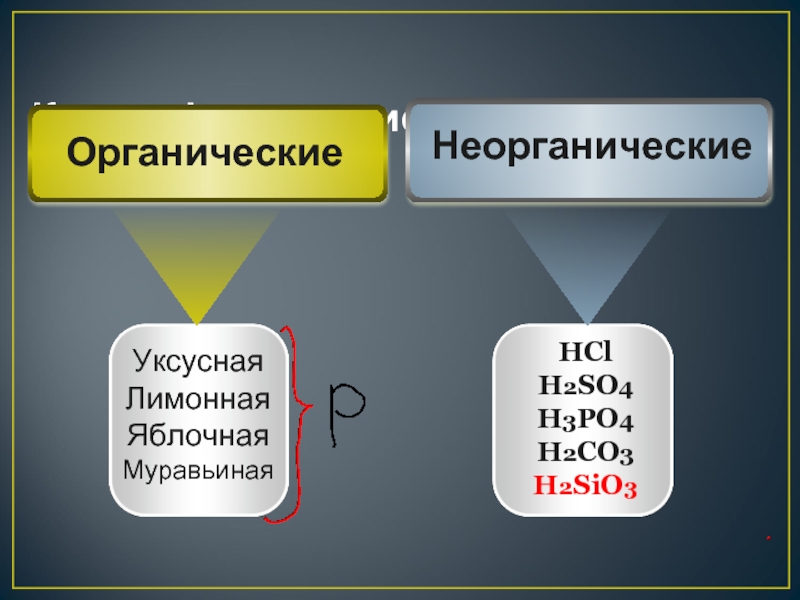
- 6. Классификация кислот Уксусная Лимонная Яблочная Муравьиная
- 7. По какому признаку кислоты
- 8. Классификация кислот по наличию в их составе кислорода Кислород- содержащие Бескислородные
- 9. По какому признаку кислоты разделены на группы?
- 10. Одноосновные HCl, HNO3
- 11. Физические свойства кислот По агрегатному
- 12. Кремниевая кислота H2SiO3 Единственная нерастворимая кислота Она соответ-ствует кислот- ному оксиду - SiO2
- 13. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—кислота! Разрушает и раздражает
- 14. Химические свойства кислот. Кислоты… 1). Изменяют
- 15. Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов.
- 16. Кислоты реагируют с солями, если образуется осадок или газ.
- 19. § 21(учить в тет.) №1,2 Выучить
- 20. Спасибо за урок!
Слайд 2 «Считай несчастным тот день или тот час, в который
ты не усвоил ничего нового и ничего не прибавил к своему образованию»
Я. А. Коменский
Я. А. Коменский
Слайд 4Кислый вкус лимону придает лимонная кислота, яблоку — яблочная кислота, скисшему
молоку — молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
Слайд 5Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода и
кислотных остатков.
HCl – хлороводородная (соляная)
H2SO4 – серная
H3PO4 - фосфорная
Слайд 6Классификация кислот
Уксусная
Лимонная
Яблочная
Муравьиная
HCl
H2SO4
H3PO4
H2CO3
H2SiO3
Неорганические
Органические
Слайд 9По какому признаку кислоты разделены на группы?
HF
HCl
HBr
HI
HNO3
HClO4
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
H3BO3
?
?
?
Слайд 10
Одноосновные
HCl, HNO3
Двухосновные
H2SO4,H2SiO3
Трехосновные
H3PO4
Классификация кислот по числу атомов водорода.
Кислоты
Слайд 11Физические свойства кислот
По агрегатному
состоянию:
Газообразные (HCl, H2S)
Жидкие (HNO3, H2SO4)
Твердые
(H3PO4, H2SiO3)
Цвет кислот – ?
Запах – ?
Вкус – ?
Цвет кислот – ?
Запах – ?
Вкус – ?
Слайд 12Кремниевая кислота
H2SiO3
Единственная нерастворимая кислота
Она соответ-ствует кислот-
ному оксиду - SiO2
Слайд 13ПРАВИЛА БЕЗОПАСНОСТИ
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу
капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Слайд 14Химические свойства кислот.
Кислоты…
1). Изменяют окраску индикатора;
Взаимодействуют:
2)
с металлами;
3) с основными оксидами;
4) с основаниями;
5) с солями.
3) с основными оксидами;
4) с основаниями;
5) с солями.
Слайд 19
§ 21(учить в тет.) №1,2
Выучить таблицу «Кислоты»
Стр. 123 – выписать в
тетрадь правила растворения H2SO4 в воде
Стр. 124 – выписать про рН среды
Рис. 65 – перерисовать в тетрадь
Домашнее задание