- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочноземельные металлы презентация
Содержание
- 1. Щелочноземельные металлы
- 2. Положение в периодической таблице. В периодической
- 3. Положение в периодической таблице Be
- 4. Строение атома +4 ) ) +12 )
- 5. Физические свойства щелочноземельных металлов Щелочноземельные металлы
- 6. Физические свойства щелочноземельных металлов.
- 7. Физические свойства цвет
- 8. Нахождение в природе Бериллий: 3BeO • Al2O3
- 9. Химические свойства С простыми веществами(неметаллами) 2Me0 +O2
- 10. Соединения щелочноземельных металлов
- 11. BaSO4 Благодаря
- 12. Ca3(PO4)2 Входит
- 13. CaCO3 Карбонат кальция
- 14. CaSO4∙ 2H2O
- 15. MgCO3 Широко применяется
- 16. Са(ОН)2 Гидроксид кальция
- 17. Спасибо за внимание!
Слайд 2Положение в периодической таблице.
В периодической системе находятся в главной подгруппе
II группы.
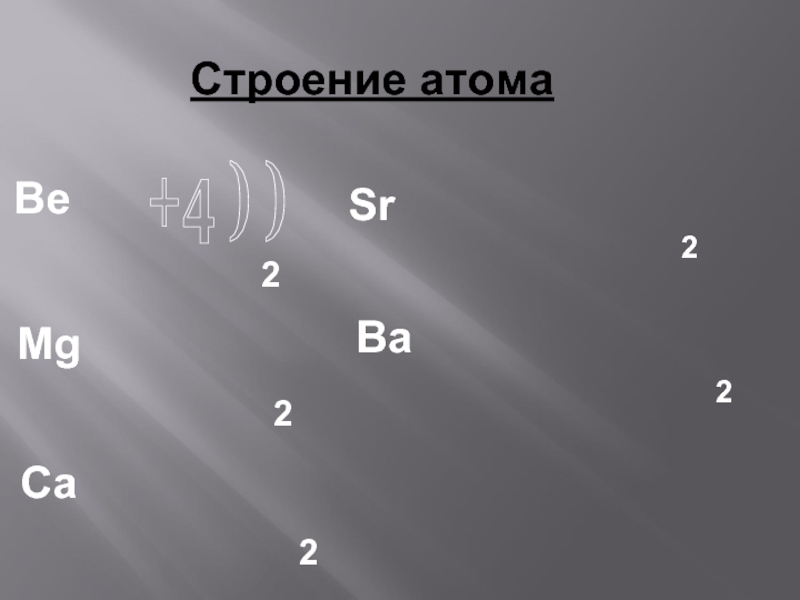
Являются сильными восстановителями, отдают 2 ē, во всех соединениях проявляют степень окисления +2.
Общая конфигурация внешнего энергетического уровня nS²
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Являются сильными восстановителями, отдают 2 ē, во всех соединениях проявляют степень окисления +2.
Общая конфигурация внешнего энергетического уровня nS²
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Слайд 5Физические свойства щелочноземельных металлов
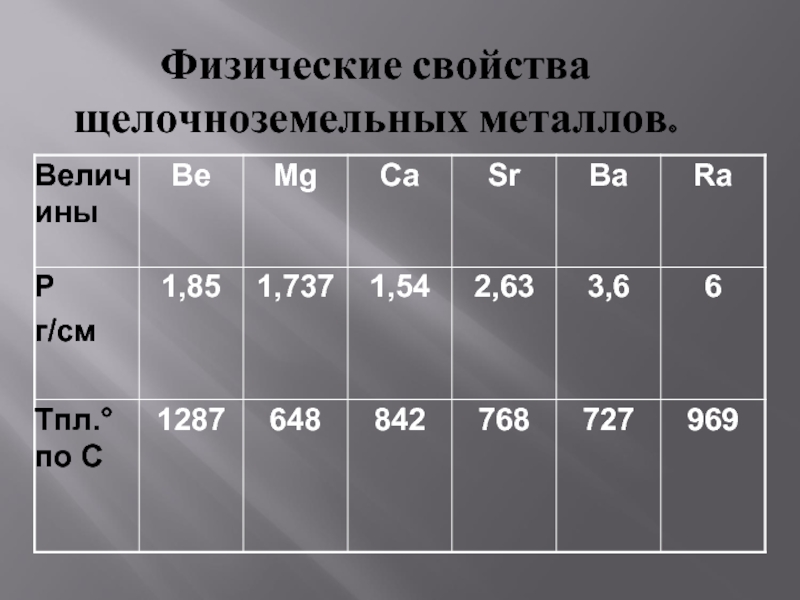
Щелочноземельные металлы – серебристо-белые, твёрдые вещества. По
сравнению со щелочными металлами обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Бериллий (Ве) очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу
Бериллий (Ве) очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу
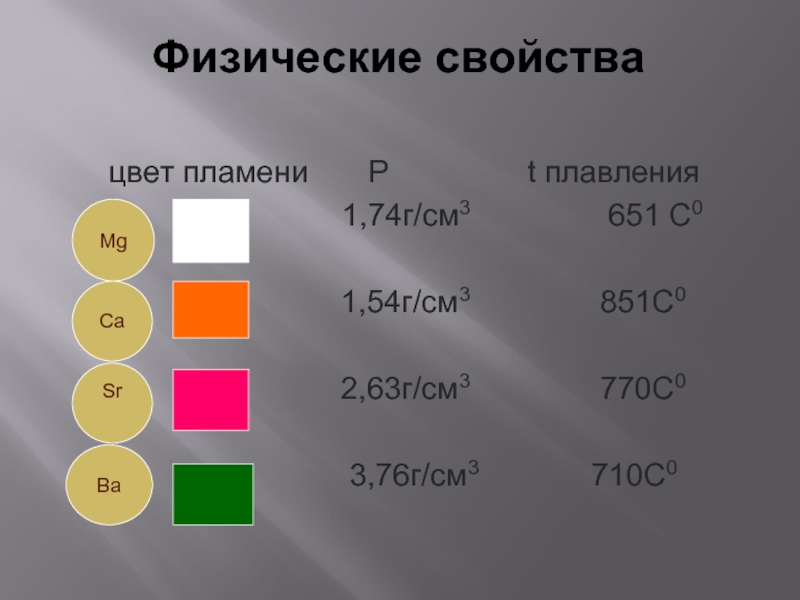
Слайд 7Физические свойства
цвет пламени P
t плавления
1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 8Нахождение в природе
Бериллий: 3BeO • Al2O3 • 6SiO2 – берилл
Магний: MgCO3
– магнезит
Кальций: CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3H2O – каинит
KCl • MgCl2 • 6H2O – карналлит
CaCO3 – кальцит (известняк, мрамор, мел.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат (флюорит)
Стронций: SrSO4 – целестин
SrCO3 – стронцианит
Барий: BaSO4 – барит
BaCO3 – витерит
Кальций: CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3H2O – каинит
KCl • MgCl2 • 6H2O – карналлит
CaCO3 – кальцит (известняк, мрамор, мел.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат (флюорит)
Стронций: SrSO4 – целестин
SrCO3 – стронцианит
Барий: BaSO4 – барит
BaCO3 – витерит
Слайд 9Химические свойства
С простыми веществами(неметаллами)
2Me0 +O2 → 2Me+2O-2 - оксид
Me0 +H2
→ Me+2H2 - гидрид
Me0 +Cl02 → Me+2Cl2 - хлорид
Me0 +S0 → Me+2S-2 - сульфид
2. Со сложными веществами
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Me0 +Cl02 → Me+2Cl2 - хлорид
Me0 +S0 → Me+2S-2 - сульфид
2. Со сложными веществами
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Слайд 10Соединения щелочноземельных
металлов
Оксиды щелочноземельных металлов –МеО, имеют основный
характер, легко реагируют с оксидами неметаллов с образованием соответствующих солей.
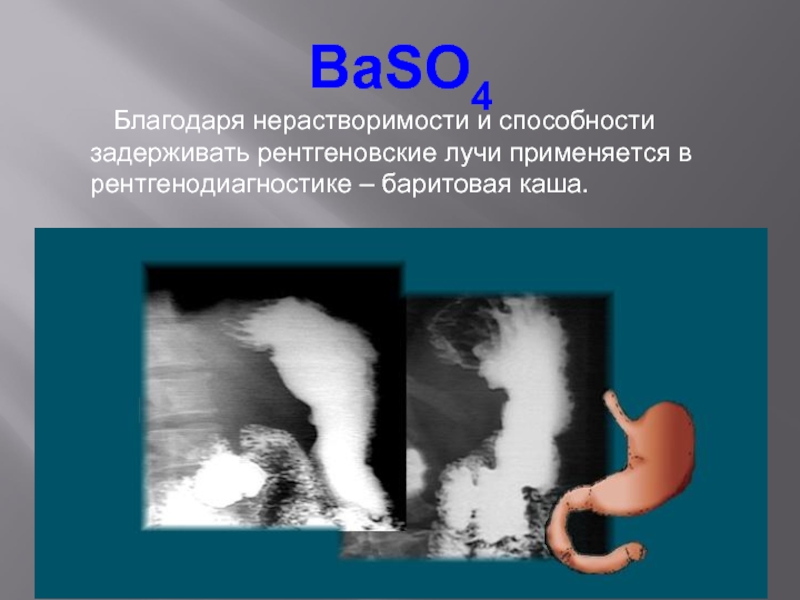
Слайд 11BaSO4
Благодаря нерастворимости и способности задерживать рентгеновские
лучи применяется в рентгенодиагностике – баритовая каша.
Слайд 12Ca3(PO4)2
Входит в состав фосфоритов и апатитов,
а также в состав костей и зубов. В организме взрослого человека содержится 1 кг Са в виде фосфата кальция.
Слайд 13CaCO3
Карбонат кальция – одно из самых распространённых
на Земле соединений. Его содержат горные породы – мел, мрамор, известняк.
Слайд 14CaSO4∙ 2H2O
Встречается в природе в виде
минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
Слайд 15MgCO3
Широко применяется в производстве стекла, цемента, кирпича,
а также в металлургии для перевода пустой породы в шлак.
Слайд 16Са(ОН)2
Гидроксид кальция или гашёная известь с песком
и водой называется известковым раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.