- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ртуть презентация
Содержание
- 1. Ртуть
- 2. История Ртуть – 1 из
- 3. Народам Индии и Китая самородная ртуть была
- 4. Распространение Ртути в природе Ртуть принадлежит
- 5. Ртуть мало распространена в природе, содержание
- 6. Самородная ртуть Hg Ртуть на киноварь-кварцевом
- 7. Каломель (Hg2)2+(Cl,Br)2 Терлингуа, Техас San-Onofre. Мексика Авала, Сербия
- 8. Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
- 9. Химический элемент Ртуть (Hg, от лат. Hydrargyrum) — элемент шестого
- 10. Физические свойства Простое вещество ртуть — переходный металл,
- 11. Физические свойства Температура плавления составляет
- 12. Химические свойства Для ртути
- 13. Химические свойства Ртуть — малоактивный металл.
- 14. Химические свойства Также с
- 15. Химические свойства При нагревании
- 16. Химические свойства
- 17. Химические свойства Ртуть также
- 18. Получение Ртуть получают обжигом киновари (сульфида ртути(II))
- 19. Ртуть широко применяется при изготовлении научных приборов:(барометры,
- 20. Ртуть обладает способностью растворять в себе
- 21. Соединения ртути Оксид
- 22. Соединения ртути Фульминат
- 23. Соединения ртути
- 24. Соединения ртути
- 25. Соединения ртути
- 26. Основной опасность представляют пары металлической ртути, выделение
- 27. Одно из тяжелейших загрязнений ртутью в истории
- 28. Спасибо за внимание
Слайд 2История
Ртуть – 1 из 7 металлов древности. Она известна более 1500
В IV - III вв. до н.э. о ртути как о жидком серебре (произошло от лат. Hydrargirum) упоминают Аристотель и Теофраст.
Ртуть считали основой металлов,
близкой к золоту и поэтому называли
меркурием (Mercurius), по имени
ближайшей к солнцу (золоту)
планеты Меркурий.
Астрономический символ
планеты Меркурий
Слайд 3Народам Индии и Китая самородная ртуть была известна за 2000 лет
История
Слайд 4Распространение Ртути в природе
Ртуть принадлежит к числу весьма редких элементов.
В биосфере ртуть в основном рассеивается и лишь в незначительных. количествах сорбируется глинами и илами (в глинах и сланцах в среднем 4.10–5%). В морской воде содержится 3.10–9% ртути.
Самородная ртуть , встречающаяся в природе, образуется при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко), гидротермальным путём (выделяется из водных растворов).
Слайд 5
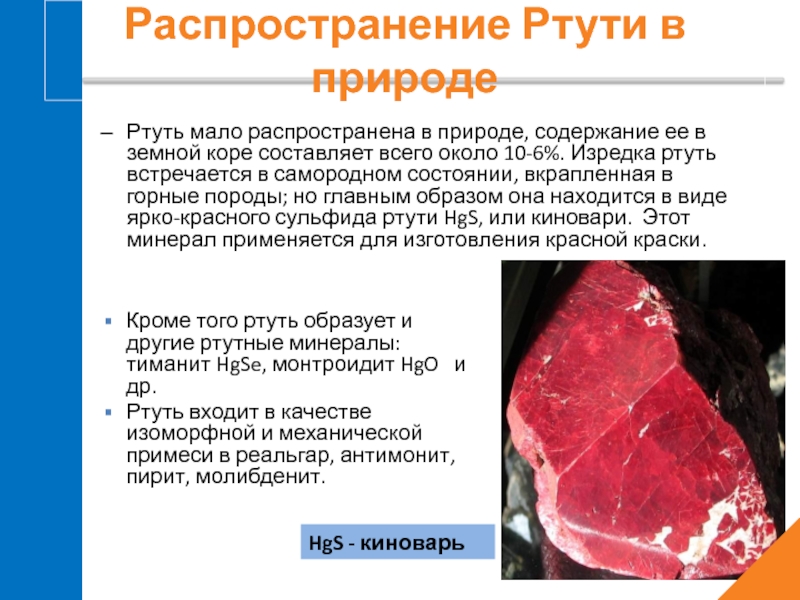
Ртуть мало распространена в природе, содержание ее в земной коре составляет
Кроме того ртуть образует и другие ртутные минералы: тиманит HgSe, монтроидит HgO и др.
Ртуть входит в качестве изоморфной и механической примеси в реальгар, антимонит, пирит, молибденит.
Распространение Ртути в природе
HgS - киноварь
Слайд 6Самородная ртуть Hg
Ртуть на киноварь-кварцевом агрегате. Levigliani, Тоскана, Италия
Ртуть на
Ртуть. Neubulach,
Шварцвальд, Германия
Капли
ртути
на
киновари.
Альмаден,
Испания
Слайд 9
Химический элемент
Ртуть (Hg, от лат. Hydrargyrum) — элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка (побочной
Hg – d элемент 4f145d106s2
Слайд 10
Физические свойства
Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром).
Слайд 11
Физические свойства
Температура плавления составляет 234,32 K (-38,83 °C), кипит при 629,88 K (356,73 °C).
Обладает свойствами диамагнетика.
Образует со многими металлами
Слайд 12
Химические свойства
Для ртути характерны две степени окисления: +1 и +2.
В
Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
Слайд 13
Химические свойства
Ртуть — малоактивный металл.
Она не растворяется в растворах кислот, не обладающих
и азотной кислоте:
Слайд 14
Химические свойства
Также с трудом растворяется в серной кислоте при нагревании, с
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2
Слайд 15
Химические свойства
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
При этом
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
Слайд 16
Химические свойства
При нагревании ртути с серой
образуется сульфид ртути(II):
Сульфид ртути
Реакция демеркуризации
Слайд 17
Химические свойства
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно
и различными хлорсодержащими отбеливателями.
Эти реакции используют для удаления металлической ртути.
Слайд 18
Получение
Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом:
Пары ртути конденсируют и собирают.
Этот способ применяли
Слайд 19Ртуть широко применяется при изготовлении научных приборов:(барометры, термометры, манометры, вакуумные насосы
в ртутных лампах, переключателях, выпрямителях;
как жидкий катод в производстве едких щелочей и хлора электролизом,
в качестве катализатора при синтезе уксусной кислоты,
в металлургии для амальгамации золота и серебра,
при изготовлении взрывчатых веществ;
в медицине (каломель, сулема, ртутьорганические и др. соединения),
в качестве пигмента (киноварь),
в сельском хозяйстве (органические соединения ртути ) в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами).
ртуть и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
Применение ртути и ее соединений
Слайд 20
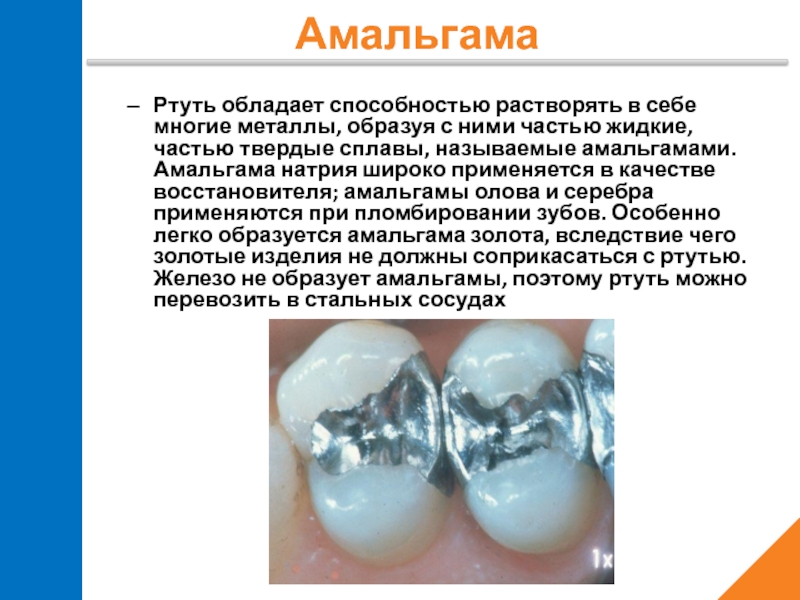
Ртуть обладает способностью растворять в себе многие металлы, образуя с ними
Амальгама
Слайд 21
Соединения ртути
Оксид ртути(II) — HgO Это твёрдое непрочное при нормальных
Красный оксид ртути получают нагреванием ртути до 350 °C или пиролизом нитрата ртути.
Жёлтый оксид получают осаждением солей ртути(II) щелочами
Слайд 22
Соединения ртути
Фульминат ртути(II) Hg(ONC)2 («гремучая ртуть») издавна применяется в качестве
«Гремучую ртуть» получают взаимодействием нитрата ртути с этанолом в разбавленной азотной кислоте
Слайд 23
Соединения ртути
Сулема - хлорид ртути HgCl2 был первым веществом
Слайд 24
Соединения ртути
Ка́ломель, хлористая ртуть, хлорид одновалентной ртути Hg2Cl2 -
Слайд 25
Соединения ртути
Циани́д рту́ти(II) Hg(CN)2 — неорганическое соединение, ртутная соль
Применяют для лечения больных сифилисом, а также как дезинфицирующее средство.
Слайд 26Основной опасность представляют пары металлической ртути, выделение которых с открытых поверхностей
Отравление ртутью
Слайд 27Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе
Отравление ртутью
Над заливом Минамата (Япония) возвышается мемориал погибшим и пострадавшим в результате отравления ртутью.