…А растворы и их образования
играют роль первостепенную не только в природе,
называемую мёртвой, но и в организмах.
Д.И. Менделеев
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов презентация
Содержание
- 1. Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов
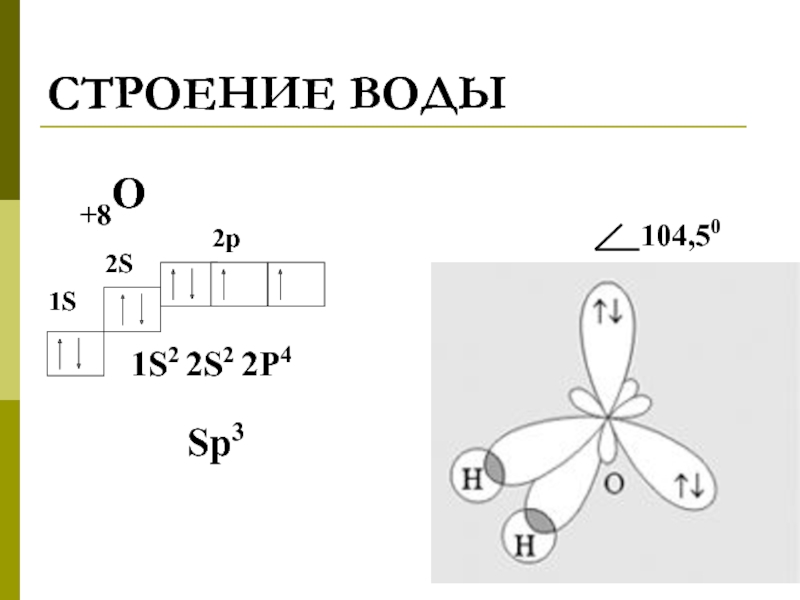
- 2. СТРОЕНИЕ ВОДЫ +8О 1S2 2S2 2P4 1S 2S 2p Sp3
- 3. ОБРАЗОВАНИЕ ВОДОРОДНЫХ СВЯЗЕЙ В ВОДЕ ●●● H
- 4. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ Массовая доля ω(Х)
- 5. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 2) Молярная концентрация С(Х)
- 6. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 3) Молярная концентрация эквивалента
- 7. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ - молярная масса эквивалента;
- 8. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ - фактор эквивалентности; Z
- 9. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 4) Моляльная концентрация –
- 10. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 5)
- 11. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 6) Титр – отношение
- 12. ТЕРМОДИНАМИКА ПРОЦЕССА РАСТВОРЕНИЯ Вещества самопроизвольно могут
- 13. САМОПРОИЗВОЛЬНОЕ РАСТВОРЕНИЕ ВЕЩЕСТВ 1) При растворении твёрдых
- 14. САМОПРОИЗВОЛЬНОЕ РАСТВОРЕНИЕ ВЕЩЕСТВ 2) При растворении
- 15. САМОПРОИЗВОЛЬНОЕ РАСТВОРЕНИЕ ВЕЩЕСТВ 3) Для
- 16. ЗАКОН ГЕНРИ Количество газа, растворённого при данной
- 17. ЗАКОН СЕЧЕНОВА Растворимость газов в жидкостях в
- 18. ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ Давление пара
- 19. Р –давление пара над раствором, (Па); Кр
- 20. ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ Р0- давление пара
- 21. - относительное понижение давления пара над
- 22. ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРОВ ΔTК =
- 23. ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРОВ ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРОВ
- 24. ТЕМПЕРАТУРА КИПЕНИЯ РАСТВОРА T(КИП.Р-РА) = TКИП.Р-ЛЯ + ΔTК
- 25. ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ РАСТВОРА ΔTЗ =
- 26. ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ РАСТВОРА
- 27. ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ РАСТВОРА ТЗАМ. Р-РА = ТЗАМ. Р-ЛЯ - ΔТЗ
- 28. РАСЧЁТ МОЛЯРНЫХ МАСС РАСТВОРЁННОГО ВЕЩЕСТВА-НЕЭЛЕКТРОЛИТА
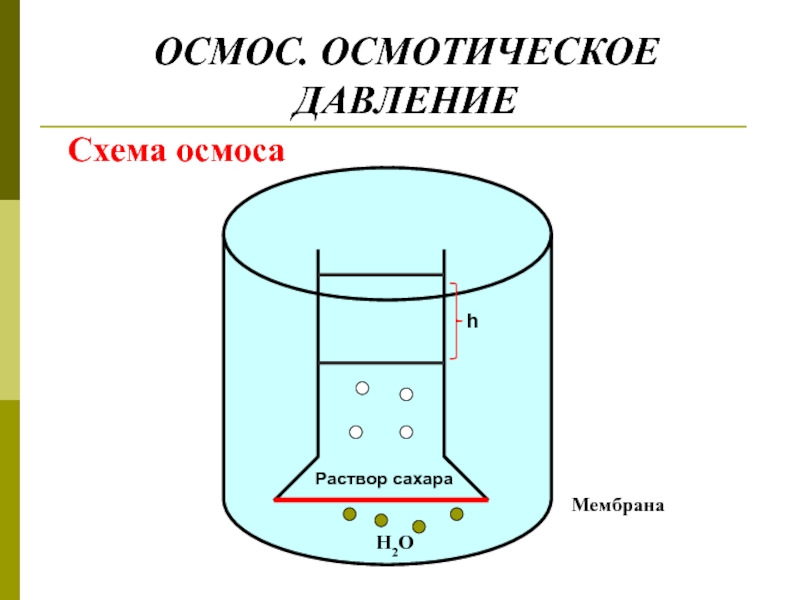
- 29. ОСМОС. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ Схема осмоса
- 30. Расчет величины осмотического давления Р = h
- 31. Уравнение Вант-Гоффа πосм = С(х) ∙ R ∙ T R – универсальная газовая постоянная (8,3Дж/моль×К);[кПа×л/моль×К]
- 32. РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО ДАВЛЕНИЯ В
- 33. РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО ДАВЛЕНИЯ
- 34. РАСЧЁТ ИЗОТОНИЧЕСКОГО КОЭФФИЦИЕНТА i - показывает во
- 35. УРАВНЕНИЯ ДЛЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ ΔТЗ = i×КЗ×b(Х)
- 36. ИЗОТОНИЧЕСКИЙ КОЭФФИЦИЕНТ СВЯЗАН СО СТЕПЕНЬЮ ДИССОЦИАЦИИ УРАВНЕНИЕМ 1< i < n
Слайд 1ЛЕКЦИЯ 2
РОЛЬ ВОДЫ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМА.
ТЕОРИЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ И НЕЭЛЕКТРОЛИТОВ
КОЛЛИГАТИВНЫЕ
Слайд 3ОБРАЗОВАНИЕ ВОДОРОДНЫХ СВЯЗЕЙ В ВОДЕ
●●● H - O ●●● H -
H
H
H
H
●●●
Eвод. связи = 20-25 кДж/моль
Слайд 4СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ
Массовая доля ω(Х) – отношение массы растворённого вещества к
Слайд 5СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ
2) Молярная концентрация С(Х) – количество молей растворённого вещества
Слайд 6СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ
3) Молярная концентрация эквивалента растворённого вещества – отношение количества
Слайд 8СПОСОБЫ ВЫРАЖЕНИЯ
КОНЦЕНТРАЦИЙ
- фактор эквивалентности;
Z - основность кислоты или кислотность основания в
Слайд 9СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ
4) Моляльная концентрация – показывает отношение количества вещества в
Слайд 10
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ
5) Молярная доля растворённого вещества – отношение количества данного
n(Хi) – количество вещества данного компонента, моль
∑ n (р-р) – суммарное количество всех компонентов раствора, моль
Слайд 11СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ
6) Титр – отношение массы вещества к объёму раствора
Единица
Слайд 12ТЕРМОДИНАМИКА ПРОЦЕССА РАСТВОРЕНИЯ
Вещества самопроизвольно могут растворятся, если ΔG0
ΔH0р = ΔH0крист. + ΔH0сольват.
∆G0= ∆H0 -T∆S0
Слайд 13САМОПРОИЗВОЛЬНОЕ РАСТВОРЕНИЕ ВЕЩЕСТВ
1) При растворении твёрдых веществ с ионной кристаллической решёткой
ΔH0р-я > 0, т.к. ΔH0кр > ΔH0сольв, ΔS > 0 тогда TΔS > ΔH0
ΔG < 0 , растворы охлаждаются
Слайд 14САМОПРОИЗВОЛЬНОЕ
РАСТВОРЕНИЕ ВЕЩЕСТВ
2) При растворении твёрдых веществ с ковалентной связью (сахар)
ΔH0< 0, т.к. ΔH0кр < ΔH0сольв, ΔS > 0, тогда процесс протекает с выделением тепла (экзотермическая реакция)
Для жидкостей ΔH0кр = 0, ΔH0сольв > ΔH0кр, поэтому ΔH0раств < 0, ΔS > 0
Слайд 15
САМОПРОИЗВОЛЬНОЕ
РАСТВОРЕНИЕ ВЕЩЕСТВ
3) Для газов ΔH0кр = 0, тогда
ΔH0раств =
ΔS < 0
TΔS < ΔH0
при низких температурах
Слайд 16ЗАКОН ГЕНРИ
Количество газа, растворённого при данной температуре в определённом объёме жидкости,
С(Х) = Kг(Х)×Р(Х)
С(Х) – концентрация газа в насыщенном растворе, (моль/л)
Kг(Х) – константа Генри (моль/л×Па) ,
Р(Х) – давление газа над раствором, Па
Слайд 17ЗАКОН СЕЧЕНОВА
Растворимость газов в жидкостях в присутствии электролитов понижается, происходит высаливание
С(Х) – растворимость газа в присутствии электролита;
C0(Х) – растворимость газа в чистом растворителе;
Сэ – концентрация электролита;
Кс – константа Сеченова (зависит от природы газа, электролита и температуры)
Слайд 18ДАВЛЕНИЕ ПАРА НАД
РАСТВОРОМ
Давление пара раствора, содержащего нелетучее растворённое вещество, прямо
Р = Кр×æ(Х1)
ЗАКОН РАУЛЯ
Слайд 19Р –давление пара над раствором, (Па);
Кр – константа Рауля, (Па);
æ(Х1) –молярная
в растворе
ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ
Слайд 20ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ
Р0- давление пара над чистым растворителем, (Па);
Р –
Р0 – Р –абсолютное понижение давления пара над раствором (Па);
Слайд 21- относительное понижение
давления пара над раствором (Па)
Р0 - Р =
ΔР = Р0×æ(раств. в-ва)
ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ
Слайд 22ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ
РАСТВОРОВ
ΔTК = KЭ×b(Х)
b(Х) - моляльная концентрация (моль/кг)
KЭ –
(кг×К/моль)
КЭ(Н2О) = 0,516 кг×К/моль
Слайд 25ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ
РАСТВОРА
ΔTЗ = KЗ×b(Х)
b(Х) – моляльная концентрация, моль/кг
KЗ –
Кз (Н2О) = 1,86 кг×К/моль
Слайд 30Расчет величины осмотического давления
Р = h ∙ ρ ∙ g
Р -
h – высота столба жидкости
ρ - плотность жидкости кг/м3
g – ускорение силы тяжести – 9,8 м/с2
Слайд 31Уравнение Вант-Гоффа
πосм = С(х) ∙ R ∙ T
R – универсальная газовая
Слайд 32РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО
ДАВЛЕНИЯ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
1) При помещении клеток
2) При помещении клеток в гипертонический раствор, вода из клеток уходит в раствор и наблюдается сморщивание клеток или плазмолиз.
0,9%
10%
Слайд 33РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО
ДАВЛЕНИЯ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
3) При помещении
вода из раствора переходит внутрь клеток, что
приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого.
Такое разрушение называют лизисом.
В случае эритроцитов этот процесс называют
гемолизом.
0,9%
0,5%
Слайд 34РАСЧЁТ ИЗОТОНИЧЕСКОГО КОЭФФИЦИЕНТА
i - показывает во сколько раз практически полученные величины
Слайд 35УРАВНЕНИЯ ДЛЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
ΔТЗ = i×КЗ×b(Х)
П =i ×С(Х) × R ×
ΔТК = i × КЭ × b(Х)
ΔР = i × P0 × æ(Х2)









![СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ6) Титр – отношение массы вещества к объёму раствораЕдиница измерения - [г/мл]](/img/tmb/4/366199/796891b07b2d90c5b8e3e7717f91e83f-800x.jpg)


















![Уравнение Вант-Гоффаπосм = С(х) ∙ R ∙ TR – универсальная газовая постоянная (8,3Дж/моль×К);[кПа×л/моль×К]](/img/tmb/4/366199/15887f77651ffd050bfd051407048adc-800x.jpg)