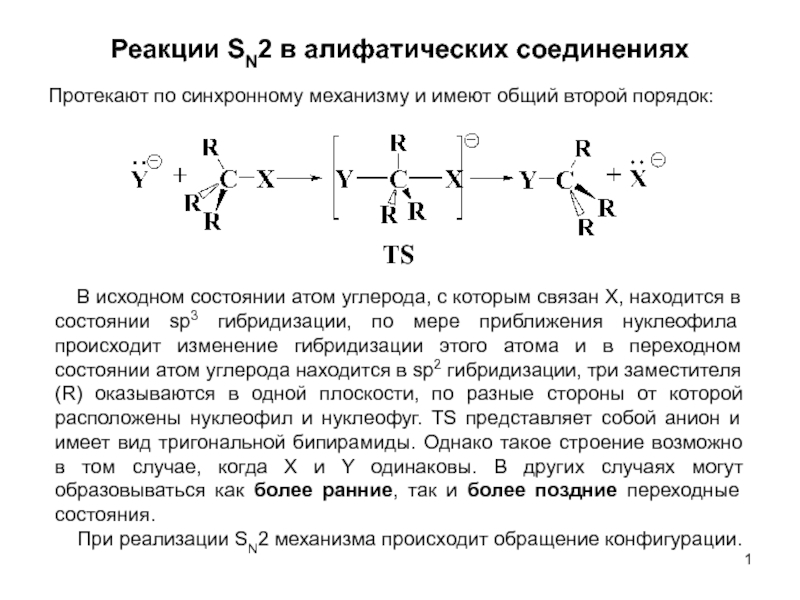
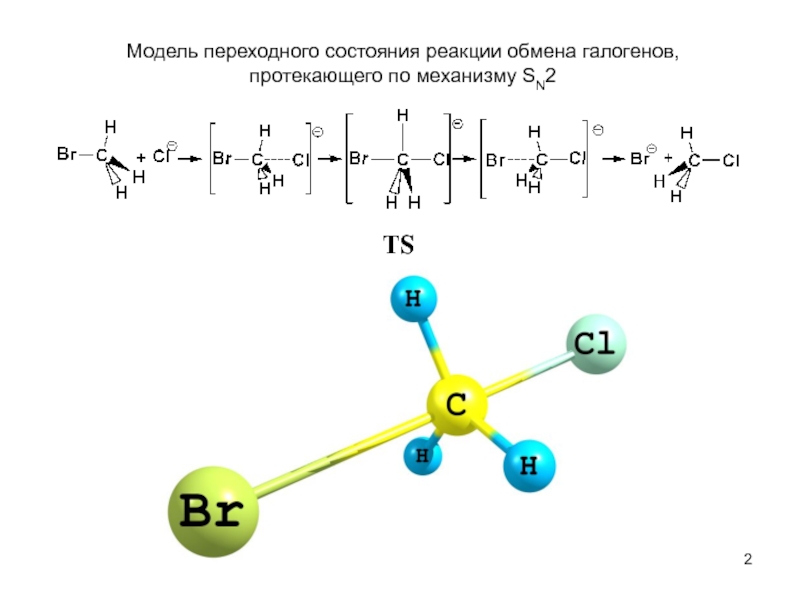
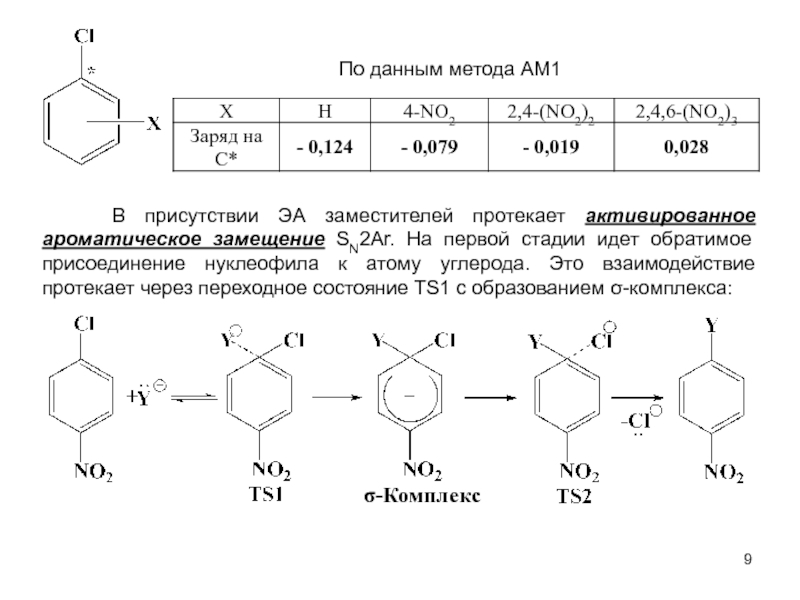
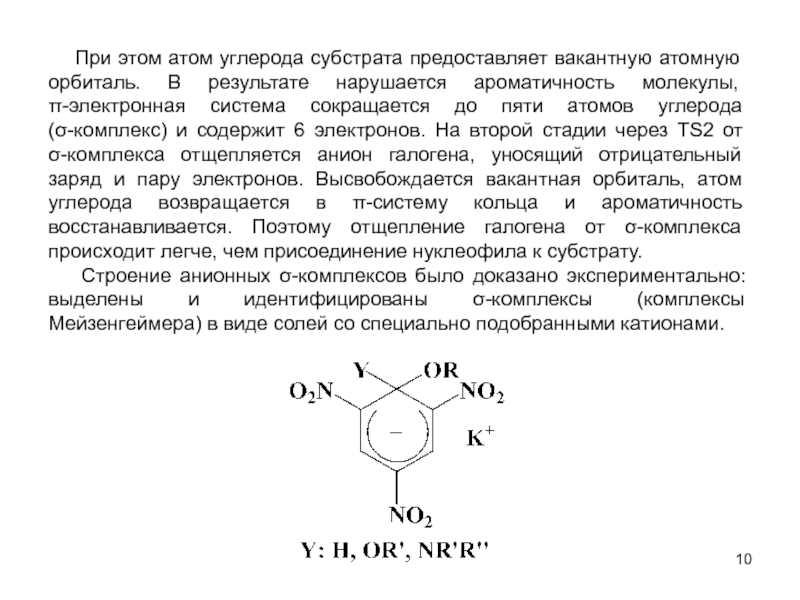
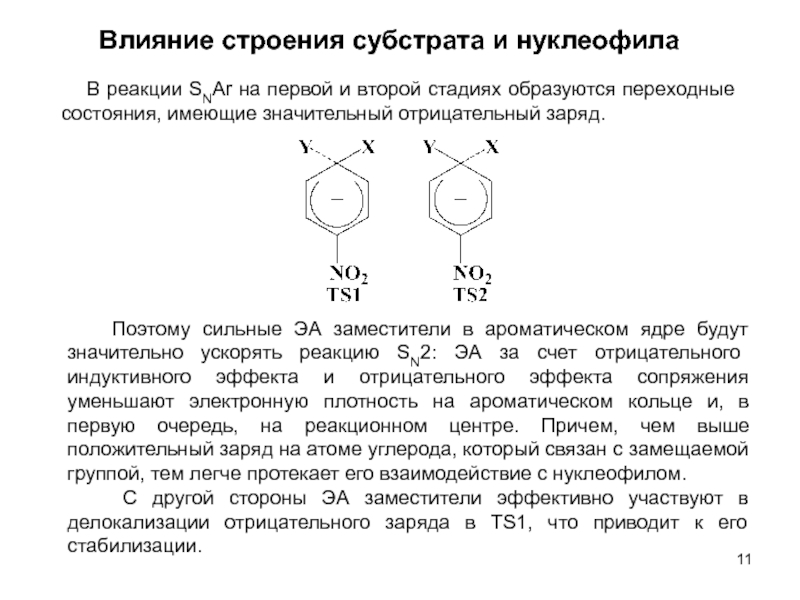
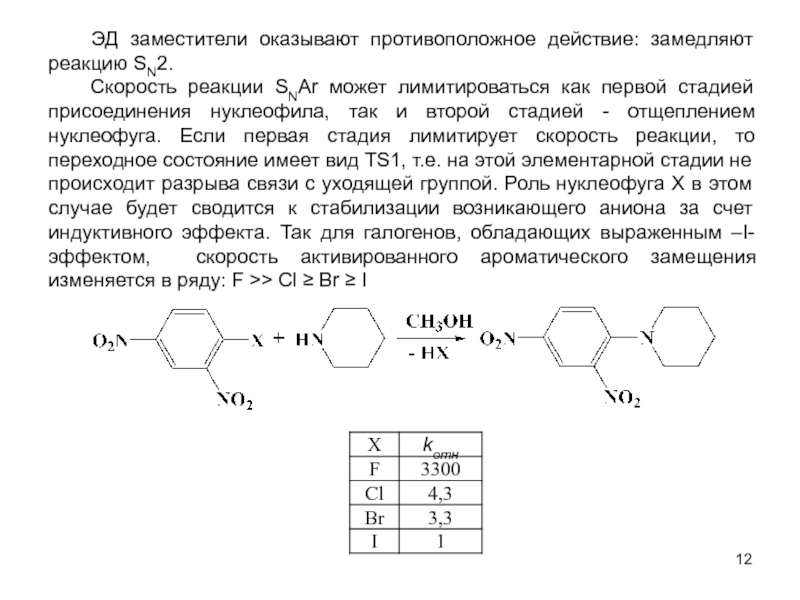
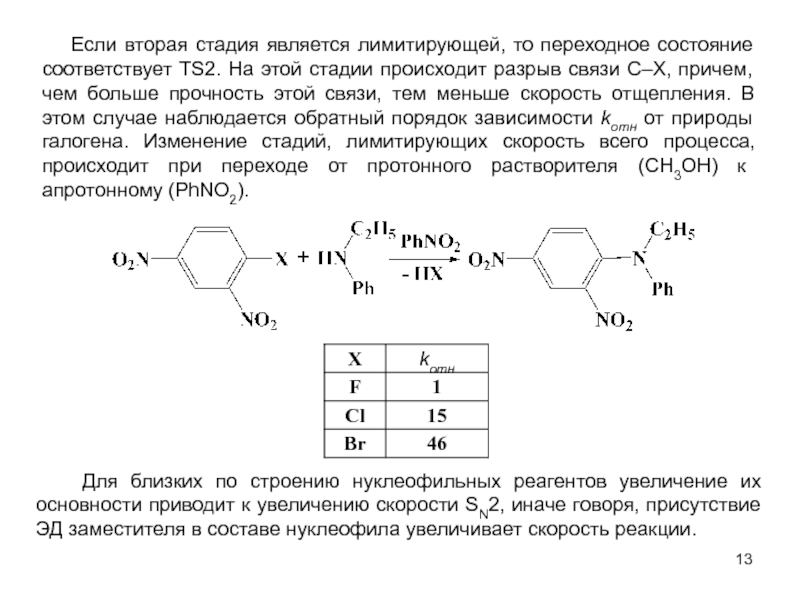
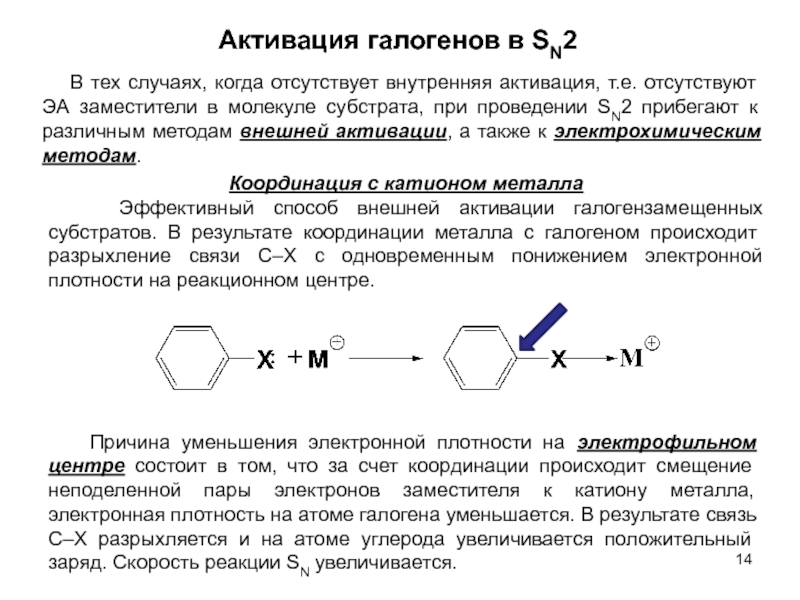
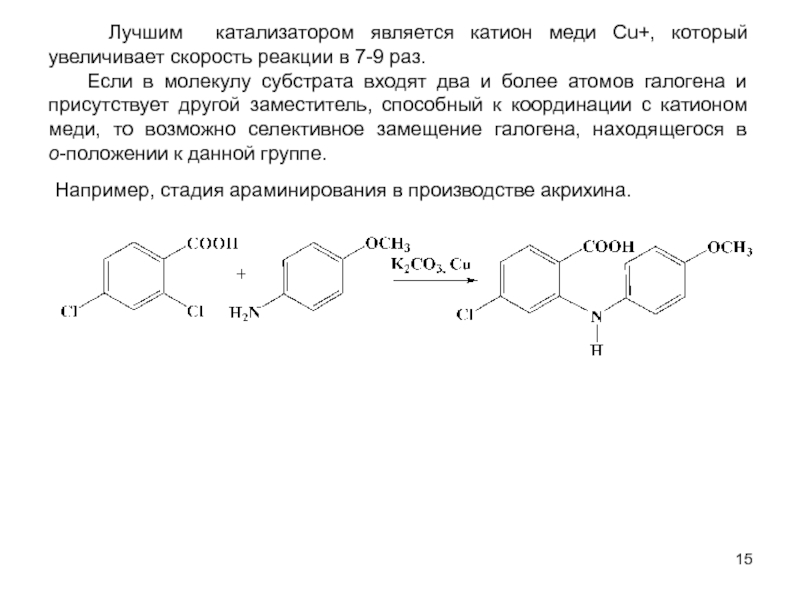
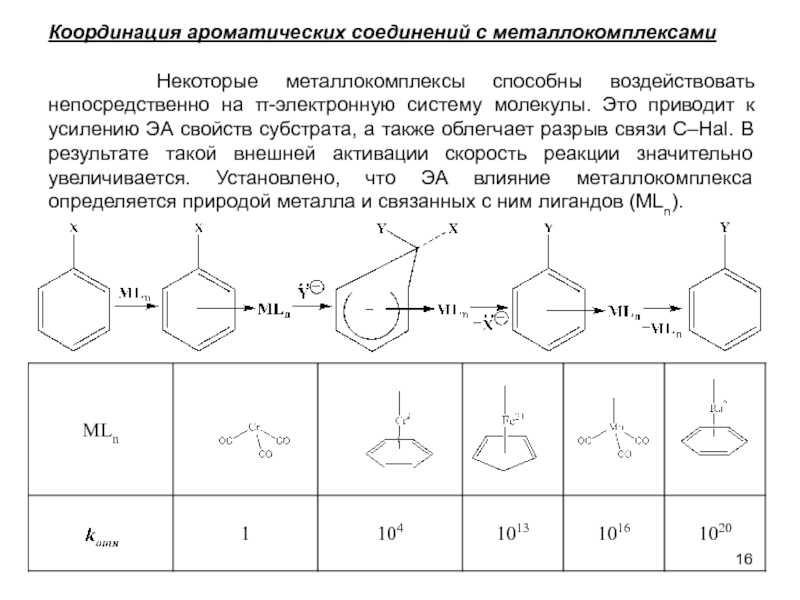
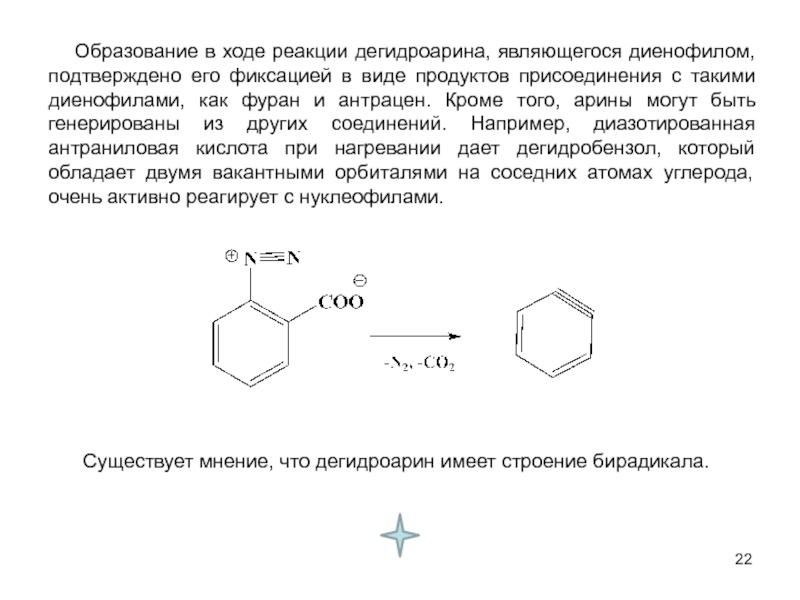
В исходном состоянии атом углерода, с которым связан Х, находится в состоянии sр3 гибридизации, по мере приближения нуклеофила происходит изменение гибридизации этого атома и в переходном состоянии атом углерода находится в sр2 гибридизации, три заместителя (R) оказываются в одной плоскости, по разные стороны от которой расположены нуклеофил и нуклеофуг. TS представляет собой анион и имеет вид тригональной бипирамиды. Однако такое строение возможно в том случае, когда Х и Y одинаковы. В других случаях могут образовываться как более ранние, так и более поздние переходные состояния.
При реализации SN2 механизма происходит обращение конфигурации.
TS