- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции ионного обмена презентация
Содержание
- 1. Реакции ионного обмена
- 2. Цели и задачи Цель: развитие знаний обучающихся
- 3. Основные понятия Реакция называется необратимой, если
- 4. Основные понятия Реакциями ионного обмена называются реакции,
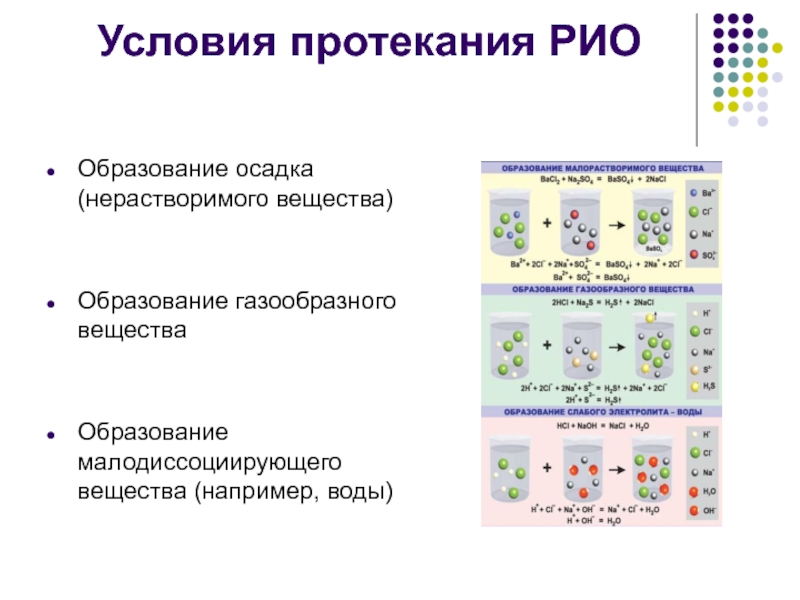
- 5. Условия протекания РИО Образование осадка (нерастворимого вещества)
- 6. Примеры реакций Образование осадка BaCl2 + Na2SO4
- 7. Примеры реакций Образование газообразного вещества 2HCI +
- 8. Примеры реакций Образование малодиссоциирующего вещества HCl +
- 9. Примеры заданий для самостоятельной работы Какие
- 10. Примеры заданий для самостоятельной работы По
- 11. Примерный перечень контрольных вопросов Какие реакции
- 12. Примерный перечень контрольных вопросов Приведите примеры
- 13. Рефлексия С какими новыми понятиями вы познакомились
- 14. Спасибо за внимание!
Слайд 2Цели и задачи
Цель: развитие знаний обучающихся о необратимых реакциях на примере
реакций ионного обмена (РИО) и условий их протекания
Для достижения поставленной цели требуется решить следующие задачи:
ознакомиться с РИО
изучить экспериментально условия протекания РИО
закрепить полученные знания
Для достижения поставленной цели требуется решить следующие задачи:
ознакомиться с РИО
изучить экспериментально условия протекания РИО
закрепить полученные знания
Слайд 3Основные понятия
Реакция называется необратимой, если один из продуктов реакции является
нерастворимым, газообразным или малодиссоциирующим веществом
Реакция называется обратимой, если не происходит связывания ионов в нерастворимые, газообразные или малодиссоциирующие вещества
Реакция называется обратимой, если не происходит связывания ионов в нерастворимые, газообразные или малодиссоциирующие вещества
Слайд 4Основные понятия
Реакциями ионного обмена называются реакции, протекающие между ионами в растворах
электролитов
Сущность РИО заключается в связывании ионов электролитов в нерастворимые, газообразные и малодиссоциирующие вещества
Реакции ионного обмена являются необратимыми
Сущность РИО заключается в связывании ионов электролитов в нерастворимые, газообразные и малодиссоциирующие вещества
Реакции ионного обмена являются необратимыми
Слайд 5Условия протекания РИО
Образование осадка (нерастворимого вещества)
Образование газообразного вещества
Образование малодиссоциирующего вещества (например,
воды)
Слайд 6Примеры реакций
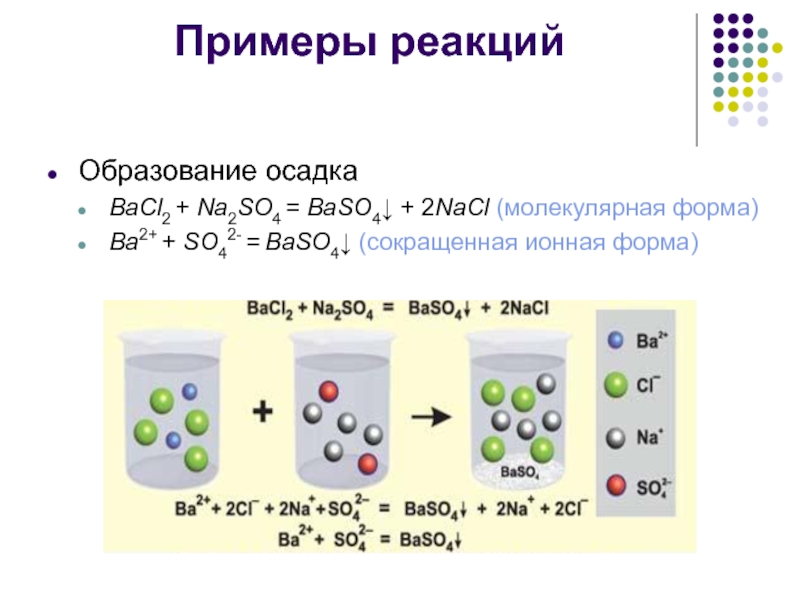
Образование осадка
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl (молекулярная форма)
Ba2+
+ SO42- = BaSO4↓ (сокращенная ионная форма)
Слайд 7Примеры реакций
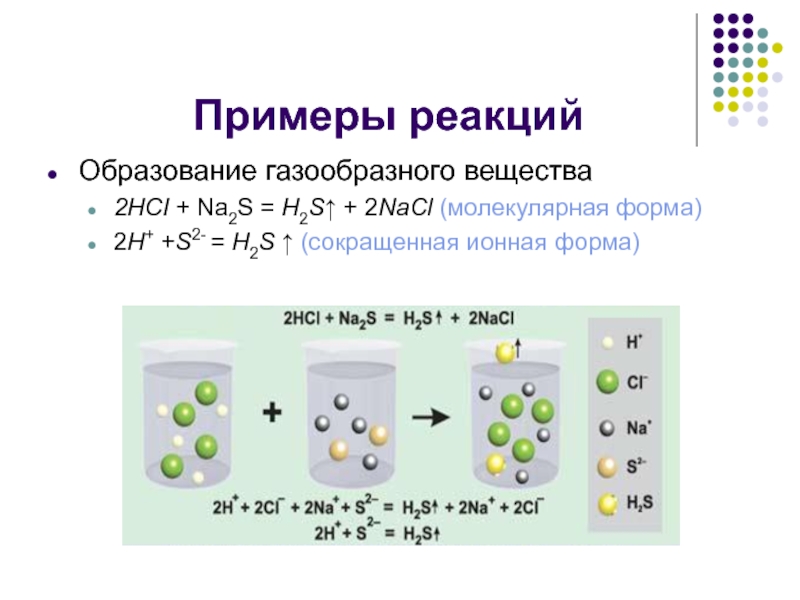
Образование газообразного вещества
2HCI + Na2S = H2S↑ + 2NaCl (молекулярная
форма)
2H+ +S2- = H2S ↑ (сокращенная ионная форма)
2H+ +S2- = H2S ↑ (сокращенная ионная форма)
Слайд 8Примеры реакций
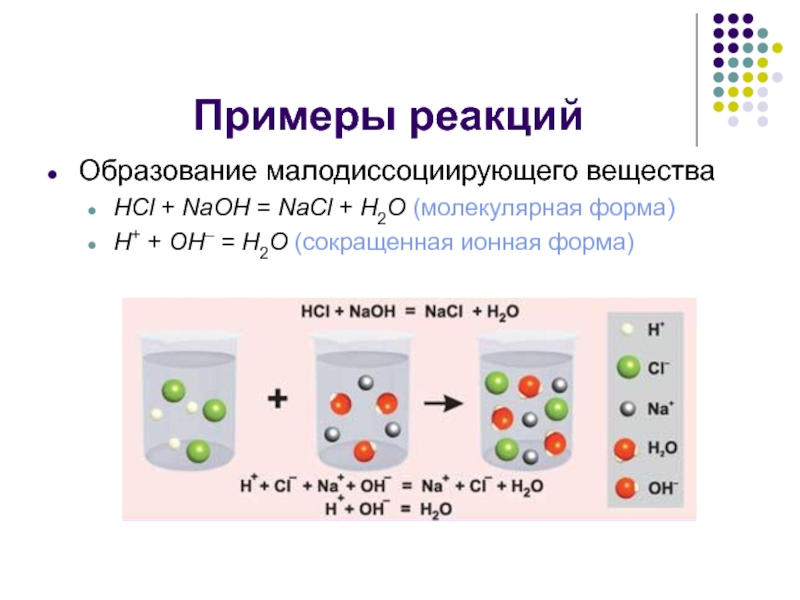
Образование малодиссоциирующего вещества
HCl + NaOH = NaCl + H2O (молекулярная
форма)
H+ + OH– = H2O (сокращенная ионная форма)
H+ + OH– = H2O (сокращенная ионная форма)
Слайд 9Примеры заданий для самостоятельной работы
Какие из перечисленных реакций относятся к
РИО? Ответ обоснуйте
AgNO3 + NaCl = AgCl + NaNO3
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Na2CO3 + 2HCl = 2NaCl + CO2 +H2O
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3
K2S + H2SO4 = K2SO4 + H2S
2KCl + Na2SO4 = 2NaCl + K2SO4
AgNO3 + NaCl = AgCl + NaNO3
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Na2CO3 + 2HCl = 2NaCl + CO2 +H2O
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3
K2S + H2SO4 = K2SO4 + H2S
2KCl + Na2SO4 = 2NaCl + K2SO4
Слайд 10Примеры заданий для самостоятельной работы
По схемам сокращенных ионных уравнений составить
молекулярные и полные ионные уравнения
2H+ + 2OH- → 2H2O
3Ca2+ + 2PO43- → Ca3(PO4)2
Pb2+ + S2- → PbS
SO32- + 2H+ → SO2 + H2O
CO32- + 2H+ → CO2 + H2O
Cu2+ +2OH- → Cu(OH)2
2H+ + 2OH- → 2H2O
3Ca2+ + 2PO43- → Ca3(PO4)2
Pb2+ + S2- → PbS
SO32- + 2H+ → SO2 + H2O
CO32- + 2H+ → CO2 + H2O
Cu2+ +2OH- → Cu(OH)2
Слайд 11Примерный перечень контрольных вопросов
Какие реакции называются необратимыми и обратимыми?
Какие реакции
называются реакциями ионного обмена?
Являются ли реакции ионного обмена обратимыми?
В чем заключается сущность реакций ионного обмена?
Являются ли реакции ионного обмена обратимыми?
В чем заключается сущность реакций ионного обмена?
Слайд 12Примерный перечень контрольных вопросов
Приведите примеры реакций ионного обмена в молекулярной
и сокращенной ионной формах
с образованием осадка
с образованием газообразного вещества
с образованием малодиссоциирующего вещества
с образованием осадка
с образованием газообразного вещества
с образованием малодиссоциирующего вещества
Слайд 13Рефлексия
С какими новыми понятиями вы познакомились на уроке?
Какие трудности усвоения материала
по данной теме у вас возникли?
Понимание каких реакций ионного обмена вызвало у вас затруднение?
Что на данном занятии было вам интересно?
Понимание каких реакций ионного обмена вызвало у вас затруднение?
Что на данном занятии было вам интересно?