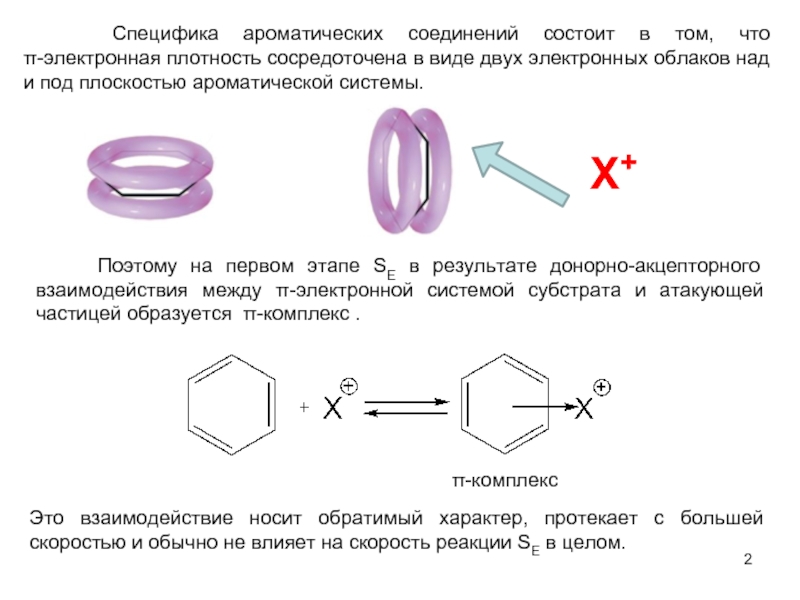
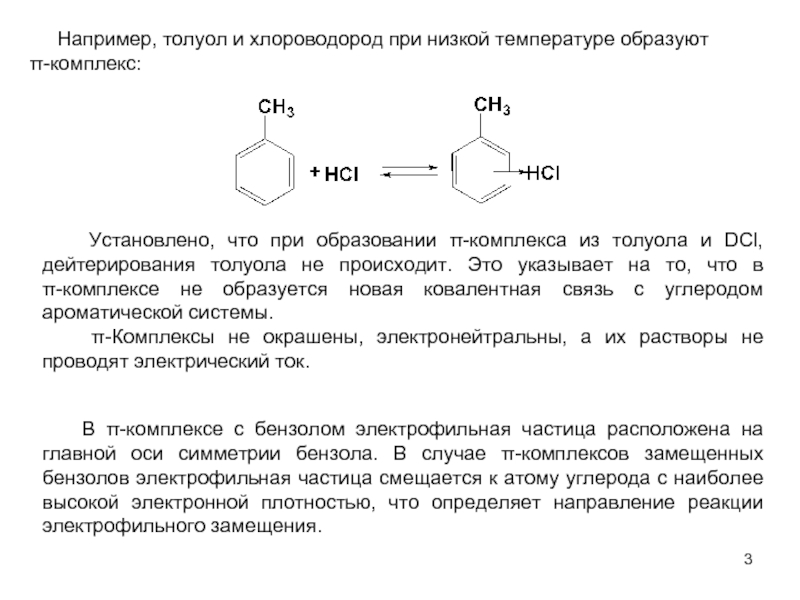
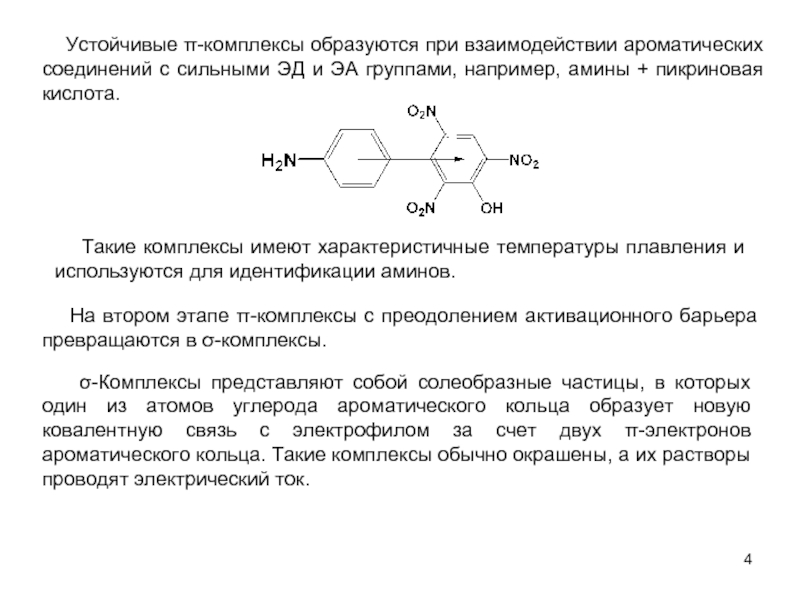
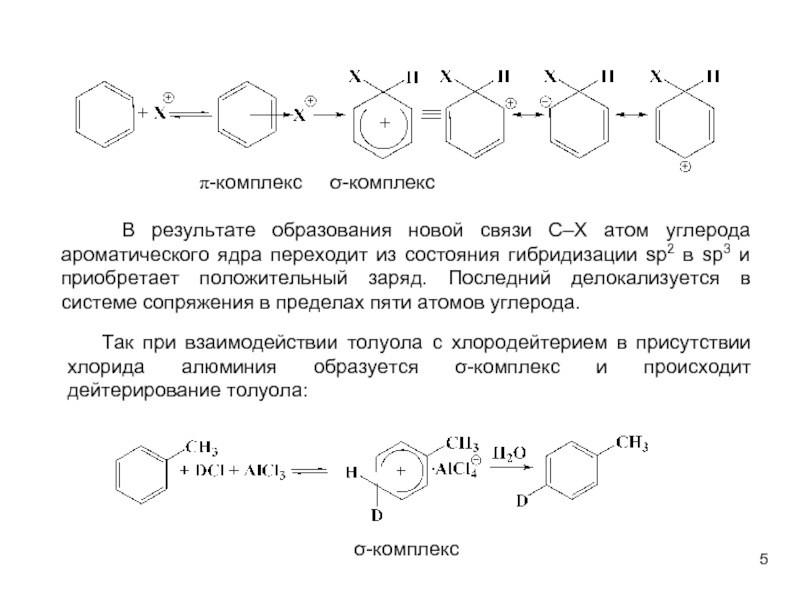
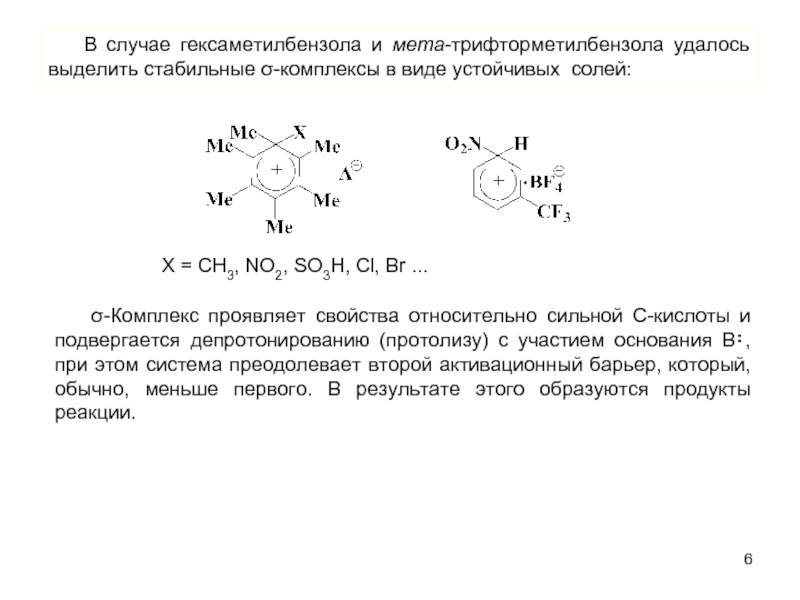
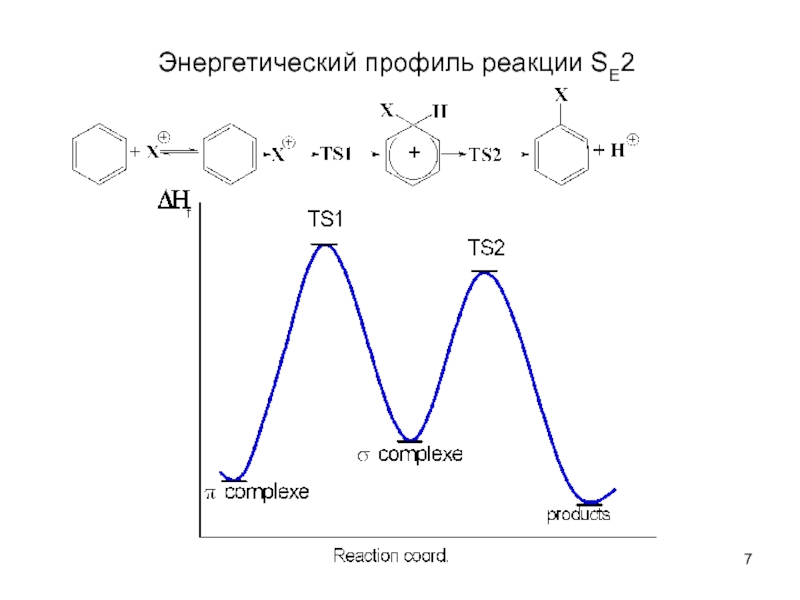
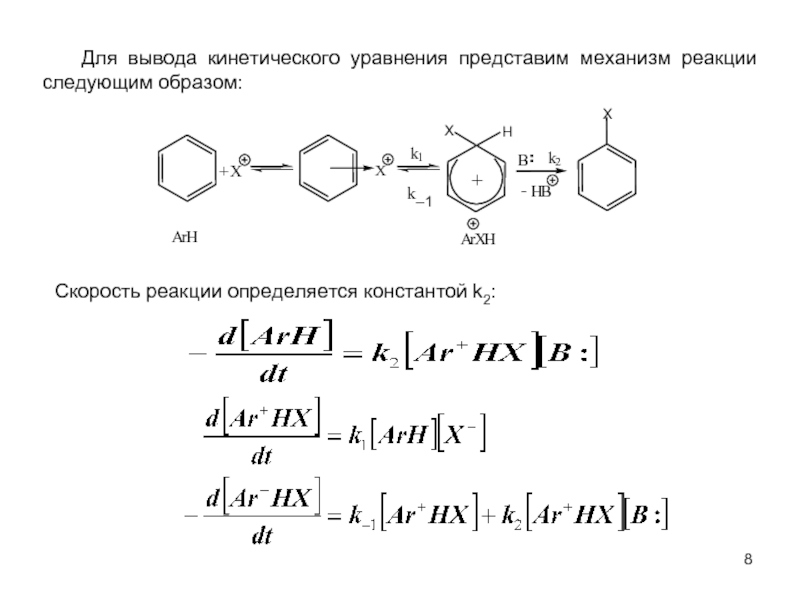
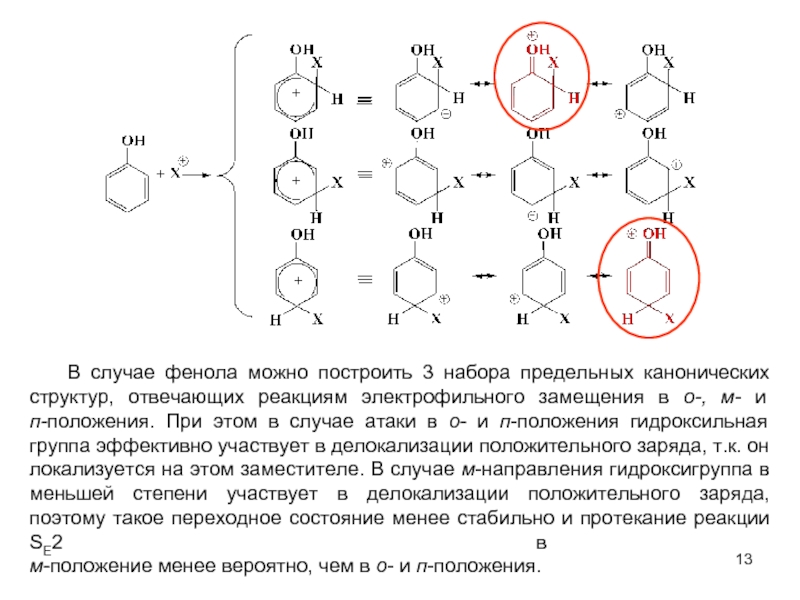
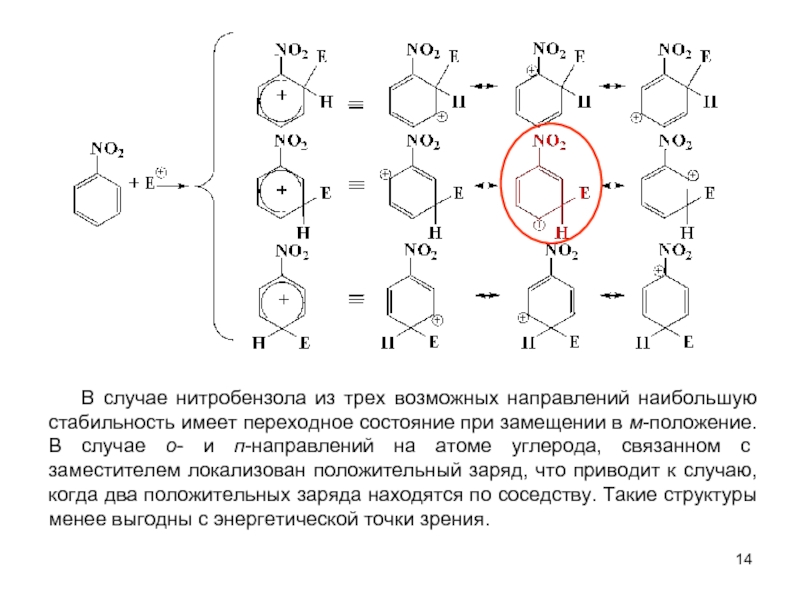
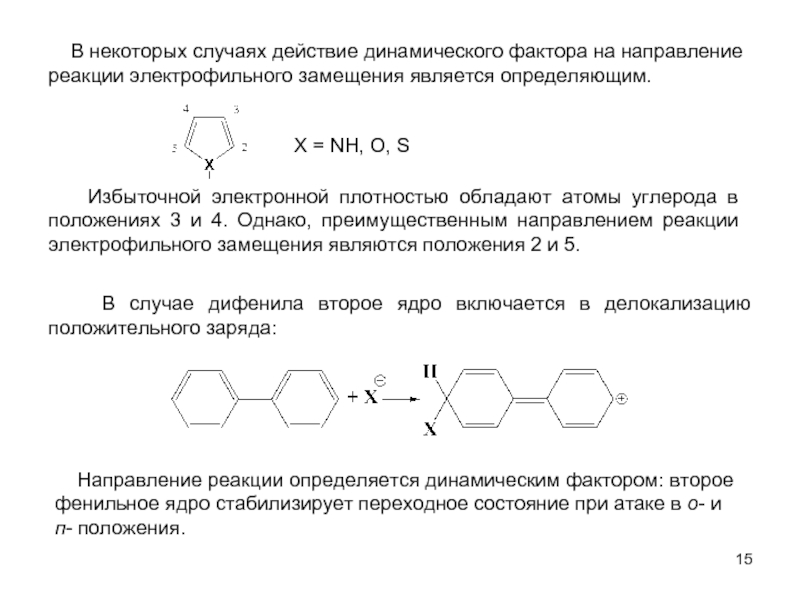
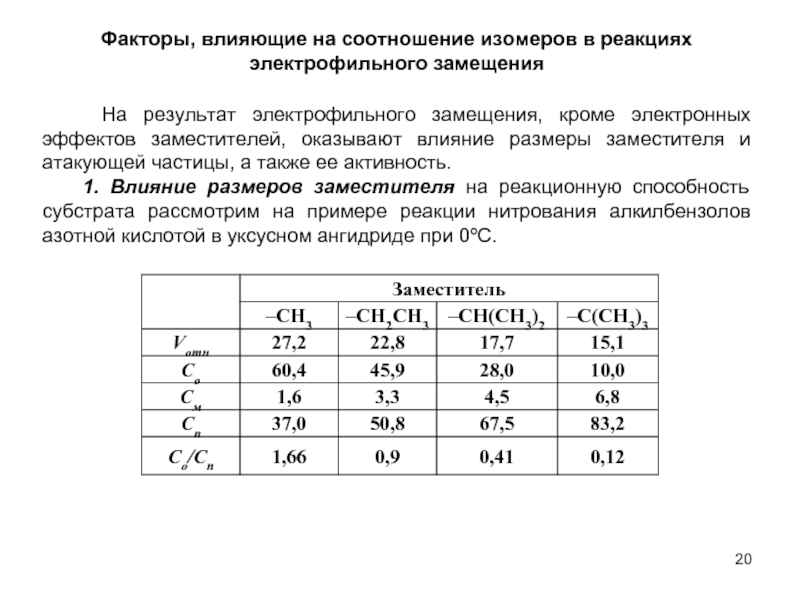
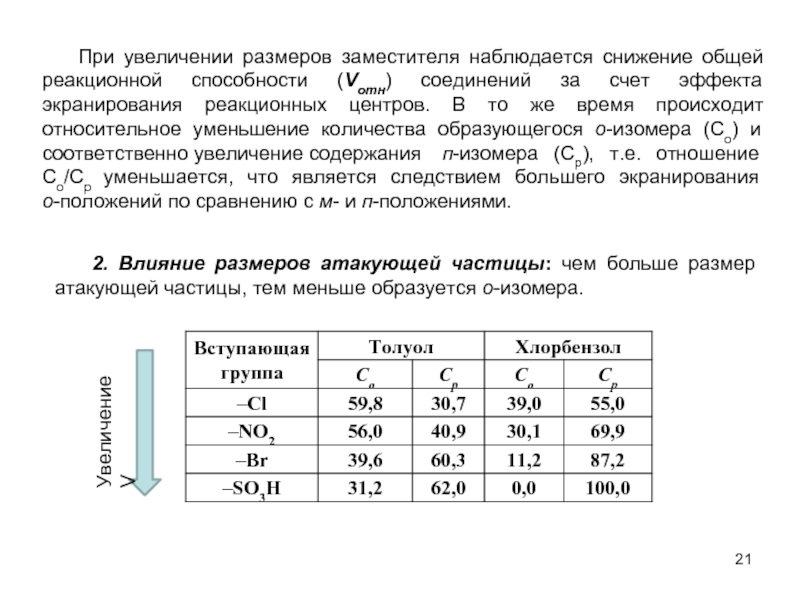
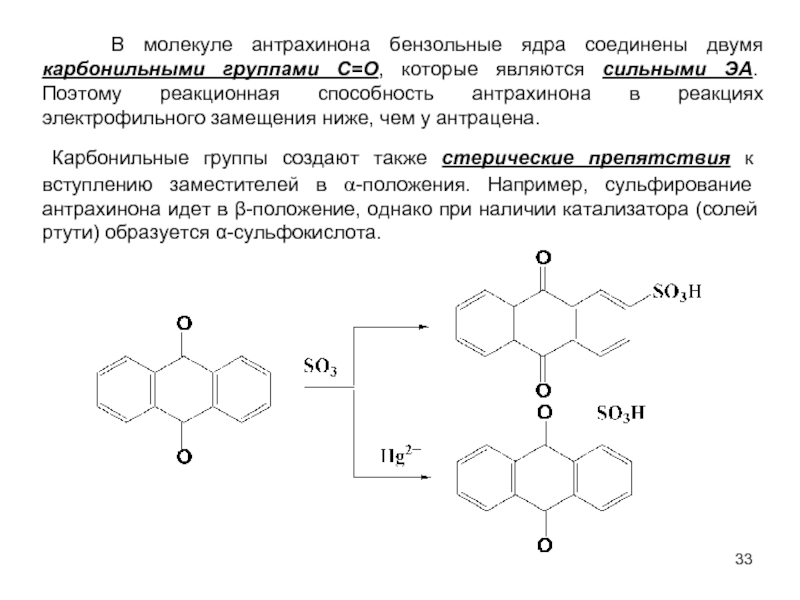
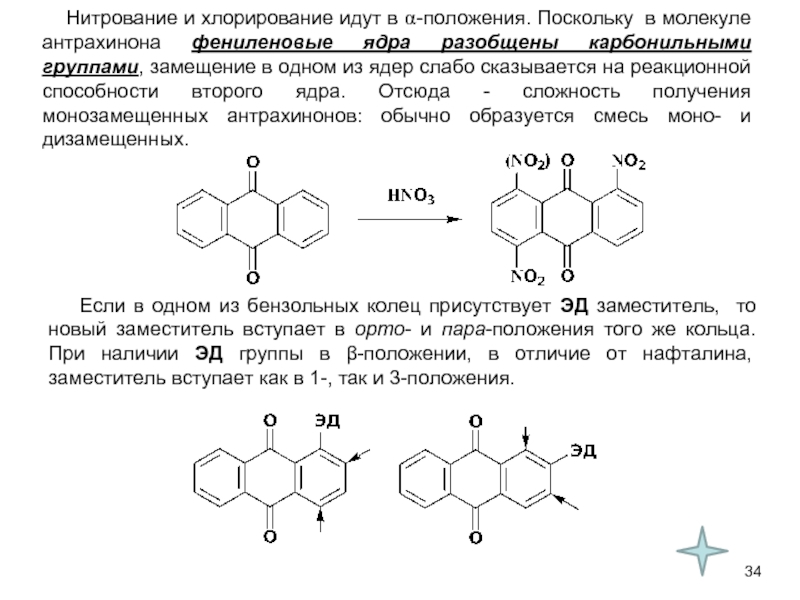
В качестве электрофильных реагентов выступают соединения, которые в условиях реакции образуют катионы или обладают атомом с пониженной электронной плотностью. Атом, на котором локализован положительный заряд, называется электрофильным центром.
нитроний-катион нитрозилхлорид серный ангидрид