- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы ВМС презентация
Содержание
- 1. Растворы ВМС
- 2. План лекции Общие понятия Классификация полимеров Набухание
- 3. Биополимеры Природные высокомолекулярные соединения (ВМС), являющиеся структурной
- 4. ВМС Большой молекулярный вес
- 5. Классификация полимеров по происхождению Природные – встречаются
- 6. Типы пространственной структуры полимеров Линейные – химически
- 7. Конформации макромолекул ВМС Энергетически равноценные пространственные формы,
- 8. Растворы ВМС Самопроизвольно образующиеся гомогенные, однофазные, термодинамически
- 9. Набухание полимеров Увеличение объема и массы ВМС
- 10. Механизм набухания Первая стадия – за счет
- 11. Группы полимеров по способности к набуханию Неограниченно
- 12. Факторы, влияющие на величину набухания Температура Степень
- 13. Ионы электролитов Чем сильнее ион гидратирован, тем
- 14. Реакция среды В кислой или щелочной среде
- 15. Давление набухания Давление, которое оказывает набухающий полимер
- 16. Студни (гели) Твердообразные нетекучие структурированные системы, возникающие
- 17. Получение студней Из растворов ВМС При набухании
- 18. Механизм застудневания В молекуле ВМС различают гидрофильные
- 19. Факторы, влияющие на скорость застудневания Концентрация Природа
- 20. Время и форма частиц Период созревания –
- 21. Электролиты Ускоряют застудневание (соли серной и уксусной
- 22. Реакция среды Заряд белка зависит от реакции
- 23. Изоэлектрическая точка Значение рН, при котором белок
- 24. Тиксотропия. Синерезис Тиксотропия – обратимое превращение студня
- 25. Особенности диффузии в студнях Диффузия крупных частиц
- 26. Осаждение ВМС Растворы ВМС устойчивы и самопроизвольно
- 27. Механизм высаливания Заключается в понижении растворимости ВМС
- 28. Общая схема осаждения ВМС (Кройт)
- 29. Вязкость растворов ВМС Сопротивление жидкости при перемещении
- 30. Закон Ньютона dV F =
- 31. Закон Пуазейля πr4 Q =
- 32. Зависимость вязкости от давления I : Хаотично
- 33. Зависимость вязкости от концентрации Аномальная вязкость растворов
- 34. Способы выражения вязкости Относительная ηотн =
- 35. Уравнение Штаудингера Зависимость вязкости раствора ВМС от
- 36. Определение молекулярной массы полимера Необходимо измерить вязкость
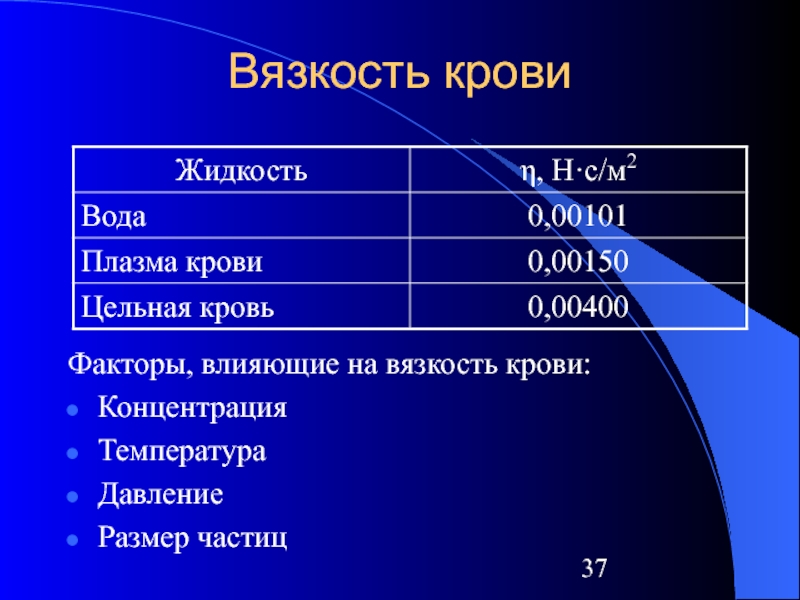
- 37. Вязкость крови Факторы, влияющие на вязкость крови: Концентрация Температура Давление Размер частиц
Слайд 2План лекции
Общие понятия
Классификация полимеров
Набухание ВМС
Застудневание растворов ВМС
Диффузия и периодические реакции в
студнях
Осаждение ВМС
Вязкость растворов ВМС
Осаждение ВМС
Вязкость растворов ВМС
Слайд 3Биополимеры
Природные высокомолекулярные соединения (ВМС), являющиеся структурной основой всех живых организмов (белки,
нуклеиновые кислоты, полисахариды)
Смешанные биополимеры: липопротеиды, гликопротеиды, липополисахариды
Смешанные биополимеры: липопротеиды, гликопротеиды, липополисахариды
Слайд 4ВМС
Большой молекулярный вес
(104 < М < 106 г/моль)
Молекулы состоят из химически связанных между собой сотен и тысяч атомов (макромолекулы)
В их составе регулярно повторяющиеся группы атомов – мономеров
Молекулы состоят из химически связанных между собой сотен и тысяч атомов (макромолекулы)
В их составе регулярно повторяющиеся группы атомов – мономеров
Слайд 5Классификация полимеров по происхождению
Природные – встречаются в природе (натуральный каучук, крахмал,
целлюлоза, белки)
Искусственные (модифицированные) – дополнительно измененные природные полимеры (резина)
Синтетические – полученные методом синтеза (нитрон, капрон, лавсан, синтетический каучук)
Искусственные (модифицированные) – дополнительно измененные природные полимеры (резина)
Синтетические – полученные методом синтеза (нитрон, капрон, лавсан, синтетический каучук)
Слайд 6Типы пространственной структуры полимеров
Линейные – химически не связанные одиночные цепи мономерных
звеньев (каучук, желатин, целлюлоза)
– М – М – М – М –
Разветвленные полимеры (крахмал или гликоген)
М – М –
– М – М
М – М – М –
Лестничные полимеры (целлюлозные и искусственные волокна)
Сетчатые (сшитые) полимеры – трехмерные полимеры, звенья которых образуют единую, химически связанную пространственную сетку
– М – М – М – М –
Разветвленные полимеры (крахмал или гликоген)
М – М –
– М – М
М – М – М –
Лестничные полимеры (целлюлозные и искусственные волокна)
Сетчатые (сшитые) полимеры – трехмерные полимеры, звенья которых образуют единую, химически связанную пространственную сетку
Слайд 7Конформации макромолекул ВМС
Энергетически равноценные пространственные формы, возникающие при повороте мономерных звеньев
полимерных цепей без разрыва химической связи
Слайд 8Растворы ВМС
Самопроизвольно образующиеся гомогенные, однофазные, термодинамически устойчивые и обратимые, не нуждающиеся
в стабилизаторе истинные растворы
Слайд 9Набухание полимеров
Увеличение объема и массы ВМС вследствие поглощения им растворителя. Количественно
измеряется степенью набухания
m – m0 V – V0
α = ----------- · 100% или α = ----------- · 100%
m0 V0
m – m0 V – V0
α = ----------- · 100% или α = ----------- · 100%
m0 V0
Слайд 10Механизм набухания
Первая стадия – за счет сольватации полярных групп ВМС молекулами
растворителя (поглощение 20-50% растворителя от массы полимера)
Вторая стадия – за счет осмотического всасывания растворителя, которое возникает благодаря односторонней диффузии растворителя в полимер
Вторая стадия – за счет осмотического всасывания растворителя, которое возникает благодаря односторонней диффузии растворителя в полимер
Слайд 11Группы полимеров по способности к набуханию
Неограниченно набухающие – набухание идет до
полного растворения полимера (полимеры линейного характера)
Ограниченно набухающие – растворения не происходит, но имеет место увеличение массы (полимеры с сетчатой структурой)
Не испытывающие набухания
Полимеры из сферических макромолекул растворяются без набухания (гемоглобин, гликоген)
Ограниченно набухающие – растворения не происходит, но имеет место увеличение массы (полимеры с сетчатой структурой)
Не испытывающие набухания
Полимеры из сферических макромолекул растворяются без набухания (гемоглобин, гликоген)
Слайд 12Факторы, влияющие на величину набухания
Температура
Степень измельчения полимера
Возраст полимера
Ионы электролитов
Реакция среды
Природа полимера
и растворителя («подобное растворяется в подобном»…)
Слайд 13Ионы электролитов
Чем сильнее ион гидратирован, тем сильнее он препятствует процессу набухания
Лиотропный
ряд (обращенный ряд Гофмейстера):
Ba2+ > Sr2+ > Ca2+ > Mg2+ > Cs+ > Rb+ > K+ > Na+ > Li+ – катионов
CNS- > J- > Br- > NO3- > Cl- > [ацетат]- > [тартрат]2- > [цитрат]3- > F- > SO42- – анионов
Анионы до хлора хорошо адсорбируются на полимерах
Ba2+ > Sr2+ > Ca2+ > Mg2+ > Cs+ > Rb+ > K+ > Na+ > Li+ – катионов
CNS- > J- > Br- > NO3- > Cl- > [ацетат]- > [тартрат]2- > [цитрат]3- > F- > SO42- – анионов
Анионы до хлора хорошо адсорбируются на полимерах
Слайд 14Реакция среды
В кислой или щелочной среде :
В результате адсорбции Н+ и
ОН- появление на макромолекулах избыточного положительного или отрицательного заряда
Повышение степени гидратации макромолекул
Увеличение электростатических сил отталкивания и нарушение целостности структуры полимера
Повышение степени гидратации макромолекул
Увеличение электростатических сил отталкивания и нарушение целостности структуры полимера
Слайд 15Давление набухания
Давление, которое оказывает набухающий полимер на ограничивающие его пористые стенки,
проницаемые для растворителя
Имеет место:
При отеке тканей
При прорастании зерен
При разрушении твердых горных пород корнями растений
Использование в анатомических музеях для расчленения костей черепа
Имеет место:
При отеке тканей
При прорастании зерен
При разрушении твердых горных пород корнями растений
Использование в анатомических музеях для расчленения костей черепа
Слайд 16Студни (гели)
Твердообразные нетекучие структурированные системы, возникающие в результате действия молекулярных сил
сцепления между макромолекулами полимеров
Происходит образование пространственного сетчатого каркаса, ячейки которого заполнены жидким раствором
Имеют значение для биологии, медицины, различных производств
Происходит образование пространственного сетчатого каркаса, ячейки которого заполнены жидким раствором
Имеют значение для биологии, медицины, различных производств
Слайд 17Получение студней
Из растворов ВМС
При набухании полимеров (столярный клей, сухой желатин, крахмал)
В
результате реакций полимеризации и конденсации (получение пластмасс, каучука)
Под воздействием ферментативных процессов (простокваша, кефир, сыр)
Под воздействием ферментативных процессов (простокваша, кефир, сыр)
Слайд 18Механизм застудневания
В молекуле ВМС различают гидрофильные (-OH, -COOH, -NH2, -SH) и
гидрофобные (-CH-, -CH2-) участки
Макромолекулы соединяются между собой гидрофобными участками
Связи образуются за счет взаимодействия полярных групп макромолекул
Взаимодействуя между собой, макромолекулы образуют ячеистое строение студня
Макромолекулы соединяются между собой гидрофобными участками
Связи образуются за счет взаимодействия полярных групп макромолекул
Взаимодействуя между собой, макромолекулы образуют ячеистое строение студня
Слайд 19Факторы, влияющие на скорость застудневания
Концентрация
Природа веществ
Температура
Время процесса
Форма частиц
Электролиты
Реакция среды
Слайд 20Время и форма частиц
Период созревания – время, необходимое для образования ячеистой
объемной сетки (от нескольких минут до недель)
Растворы соединений, имеющих нитевидные или лентообразные частицы, хорошо застудневают
Растворы соединений, имеющих нитевидные или лентообразные частицы, хорошо застудневают
Слайд 21Электролиты
Ускоряют застудневание (соли серной и уксусной кислот)
Замедляют (хлориды и йодиды)
Приостанавливают (роданиды)
Прямой
лиотропный ряд Гофмейстера:
SO42- > C6H5O73- > C4H4O62- > C2H4O2- > Cl-
цитрат тартрат ацетат
> NO3- > Br- > J- > CNS-
На застудневание влияют главным образом анионы
SO42- > C6H5O73- > C4H4O62- > C2H4O2- > Cl-
цитрат тартрат ацетат
> NO3- > Br- > J- > CNS-
На застудневание влияют главным образом анионы
Слайд 22Реакция среды
Заряд белка зависит от реакции среды; от соотношения количества –СООН
и –NH2 групп
В кислой среде:
СООН- СООН
R + H+ ⮀ R
NH3+ NH3+
В щелочной среде:
СООН- СОО-
R + ОH- ⮀ R
NH3+ NH3ОН
В кислой среде:
СООН- СООН
R + H+ ⮀ R
NH3+ NH3+
В щелочной среде:
СООН- СОО-
R + ОH- ⮀ R
NH3+ NH3ОН
Слайд 23Изоэлектрическая точка
Значение рН, при котором белок находится в изоэлектрическом состоянии (т.е.
в состоянии, при котором число разноименных зарядов в белковой частице одинаково и ее общий заряд равен нулю)
В изоэлектрической точке набухание минимально, а застудневание максимально
В изоэлектрической точке набухание минимально, а застудневание максимально
Слайд 24Тиксотропия. Синерезис
Тиксотропия – обратимое превращение студня в раствор и наоборот
Синерезис –
процесс самопроизвольного расслаивания студней
Секреция желез
Образование патологических опухолей
Старение организма
Скорость синерезиса возрастает с повышением температуры и увеличением концентрации
Секреция желез
Образование патологических опухолей
Старение организма
Скорость синерезиса возрастает с повышением температуры и увеличением концентрации
Слайд 25Особенности диффузии в студнях
Диффузия крупных частиц и крупных молекул затруднена
Отсутствие перемешивания
и конвекции
Специфически протекают реакции осаждения:
K2Cr2O7 + 2AgNO3 → Ag2Cr2O7↓ + 2KNO3
Явление слоистости у минералов (яшма, агат)
Образование желчных и почечных камней
Кольца Лизеганга:
Специфически протекают реакции осаждения:
K2Cr2O7 + 2AgNO3 → Ag2Cr2O7↓ + 2KNO3
Явление слоистости у минералов (яшма, агат)
Образование желчных и почечных камней
Кольца Лизеганга:
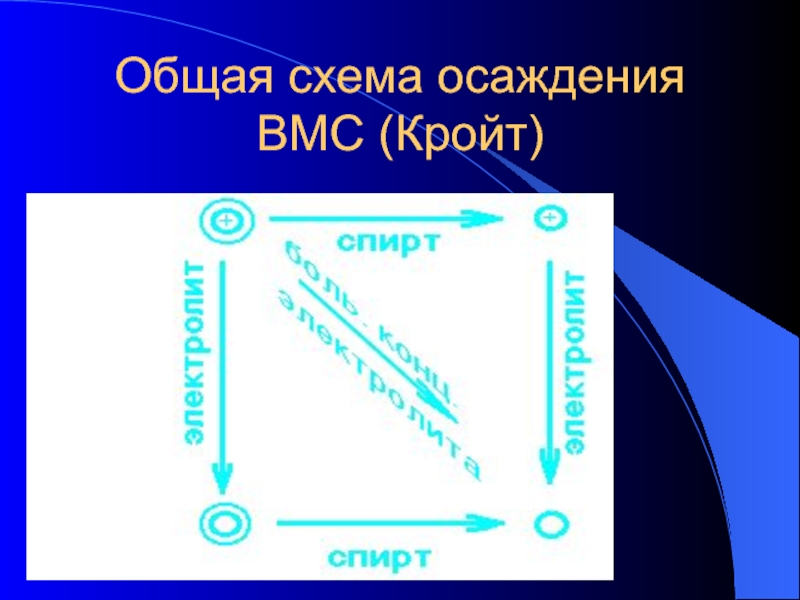
Слайд 26Осаждение ВМС
Растворы ВМС устойчивы и самопроизвольно не осаждаются
Коацервация – слияние водных
оболочек нескольких частиц без объединения самих частичек (используется при микрокапсулировании лекарств)
Ультрацентрифугирование
Высаливание – осаждение ВМС в концентрированных растворах электролитов
Ультрацентрифугирование
Высаливание – осаждение ВМС в концентрированных растворах электролитов
Слайд 27Механизм высаливания
Заключается в понижении растворимости ВМС в концентрированных растворах электролитов
Малые концентрации
солей – осаждение наиболее крупных, тяжелых и обладающих наименьшим зарядом
При повышении концентрации солей – осаждение более мелких и устойчивых белковых фракций
При повышении концентрации солей – осаждение более мелких и устойчивых белковых фракций
Слайд 29Вязкость растворов ВМС
Сопротивление жидкости при перемещении одной ее части относительно другой
Течение
можно рассматривать как перемещение тонких слоев жидкости, движущихся параллельно друг другу
Поток жидкости без перемешивания слоев – ламинарный
При увеличении скорости слои образуют завихрения и перемешиваются – турбулентный поток
Ламинарное течение характеризуется двумя законами: Ньютона и Пуазейля
Поток жидкости без перемешивания слоев – ламинарный
При увеличении скорости слои образуют завихрения и перемешиваются – турбулентный поток
Ламинарное течение характеризуется двумя законами: Ньютона и Пуазейля
Слайд 30Закон Ньютона
dV
F = ηS-------
dX
F – сила вязкого
течения
η – вязкость
S – площадь контакта слоев
dV – разность скоростей двух слоев
dX – расстояние между слоями
η – вязкость
S – площадь контакта слоев
dV – разность скоростей двух слоев
dX – расстояние между слоями
Слайд 31Закон Пуазейля
πr4
Q = Pτ------
8ηl
Q – количество жидкости, протекающей
через трубку
r – радиус трубки
l – длина трубки
P – давление столба жидкости
τ – время
Законы применимы для чистых жидкостей и истинных растворов
r – радиус трубки
l – длина трубки
P – давление столба жидкости
τ – время
Законы применимы для чистых жидкостей и истинных растворов
Слайд 32Зависимость вязкости от давления
I : Хаотично расположенные молекулы с повышением давления
ориентируются вдоль слоев жидкости
II : Ориентация молекул завершена
III : Возрастание вязкости связано с переходом в турбулентный режим
II : Ориентация молекул завершена
III : Возрастание вязкости связано с переходом в турбулентный режим
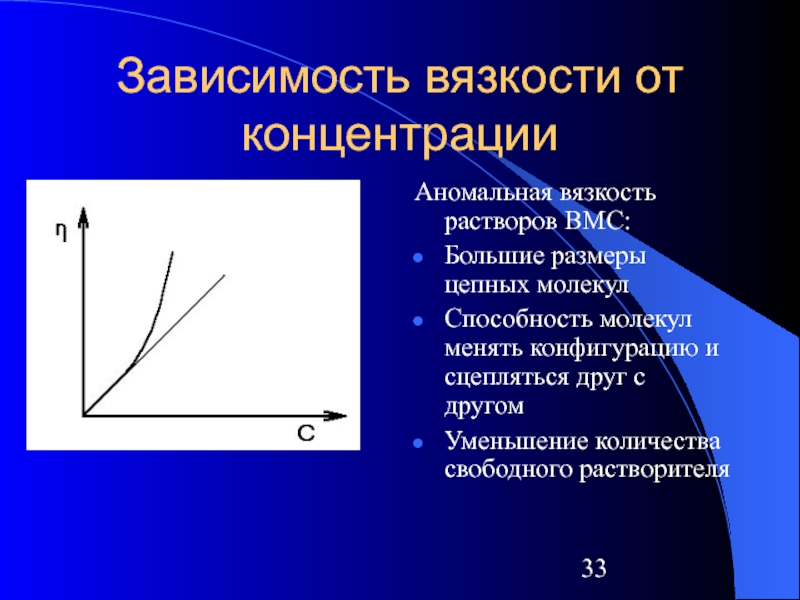
Слайд 33Зависимость вязкости от концентрации
Аномальная вязкость растворов ВМС:
Большие размеры цепных молекул
Способность молекул
менять конфигурацию и сцепляться друг с другом
Уменьшение количества свободного растворителя
Уменьшение количества свободного растворителя
Слайд 34Способы выражения вязкости
Относительная
ηотн = η / η0
Удельная
(η – η0)
η
ηуд = ----------- = ----- – 1
η0 η0
Приведенная вязкость (число вязкости)
ηпривед = ηуд / С
Характеристическая вязкость (предельное число вязкости)
lim (ηуд / С) = [η]; при С → 0
ηуд = ----------- = ----- – 1
η0 η0
Приведенная вязкость (число вязкости)
ηпривед = ηуд / С
Характеристическая вязкость (предельное число вязкости)
lim (ηуд / С) = [η]; при С → 0
Слайд 35Уравнение Штаудингера
Зависимость вязкости раствора ВМС от его концентрации и молекулярного веса
[η]
= К·Мα
К – постоянная для данного полимергомологического ряда
α – отражает зависимость вязкости от формы макромолекул (½ ≤ α ≤ 1)
М – молекулярный вес
С ростом температуры вязкость растворов ВМС быстро падает
К – постоянная для данного полимергомологического ряда
α – отражает зависимость вязкости от формы макромолекул (½ ≤ α ≤ 1)
М – молекулярный вес
С ростом температуры вязкость растворов ВМС быстро падает
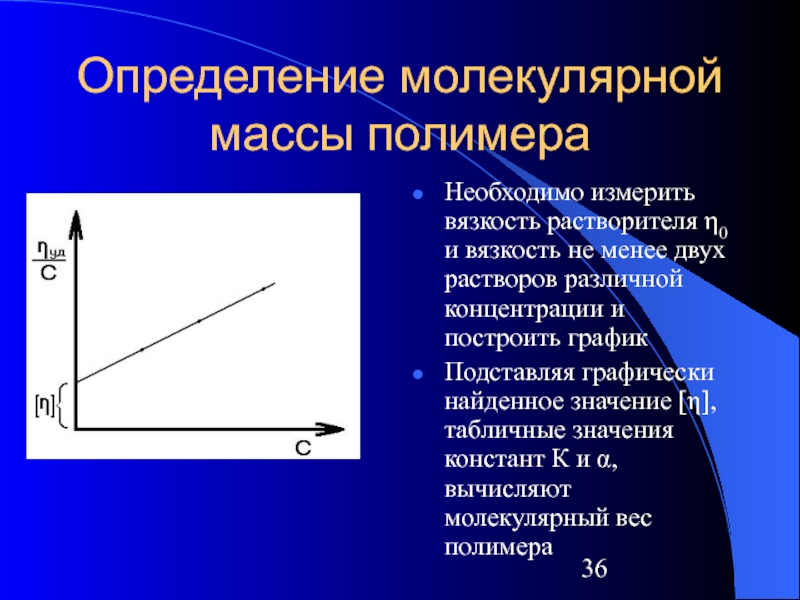
Слайд 36Определение молекулярной массы полимера
Необходимо измерить вязкость растворителя η0 и вязкость не
менее двух растворов различной концентрации и построить график
Подставляя графически найденное значение [η], табличные значения констант К и α, вычисляют молекулярный вес полимера
Подставляя графически найденное значение [η], табличные значения констант К и α, вычисляют молекулярный вес полимера
































![Уравнение ШтаудингераЗависимость вязкости раствора ВМС от его концентрации и молекулярного веса [η] = К·МαК – постоянная](/img/tmb/5/424032/e75359ed4da3aea856043c15dfe17c68-800x.jpg)