- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации презентация
Содержание
- 1. Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации
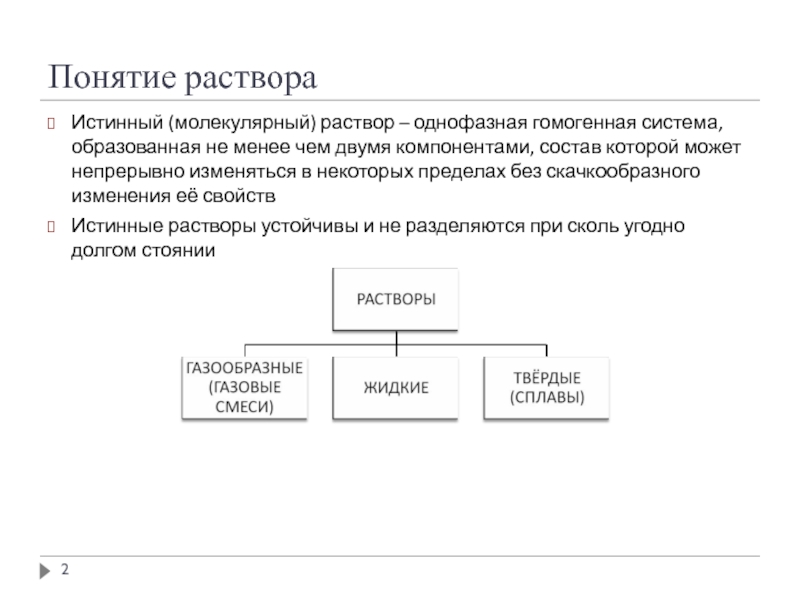
- 2. Понятие раствора Истинный (молекулярный) раствор – однофазная
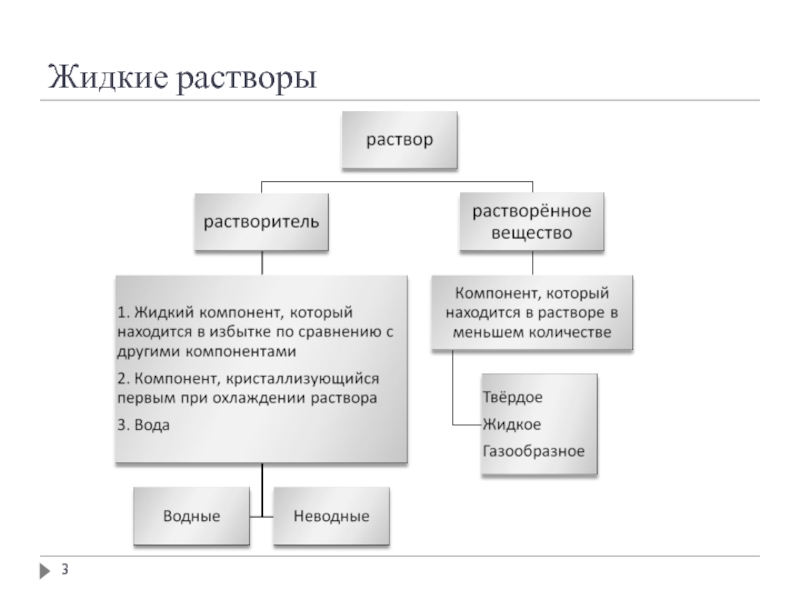
- 3. Жидкие растворы
- 4. Движущая сила образования растворов (1) Энтропийный и
- 5. Движущая сила образования растворов (2) Независимо от
- 6. Растворимость Процесс растворения протекает самопроизвольно до тех
- 7. Способы выражения концентрации растворов Концентрация – величина,
- 8. Закон Рауля Парциальное давление насыщенного пара компонента
- 9. Закон Рауля для бинарного раствора
- 10. Закон Вант -Гоффа.
- 12. Растворы электролитов и неэлектролитов.
- 13. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Электролиты, как сильные,
- 14. Электролитическая диссоциация предполагает, что молекулы электролита в растворе
- 15. С
- 17. 1) образование малодиссоциирующих соединений: а) HCl
- 18. Спасибо за внимание!!!
Слайд 1Физ. Химия растворов. Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации. Реакция
Слайд 2Понятие раствора
Истинный (молекулярный) раствор – однофазная гомогенная система, образованная не менее
Истинные растворы устойчивы и не разделяются при сколь угодно долгом стоянии
Слайд 4Движущая сила образования растворов (1)
Энтропийный и энтальпийный факторы
При растворении газов в
При растворении кристаллов в жидкости энтропия возрастает (ΔS>0)
Чем сильнее взаимодействие растворённого вещества и растворителя, тем больше роль энтальпийного фактора в образовании раствора
> 0 < 0
Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят
разрушение кристаллической решётки на свободные ионы
и взаимодействие образовавшихся ионов с молекулами растворителя
Слайд 5Движущая сила образования растворов (2)
Независимо от знака энтальпии при растворении всегда
т.е.
Для жидких растворов процесс идёт самопроизвольно (ΔG<0) до установления динамического равновесия между твёрдой и жидкой фазами
Слайд 6Растворимость
Процесс растворения протекает самопроизвольно до тех пор, пока химический потенциал чистого
При в системе устанавливается равновесие :
чистый компонент ↔ растворённый компонент
При этих условиях больше вещества раствориться не может
Раствор, в котором при данных условиях вещество больше не может растворяться, называется насыщенным
Концентрация растворённого вещества в насыщенном растворе называется растворимостью
В справочниках – масса растворённого вещества в 100г (1000г) растворителя
Растворимость зависит от:
природы растворённого вещества и растворителя
взаимодействия частиц растворённого веществ между собой и с молекулами растворителя
внешних условий (температуры и давления)
Слайд 7Способы выражения концентрации растворов
Концентрация – величина, характеризующая относительное содержание данного компонента
Массовая доля растворённого вещества
Мольная доля растворённого вещества
Объёмная доля растворённого вещества
Моляльность
Молярность
Молярная концентрация эквивалентность (нормальность)
Титр
Слайд 8Закон Рауля
Парциальное давление насыщенного пара компонента раствора над раствором pi прямо
- давление насыщенного пара над чистым компонентом
Для бинарного раствора:
давление насыщенного пара растворителя pр-ля над раствором равно его давлению над чистым растворителем , умноженному на мольную долю растворителя в растворе x1:
Отсюда следует, что , так как х1< 1
Уменьшение давления насыщенного пара над раствором может быть объяснено уменьшением поверхности испарения при добавлении растворяемого вещества (на поверхности оказывается меньше способных испаряться молекул растворителя, ведь часть места занимает растворённое вещество)
Идеальные растворы подчиняются закону Рауля по всем компонентам
Слайд 9Закон Рауля для бинарного раствора
Относительное понижение давления насыщенного пара растворителя над
Общее давление насыщенного пара над раствором равно сумме парциальных давлений насыщенных паров компонентов раствора:
Давление пара линейно зависит от состава
Слайд 13ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Электролиты, как сильные, так и слабые и даже очень
Слайд 14Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и
Теория выдвигает следующие постулаты:
В растворах электролиты распадаются на ионы, т.е. диссоциируют.
Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
Диссоциация — явление обратимое и равновесное.
Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
α = n/N
Слайд 15 С точки зрения степени диссоциации, по силе электролиты делятся на сильные
Слайд 16
Далее приведем примеры реакций, протекающих практически необратимо: