- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Классификация растворов презентация
Содержание
- 1. Растворы. Классификация растворов
- 2. Растворы. Классификация растворов Растворы – это
- 3. В зависимости от размеров частиц растворы делятся
- 4. Движущими силами образования растворов являются энтропийный и
- 5. Знак изменения энтальпии растворения определяется знаком
- 6. При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS
- 7. Концентрация насыщенного раствора определяется растворимостью вещества при
- 8. В химической практике наиболее важны растворы, приготовленные
- 9. Концентрация растворов Важной характеристикой растворов служит
- 10. Объемная доля растворенного вещества σ (B) выражается
- 11. Мольная доля растворенного вещества χ (B) выражается
- 12. К размерным концентрациям относятся следующие концентрации: Моляльность
- 13. Титр раствора вещества B (TB) определяется массой растворенного
- 14. Растворимостью вещества при данных условиях называют его
- 15. Растворы неэлектролитов По термодинамическому признаку
- 16. Если раствор сохраняет свойства идеальности при любых
- 17. Закон Генри Если растворенное вещество характеризуется
- 18. В таблице приведены константы Генри некоторых газов
- 19. Законы Рауля первый закон Рауля –
- 20. Относительное понижение упругости пара над раствором равно
- 21. Эбулиоскопическая константа Выразим мольную долю через моляльную концентрацию Для двухкомпонентного раствора . При Сm (B)
- 22. Проведя аналогичное исследование, касающееся понижения температуры замерзания
- 23. Kэб и Kкр являются экстраполяционными величинами от
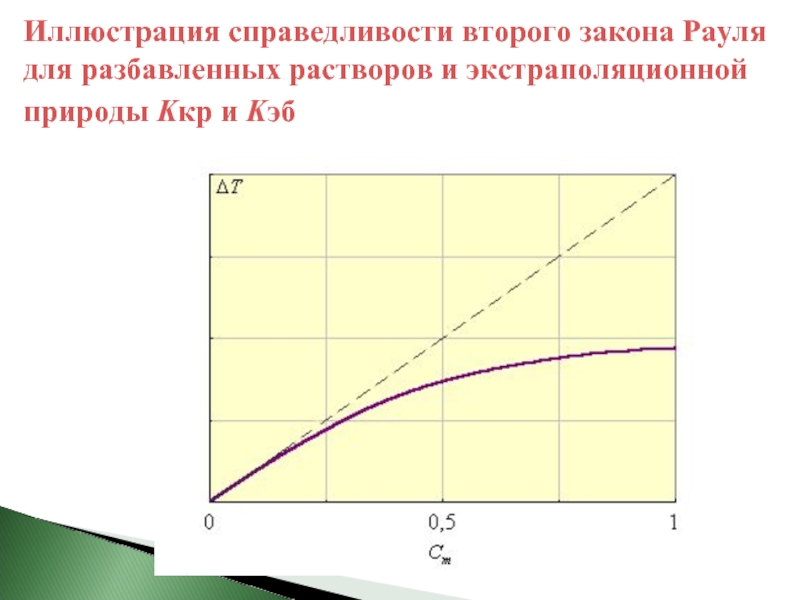
- 24. Иллюстрация справедливости второго закона Рауля для разбавленных
- 25. Криоскопические и эбулиоскопические константы для воды и бензола (град/моль–1∙кг)
- 26. Второй закон Рауля дает легко осуществимую экспериментально
- 27. Осмос
- 28. принцип Вант-Гоффа: осмотическое давление идеального раствора равно
- 29. Рассмотрим роль осмоса в водном режиме растительной
- 30. Если клетку поместить в чистую воду или
- 31. У животных клеток нет клеточной стенки, поэтому
Слайд 2Растворы. Классификация растворов
Растворы – это гомогенные (однофазные) системы переменного состава,
По характеру агрегатного состояния растворы могут быть:
газообразными,
жидкими и
твердыми.
Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами.
В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
Слайд 3В зависимости от размеров частиц растворы делятся на истинные и коллоидные.
В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя.
Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Слайд 4Движущими силами образования растворов являются энтропийный и энтальпийный факторы.
При растворении
Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов.
Слайд 5
Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов,
разрушение кристаллической решетки на свободные ионы (ΔH > 0) и
взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0).
Слайд 6При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ
Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
Слайд 7Концентрация насыщенного раствора определяется растворимостью вещества при данной температуре.
Растворы с
Растворимость для различных веществ колеблется в значительных пределах и зависит:
от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также
от внешних условий (давления, температуры и т. д.)
Слайд 8В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя.
Именно жидкие смеси в химии называют просто растворами.
Наиболее широко применяемым неорганическим растворителем является вода.
Растворы с другими растворителями называются неводными.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
Слайд 9Концентрация растворов
Важной характеристикой растворов служит их концентрация, которая выражает относительное
К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:
где m (B) и m (A) – масса растворенного вещества B и масса растворителя A.
Слайд 10Объемная доля растворенного вещества σ (B) выражается в долях единицы или
где Vi – объем компонента раствора, V (B) – объем растворенного вещества B. Объемные проценты называют градусами*).
*) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm.
Слайд 11Мольная доля растворенного вещества χ (B) выражается соотношением:
Сумма мольных долей k
Слайд 12К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества Cm (B) определяется количеством
Молярная концентрация эквивалентов вещества B CЭ (B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента
Слайд 13Титр раствора вещества B (TB) определяется массой растворенного вещества в г, содержащегося
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода–ацетон, бензол–толуол, жидкие натрий–калий).
Большинство соединений ограниченно растворимы (вода–бензол, вода–бутиловый спирт, вода–поваренная соль), а многие малорастворимы или практически нерастворимы (вода–BaSO4, вода–бензин).
Слайд 14Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе.
В таком растворе достигается равновесие между растворяемым веществом и раствором.
В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Слайд 15Растворы неэлектролитов
По термодинамическому признаку
Для идеальных растворов предполагается, что между компонентами раствора любыми взаимодействиями можно пренебречь.
Следовательно, любое свойство растворяемых веществ при их смешении не должно меняться.
Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Рауля будет аддитивной величиной.
Слайд 16Если раствор сохраняет свойства идеальности при любых концентрациях, его называют идеальным
Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ → 0. Во всех прочих случаях раствор считается реальным.
Взаимодействие между компонентами раствора, выражаемое через энтальпию сольвации ΔHсольв, служит в определенных пределах мерой идеальности раствора. Д. И. Менделеев показал, что взаимодействие между компонентами раствора может рассматриваться как химический процесс образования соединений переменного состава – сольватов.
Этот подход лежит в основе химической или сольватной теории растворов.
Если при кристаллизации твердая фаза содержит молекулы растворителя, то ее называют кристаллосольватом.
Слайд 17Закон Генри
Если растворенное вещество характеризуется большой упругостью пара по сравнению
KH – константа Генри.
Слайд 18В таблице приведены константы Генри некоторых газов для воды.
KH определяется выбором
Слайд 19Законы Рауля
первый закон Рауля – парциальное давление над раствором прямо
После подстановки χA = 1 – χB и несложных преобразований
Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
Слайд 20Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества.
Зависимость повышения температуры кипения ΔTкип и понижения температуры замерзания ΔTзам раствора от концентрации растворенного вещества.
Слайд 21Эбулиоскопическая константа
Выразим мольную долю через моляльную концентрацию Для двухкомпонентного раствора
Из подобия треугольников следует
По определению, при (B) = 1 моль повышение температуры равно – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
Слайд 22Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим
где Kкр
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
Слайд 23Kэб и Kкр являются экстраполяционными величинами от малых концентраций растворенного вещества,
При Cm (B) = 1 - этот закон уже не действует.
Слайд 24Иллюстрация справедливости второго закона Рауля для разбавленных растворов и экстраполяционной природы
Слайд 26Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс
Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = gB ∙ 1000 / μB ∙gA, где gA – вес растворителя, gB – вес растворенного вещества, μB – его молярная масса.
Тогда из ΔT = Kкр · m получим молярную массу растворенного вещества:
Слайд 27Осмос
Если
Слайд 28принцип Вант-Гоффа:
осмотическое давление идеального раствора равно тому давлению, которое оказывало бы
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
Слайд 29Рассмотрим роль осмоса в водном режиме растительной клетки. Осмотическое давление жидкости,
Если клетка находится в контакте с гипертоническим раствором, вода выходит из неё путём осмоса через плазматическую мембрану. Протопласт (живое содержимое клетки) при этом уменьшается в объёме, сморщивается и в конце концов отстаёт от клеточной стенки. Этот процесс называют плазмолизом.
Процесс плазмолиза обычно обратим.
Слайд 30Если клетку поместить в чистую воду или гипотонический раствор, вода путём
Тургорное давление препятствует дальнейшему поступлению воды в клетку. Именно тургорное давление поддерживает стебли растений в вертикальном положении, придаёт растениям прочность и устойчивость.
Изотонические растворы не оказывают влияния на водный режим клетки.
Слайд 31У животных клеток нет клеточной стенки, поэтому они более чувствительны к
Например, осмотическое давление крови человека – 800 000 Н/м2. Такое же осмотическое давление имеет 0,9 %-ный раствор хлорида натрия.
Физиологический раствор, изотоничный крови, широко применяется в медицине.