- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Классификация дисперсных систем презентация
Содержание
- 1. Растворы. Классификация дисперсных систем
- 2. Сложные химические системы могут быть получены из
- 3. В случае, когда распределенная фаза диспергирована до
- 4. Дисперсные системы Суспензии (suspensio) — это такие системы,
- 5. Процесс растворения твердого тела в жидкости является
- 6. Концентрации (размерные величины) Процентная концентрация (массовая)
- 7. Растворимость - предельное количество растворяющегося в растворе
- 8. Понятие об идеальных растворах Идеальный раствор –
- 10. Коллигативные свойства растворов Коллигативные (общие) свойства растворов
- 11. Фазовая диаграмма чистой воды Изменение фазовой диаграммы
- 12. Следствия из закона Рауля повышение температуры кипения
- 13. Явление осмоса Причина осмоса –
- 14. Электролитическая диссоциация Электролитическая диссоциация – процесс распада
- 15. Количественные характеристики электролитической диссоциации Константа электролитической диссоциации
- 16. Связь константы диссоциации и степени диссоциации
- 17. электролиты Сильные Диссоциируют в растворе полностью
- 18. Электролитическая диссоциация воды Вода – слабый электролит:
Слайд 2Сложные химические системы могут быть получены из чистых химических веществ в
Дисперсные системы – это системы, состоящие из сплошной среды (называемой дисперсионной средой) с распределенным в ней веществом (дисперсной фазой), которое состоит из отдельных частиц с большой удельной поверхностью.
Растворы – это гомогенные системы переменного состава, образованные не менее чем двумя компонентами
Растворитель - тот компонент, который находится в жидкой фазе и, как правило, превалирует количественно
Образование раствора является самопроизвольным процессом, неизбежно протекающем при контакте фаз. Это - принципиальное следствие Второго Начала термодинамики, поскольку общая энтропия при смешении растет
Энергетической характеристикой процесса растворения является изменение энергии Гиббса в ходе этого процесса.
абсолютно нерастворимых веществ нет
может быть как положительной, так и отрицательной.
Процессы
при растворении
Положительна и очень велика
Отрицательна при любом значении энтальпии.
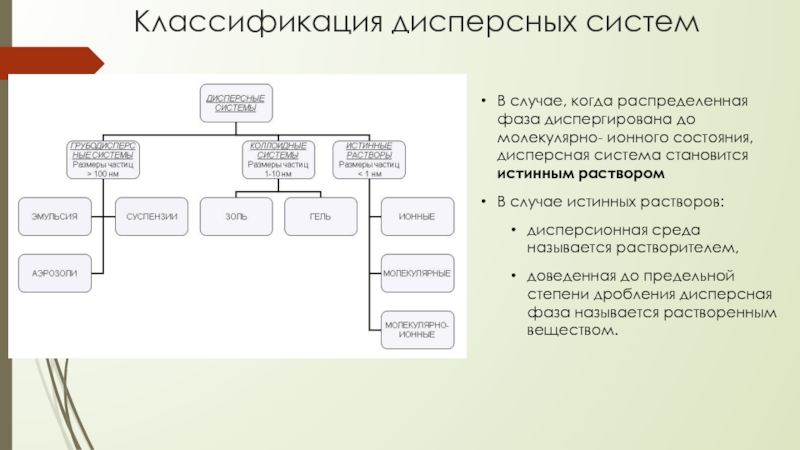
Слайд 3В случае, когда распределенная фаза диспергирована до молекулярно- ионного состояния, дисперсная
В случае истинных растворов:
дисперсионная среда называется растворителем,
доведенная до предельной степени дробления дисперсная фаза называется растворенным веществом.
Классификация дисперсных систем
Слайд 4Дисперсные системы
Суспензии (suspensio) — это такие системы, которые состоят из раздробленного твердого
Эмульсии (emulsus) представляют собой дисперсные системы, в которых и дисперсная фаза, и дисперсионная среда представлены взаимонерастворимыми или мало взаиморастворимыми жидкостями. Эмульсии относятся к грубодисперсным системам, в которых размер дисперсных частиц (капелек) колеблется в пределах от 1 до 150 мкм, но в некоторых случаях они бывают и более высокодисперсными
Золи - жидкая (лиозоль) или газообразная (аэрозоль) дисперсионная среда, в объеме которой распределена другая (дисперсная) фаза в виде капелек жидкости, пузырьков газа или мелких твердых частиц
Гели - состоят, по крайней мере, из двух компонентов, один из которых образует непрерывную трёхмерную макромолекулярную сетку, выступающую в роли каркаса, пустоты в которой заполнены низкомолекулярным растворителем — дисперсионной средой.
Слайд 5Процесс растворения твердого тела в жидкости является результатом явления сольватации –
В результате этого взаимодействия возникают сольваты – образования молекулярных размеров, представляющие собой ассоциаты частиц растворяемого вещества (A) с молекулами растворителя (R):
В случае, когда растворителем является вода, процесс называется гидратацией, а ассоциаты – гидратами.
Процесс сольватации может приводить к распаду молекул растворяемого вещества на заряженные частицы - электролитическая диссоциация.
Слайд 6Концентрации (размерные величины)
Процентная концентрация (массовая) – количество граммов растворенного вещества
Процентная концентрация (объемная) – количество миллилитров растворенного вещества в 100 миллилитров раствора [об.%]
Молярная концентрация (молярность) – количество молей растворенного вещества в литре раствора [моль/л]
Массовая концентрация – масса растворенного вещества в литре раствора [г/л]
Моляльная концентрация (моляльность) – количество молей растворенного вещества в 1000 граммах растворителя. [моль/1000 г р-рителя]
Нормальная концентрация (нормальность) – количество молей химического эквивалента растворенного вещества в литре раствора [моль-экв/л]
Доли (безразмерные величины)
Мольная доля – отношение числа молей растворенного компонента к общему числу молей раствора.
Массовая доля – отношение массы растворенного компонента к общей массе раствора.
Объемная доля (для смесей газов и растворов ж-ж) – отношение объема растворенного компонента к сумме объемов растворителя и растворенного вещества до начала процесса растворения.
ХАРАКТЕРИСТИКИ РАСТВОРОВ
Слайд 7Растворимость - предельное количество растворяющегося в растворе вещества. [г/100г растворителя].
Чем
РАСТВОРЫ
ненасыщенные
содержание растворенного вещества в растворе меньше растворимости
насыщенные
пересыщенные
содержание растворенного вещества в растворе равно растворимости
содержание растворенного вещества в растворе больше растворимости
AmBn ↔ mAn+ + nBm-
Слайд 8Понятие об идеальных растворах
Идеальный раствор – это раствор, при образовании которого
Для газов, объем которых при переходе в раствор значительно уменьшается (имеется в виду объем чистого газа и объем раствора, содержащего то же количество компонента), зависимость растворимости от давления характеризуется законом Генри:
где Pk – парциальное давление k-го газообразного компонента, находящегося над раствором,
Kk – константа Генри для этого компонента.
Влияние температуры на процесс растворения имеет сложный характер и зависит от знака теплового эффекта процесса растворения.
Для экзотермического процесса растворения газов с ростом температуры растворимость уменьшается
Для твердых тел возможно как увеличение, так и уменьшение растворимости с ростом температуры
Слайд 10Коллигативные свойства растворов
Коллигативные (общие) свойства растворов – свойства, которые не зависят
Поведение насыщенного пара
Явление осмоса
Закон Рауля: Отношение понижения давления пара растворителя над раствором нелетучего вещества к давлению пара чистого растворителя равно мольной доле растворенного вещества.
при растворении нелетучего компонента в поверхностном слое жидкости концентрация молекул растворителя уменьшается, уменьшается и давление ее пара P по сравнению с давлением насыщенного пара над чистым растворителем P0
Слайд 11Фазовая диаграмма чистой воды
Изменение фазовой диаграммы воды при растворении в ней
раствор
Чистый растворитель
Слайд 12Следствия из закона Рауля
повышение температуры кипения раствора по сравнению с температурой
ΔTкип.= Tкип − Т0кип
ΔTкип.= Екип.⋅Сm
Екип.– эбулиоскопическая постоянная растворителя
для воды Екип.= 0,52, Т0кип = 373,1 К
для этилового спирта Екип = 1,20 Т0кип = 351,4 К
Сm - моляльная концентрация раствора
понижение температуры кристаллизации растворителя из раствора по сравнению с температурой кристаллизации чистого растворителя
ΔTкрист.= Т0крист. − Tкрист.
ΔTкрист.= Ккрист.⋅Сm
Ккрист.– криоскопическая постоянная растворителя
для воды Ккрист.= 1,86, Т0крист. = 273,1 К
для камфоры Ккрист. = 40 Т0крист. = 447,4 К
Температура кипения раствора выше температуры кипения чистого растворителя
Температура замерзания раствора ниже температуры замерзания чистого растворителя
Для растворов неэлектролитов
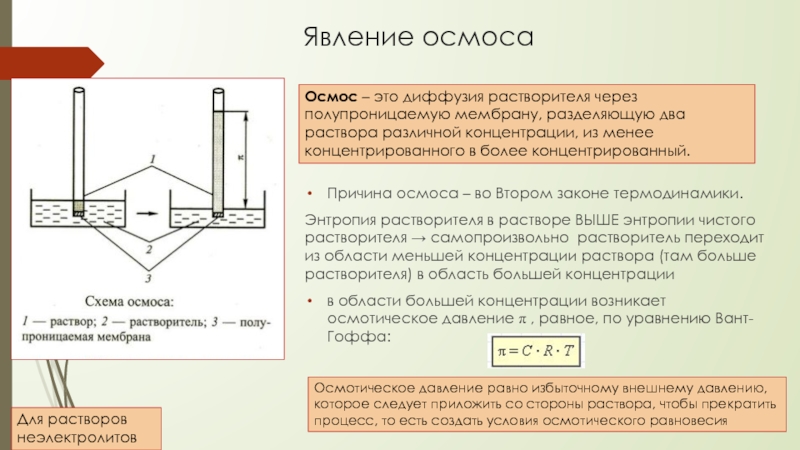
Слайд 13Явление осмоса
Причина осмоса – во Втором законе термодинамики.
Энтропия растворителя
в области большей концентрации возникает осмотическое давление π , равное, по уравнению Вант-Гоффа:
.
Осмос – это диффузия растворителя через полупроницаемую мембрану, разделяющую два раствора различной концентрации, из менее концентрированного в более концентрированный.
Осмотическое давление равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия
Для растворов неэлектролитов
Слайд 14Электролитическая диссоциация
Электролитическая диссоциация – процесс распада растворяемого вещества на ионы в
Электролиты – системы, содержащие способные к самостоятельному существованию ионы
Процесс электролитической диссоциации обусловлен тем, что среда растворителя с высоким значением диэлектрической проницаемости:
ослабляет электростатическое взаимодействие в ионных соединениях
увеличивает длину диполя полярных молекул.
Образование гидратных оболочек сопровождается выделением значительных количеств энергии
Слайд 15Количественные характеристики электролитической диссоциации
Константа электролитической диссоциации Кe.d.:
Степень электролитической диссоциации α
Коэффициент диссоциации i - количество частиц, в среднем возникающее при переходе в раствор одной молекулы растворенного вещества,
ΔTкип.= i⋅ Екип.⋅Сm
ΔTкрист.= i⋅ Ккрист.⋅Сm
n - число ионов, образующихся при полной
диссоциации растворенного вещества
π.= i⋅C⋅R⋅T
i – изотонический коэффициент Вант-Гоффа,
численно равен коэффициенту диссоциации
Слайд 16Связь константы диссоциации и степени диссоциации
Для сильно разбавленных растворов:
Закон разбавления Оствальда
Зависимость степени диссоциации α от концентрации слабого электролита в растворе с0
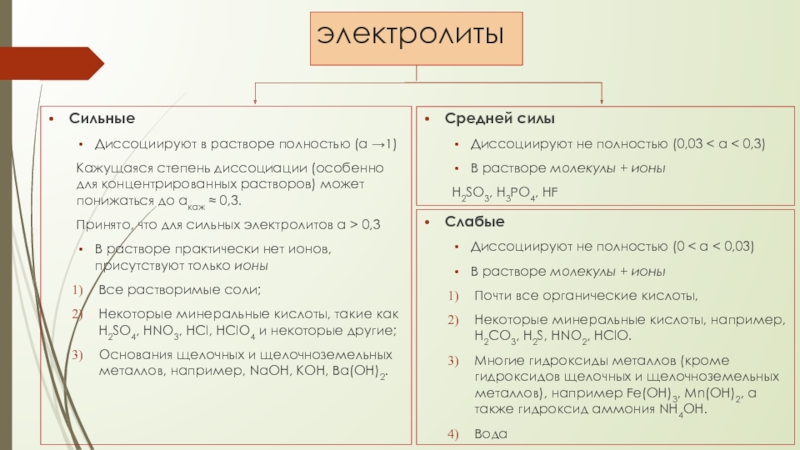
Слайд 17электролиты
Сильные
Диссоциируют в растворе полностью (α →1)
Кажущаяся степень диссоциации (особенно для
Принято, что для сильных электролитов α > 0,3
В растворе практически нет ионов, присутствуют только ионы
Все растворимые соли;
Некоторые минеральные кислоты, такие как H2SO4, HNO3, HCl, HClO4 и некоторые другие;
Основания щелочных и щелочноземельных металлов, например, NaOH, KOH, Ba(OH)2.
Слабые
Диссоциируют не полностью (0 < α < 0,03)
В растворе молекулы + ионы
Почти все органические кислоты,
Некоторые минеральные кислоты, например, H2CO3, H2S, HNO2, HClO.
Многие гидроксиды металлов (кроме гидроксидов щелочных и щелочноземельных металлов), например Fe(OH)3, Мn(OH)2, а также гидроксид аммония NH4OH.
Вода
Средней силы
Диссоциируют не полностью (0,03 < α < 0,3)
В растворе молекулы + ионы
H2SO3, H3PO4, HF
Слайд 18Электролитическая диссоциация воды
Вода – слабый электролит: при 18 °С степень диссоциации
молярная концентрация воды в воде
CH2O=Const =55,56 моль/л
ионное произведение воды.
pH= -lgCH+
pОH= -lgCОН+
pH + рОН= 14
Квод = 10-14 моль2 /л2 при 298 К





![Растворимость - предельное количество растворяющегося в растворе вещества. [г/100г растворителя]. Чем более похожи по характеру](/img/tmb/2/104235/25c102232cfc5bc77e02d4786e5f4c0d-800x.jpg)