- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Распознавание химических соединений презентация
Содержание
- 1. Распознавание химических соединений
- 2. Техника безопасности Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 3. Задание Лаборант, разлив по склянкам растворы кислот:
- 4. ~0,1 M HCl ~0,05 M H2SO4 ~0,05
- 5. ~0,1 M HCl ~0,05 M H2SO4 ~0,05
- 6. Хомякова Ирина Витальевна МБОУ СОШ №5 им.
- 7. 1. В три пробирки переносим глазной пипеткой
- 8. Качественная реакция на SO42- Pb2+ + 2Cl-
- 9. Уравнения реакций Хомякова Ирина Витальевна МБОУ СОШ
- 10. Стандартизация раствора NaOH Хомякова Ирина Витальевна МБОУ
- 11. Стандартизация раствора NaOH Хомякова Ирина Витальевна МБОУ
- 12. Определение концентрации H2SO4 Хомякова Ирина Витальевна МБОУ
- 13. Определение концентрации H2SO4 Хомякова Ирина Витальевна МБОУ
- 14. Оформление результатов Хомякова Ирина Витальевна МБОУ СОШ
- 15. Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
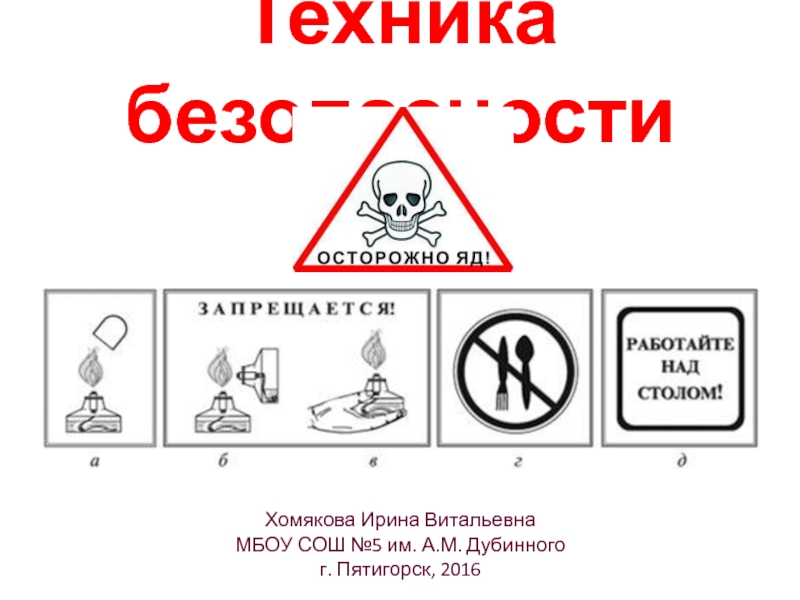
Слайд 2Техника безопасности
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск,
Слайд 3Задание
Лаборант, разлив по склянкам растворы кислот: HCl, H2SO4 и H3PO4, обнаружил,
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 4~0,1 M HCl
~0,05 M H2SO4
~0,05 M H3PO4
~0,1 M BaCl2
~0,1 M NaOH
0,0500
фенолфталеин
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
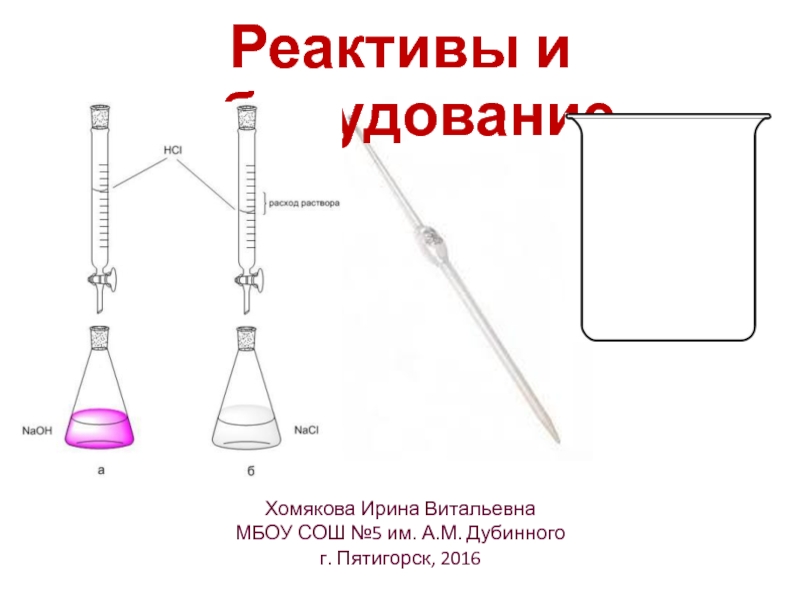
Реактивы и оборудование
Слайд 5~0,1 M HCl
~0,05 M H2SO4
~0,05 M H3PO4
~0,1 M BaCl2
~0,1 M NaOH
0,0500
фенолфталеин
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Реактивы и оборудование
Слайд 6Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Реактивы
Слайд 71. В три пробирки переносим глазной пипеткой по 10–15 капель растворов
2. В каждую пробирку добавляем по каплям раствор хлорида бария и наблюдаем, что происходит.
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Определение
cклянок с кислотами
Слайд 8Качественная реакция на SO42-
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- =
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Pb2+ + 2Cl- = PbCl2↓
Hg22+ + 2Cl- = Hg2Cl2↓
Ba2+ + SO42– = BaSO4↓
К анализируемому раствору добавить р-р BaCl2
Если выпал белый осадок, то в анализируемом растворе были ионы SO42-
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск, 2016
Слайд 9Уравнения реакций
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск,
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2H3PO4 + 3BaCl2 =Ba3(PO4)2↓ + 6HCl
Слайд 10Стандартизация раствора NaOH
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г.
С помощью воронки заполняем бюретку раствором NaOH.
В колбу для титрования переносим пипеткой Мора 10 мл раствора H2C2O4, добавляем 2–3 капли индикатора фенолфталеина и при перемешивании титруем раствором NaOH до появления бледно-розовой окраски раствора.
Записываем объём раствора щёлочи, израсходованный на титрование.
Титрование повторяем несколько раз до появления не менее трёх сходящихся результатов.
Слайд 11Стандартизация раствора NaOH
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г.
Расчёт концентрации щёлочи проводим по формуле:
Слайд 12Определение концентрации H2SO4
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г.
Заполняем бюретку раствором NaOH.
В колбу для титрования переносим пипеткой Мора 10 мл раствора H2SO4 из склянки с кислотой, добавляем 2–3 капли фенолфталеина и при перемешивании титруем раствором NaOH до появления бледно-розовой окраски раствора.
Записываем объём раствора щёлочи, израсходованный на титрование.
Титрование повторяем несколько раз до появления не менее трёх сходящихся результатов.
Слайд 13Определение концентрации H2SO4
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г.
Расчёт концентрации H2SO4 проводим по формуле:
Слайд 14Оформление результатов
Хомякова Ирина Витальевна
МБОУ СОШ №5 им. А.М. Дубинного
г. Пятигорск,
Определение кислот в склянках
Уравнения реакций (всех!!!)
Расчет концентрации H2SO4