- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Производство аммиака презентация
Содержание
- 1. Производство аммиака
- 2. Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный
- 3. Разработав технологию получения аммиака прямым
- 4. В период разработки
- 5. Массовое производство аммиака началось в канун первой
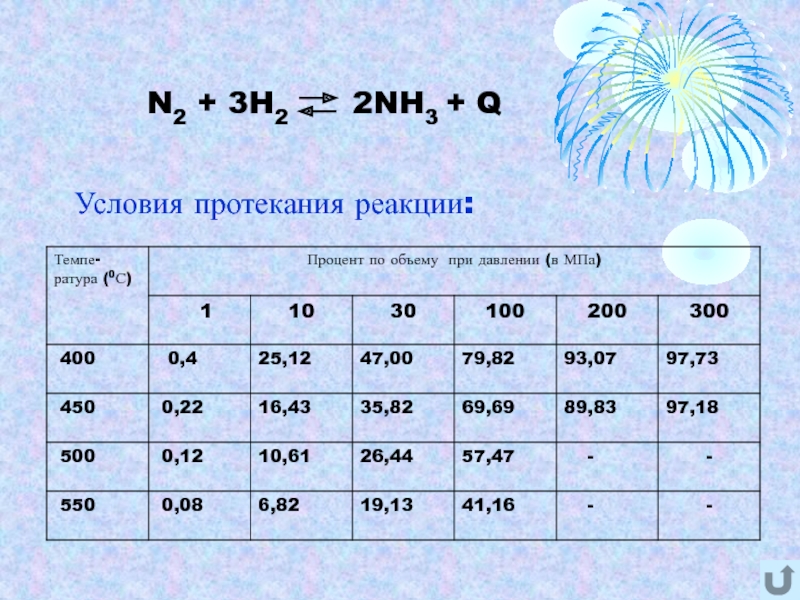
- 6. Условия протекания реакции:
- 8. Отравление аммиаком вызывает также сильное возбуждение, вплоть
- 9. Но даже несмотря на то, что производство
- 10. Использование аммиака
- 11. Медики используют водные растворы аммиака
Слайд 2 Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным
М (NH3) = 17 г/моль
Нашатырный спирт – 10%-ный раствор аммиака
Слайд 3
Разработав технологию получения аммиака прямым синтезом из азота и водорода, немецкие
Для страны, не очень богатой минеральными ресурсами, получение аммиака "из воздуха" было решением многих экономических вопросов. Более того, считается, что Германия, блокированная войсками противника, без аммиачного производства Габера и Боша не смогла бы столько времени "продержаться" в первой мировой войне.
Фриц Габер
(1868 – 1934)
Карл Бош
(1874 – 1940)
Слайд 4
В период разработки промышленного способа синтеза аммиака проводились
Поиск катализатора
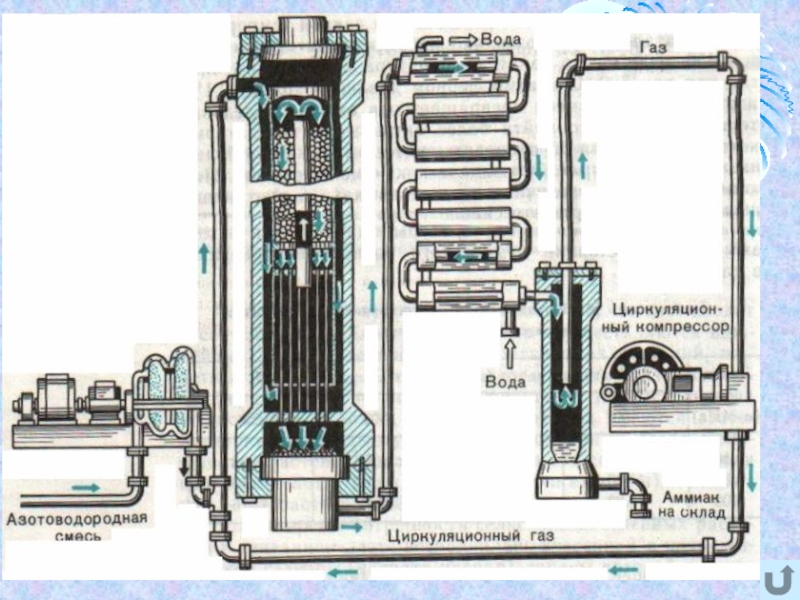
Слайд 5Массовое производство аммиака началось в канун первой мировой войны благодаря К.
Итог исследований
В результате исследований Ф. Габеру удалось обобщить сведения об этой реакции и подобрать условия для ее промышленного проведения.
Слайд 8Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия
Вред производства аммиака
Внешние признаки отравления аммиаком могут быть весьма необычными.
У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги.
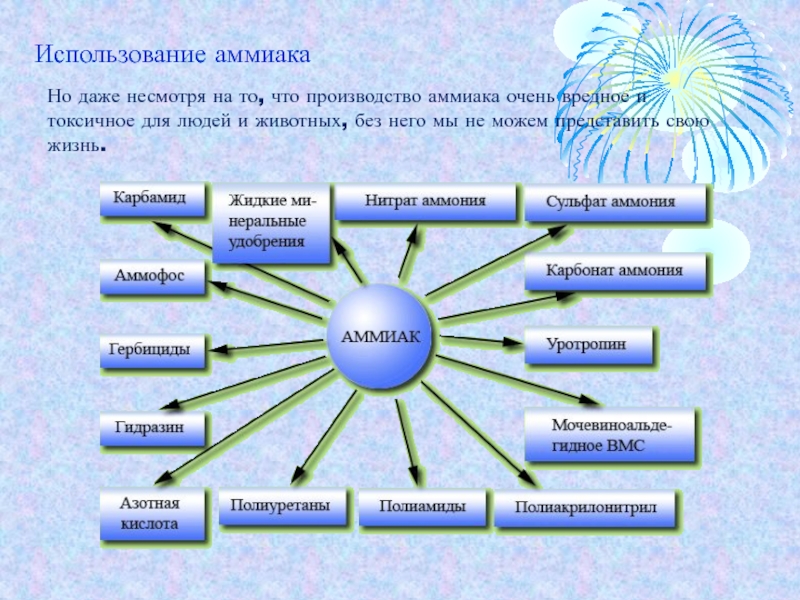
Слайд 9Но даже несмотря на то, что производство аммиака очень вредное и
Использование аммиака
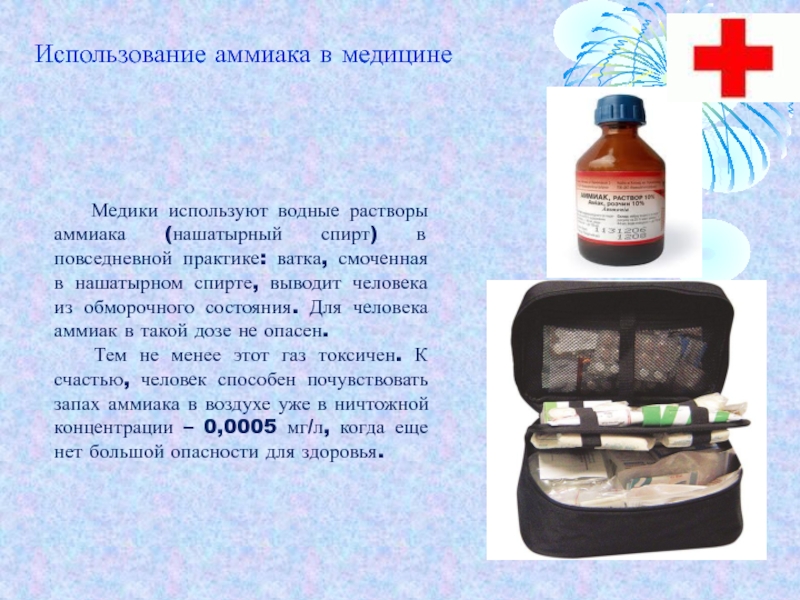
Слайд 11 Медики используют водные растворы аммиака (нашатырный спирт) в повседневной
Тем не менее этот газ токсичен. К счастью, человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья.
Использование аммиака в медицине