- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Продолжение лекции Химическая связь презентация
Содержание
- 1. Продолжение лекции Химическая связь
- 2. Дипольный момент – количественная характеристика полярности связи
- 3. Дипольный момент – векторная величина, направленная от
- 4. О=С = О = 0
- 5. Донорно-акцепторный механизм образования связи связывающие электронные пары
- 6. Кратность хим. связи - число общих электронных
- 7. Гибридизация АО Это математический прием отыскания новых
- 8. Основные положения гибридизации Гибридизуются только орбитали центрального
- 9. Гибридные орбитали более вытянуты в пространстве и
- 10. При образовании молекулы BeCl2 происходит гибридизация АО
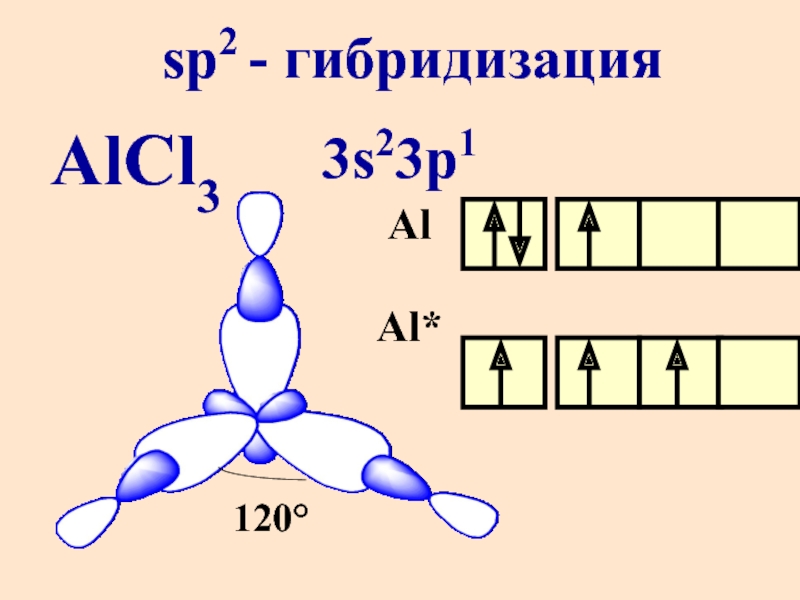
- 11. AlCl3 sp2 - гибридизация 3s23p1 Al Al* 120°
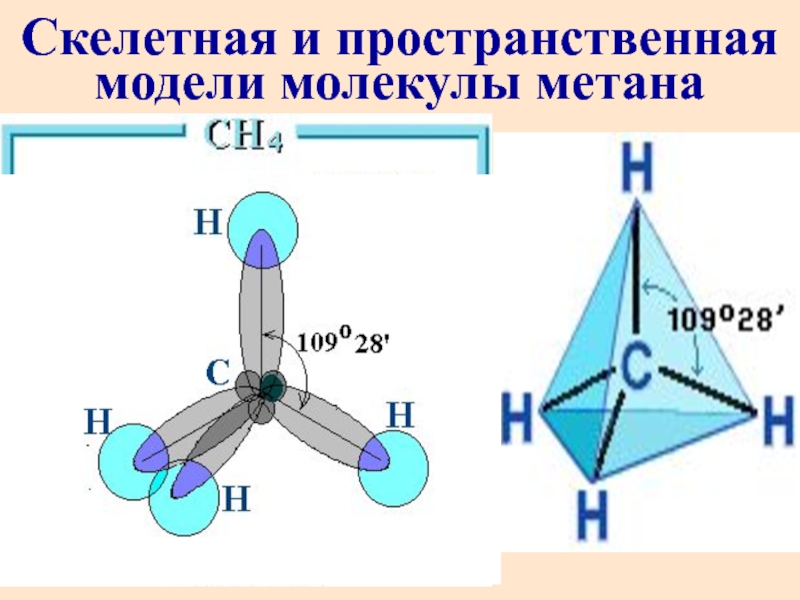
- 12. Скелетная и пространственная модели молекулы метана
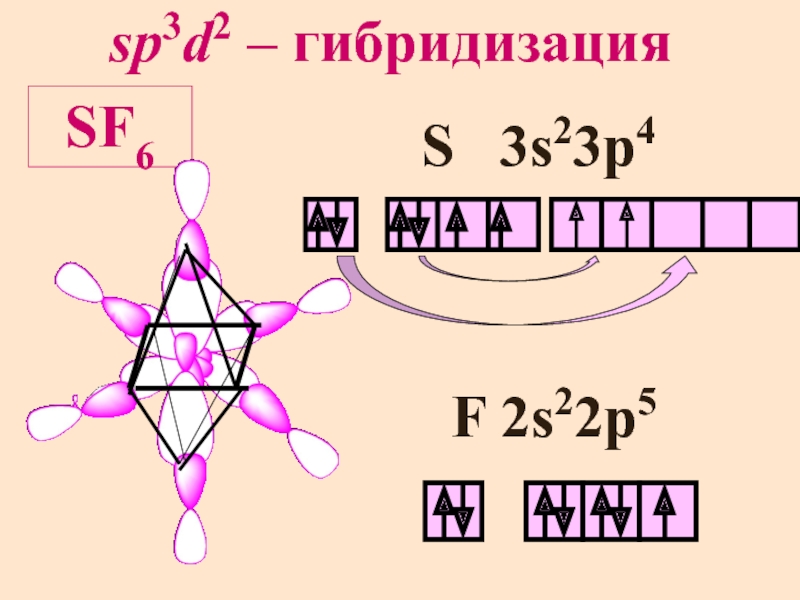
- 13. sp3d2 – гибридизация SF6 S 3s23p4 F 2s22p5
- 14. В гибридизации могут участвовать: Одноэлектронные орбитали Орбитали
- 15. Орбитали, участвующие в образовании хим. связи наз-ся
- 16. NH3 H2O sp3 - гибридизация
- 17. Метод ОЭПВО (метод Гиллеспи) (отталкивание электронных пар
- 18. Основные положения метода МО В образовании хим.св.
- 19. АО должны быть близкими по энергии
- 20. Связывающие и разрыхляющие МО Для нахождения волновых
- 21. Распределение электронов по МО в Н2 МОр МОсв АО АО
- 22. Энергетическая диаграмма позволяет определить: Магнитные свойства вещества
- 23. Изоэлектронные частицы N2, CO, NO+ имеют
- 24. O2
- 25. N2 N2
- 26. Электронная формула молекулы O2 (KK)σs2σs*2σpx2
- 27. Ионная связь Это предельный случай полярной
- 28. Ионная связь Энергия связи определяется силами
- 29. В соединениях с большой долей ионности связи
- 31. Свойства ионной связи: - ненаправленность - ненасыщаемость
- 32. Ненаправленность и ненасыщаемость В ионном соединении каждый
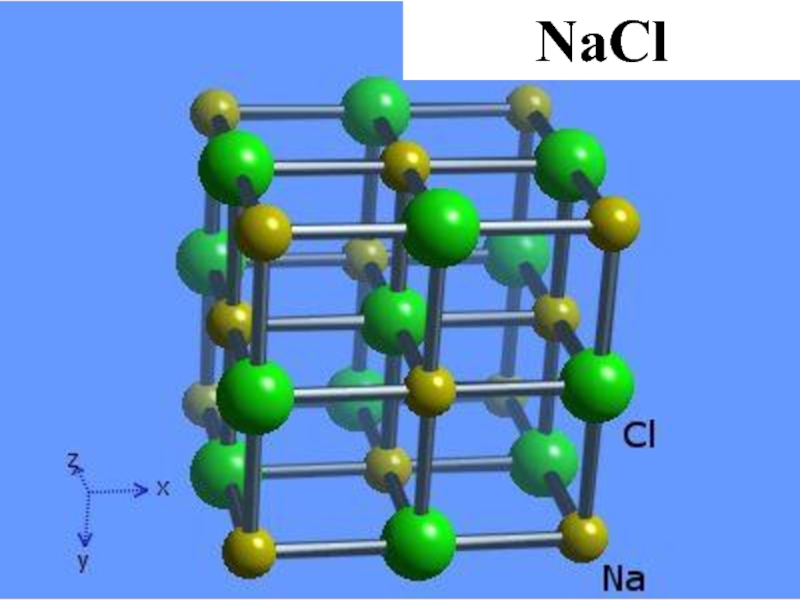
- 34. Na Cl NaCl
- 35. Ионные соединения при обычных условиях – твердые
- 36. Поляризация Это влияние друг на друга ионов,
- 37. Поляризуемость - деформация электронного облака в электрическом
- 38. Поляризуемость иона возрастает с ув-м размеров иона
- 39. Поляризующая способность ионов зависит от заряда, размера
- 40. Катионы d-элементов обладают (при одном и том
- 41. Влияние поляризации на свойства соединений: растворимость термическая устойчивость окраску
- 42. Пример AgCl хуже растворим в воде,
- 43. Пример: Оксо-кислоты менее устойчивы при нагревании, чем
- 44. Металлическая связь образуется в металлах и их
- 45. Природа металлической связи основана на обобществлении валентных
- 46. Теория электронного газа Все валентные электроны свободны
- 47. Метод МО – Зонная теория ΔЕ
- 48. ΔЕ = 0 для металлов ΔЕ ≥
- 49. Межмолекулярные взаимодействия называют силами Ван дер Ваальса
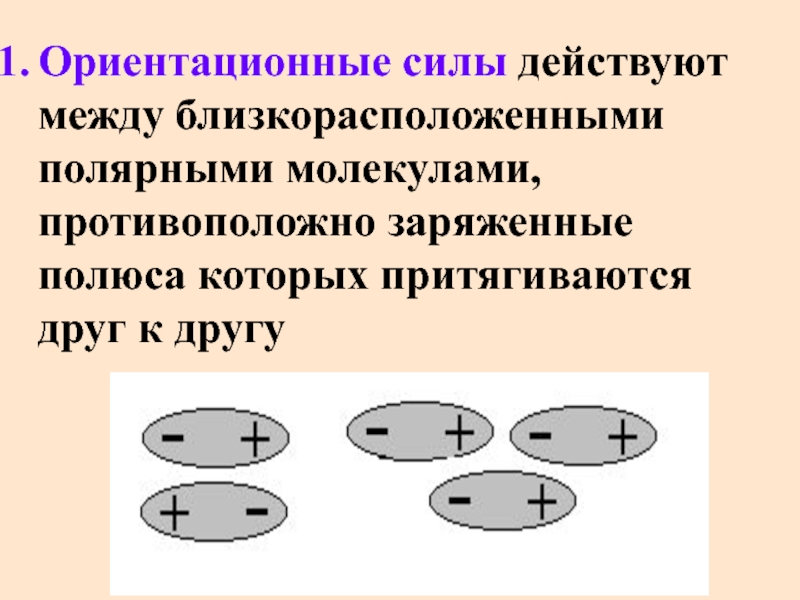
- 50. Ориентационные силы действуют между близкорасположенными полярными молекулами,
- 51. Индукционные силы возникают между полярной и неполярной
- 52. Дисперсионное взаимодействие (наиболее универсальное) Возникает в неполярных
- 53. Водородная связь Периоды t° кипения
- 54. Водородная связь бывает внутримолекулярная (чаще в орг.
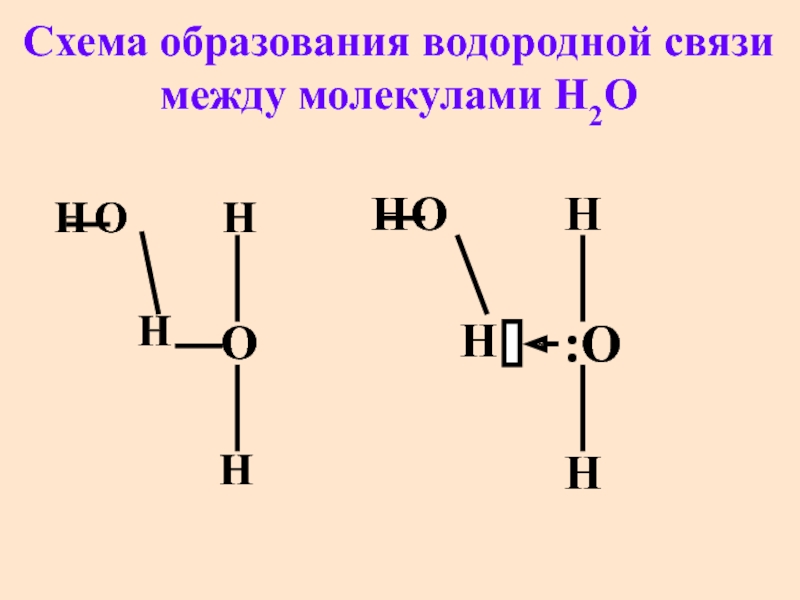
- 55. Cхема образования водородной связи между молекулами H2O
- 56. Свойства водородной связи - направленность и насыщаемость
Слайд 2Дипольный момент – количественная характеристика полярности связи
μ = qэфф⋅lдип
qэфф– эффект.
lдип – длина диполя
Дебай (D): 1D = 3,33 . 10-30 Кл⋅м
[Кл•М]
Слайд 3Дипольный момент – векторная величина, направленная от
(+) к (–)
Различают
μмол. = Σ μсв
Слайд 5Донорно-акцепторный механизм образования связи
связывающие электронные пары образуются объединением пары валентных электронов
Пример:
BF3 + F – = BF4–
B
F
Слайд 6Кратность хим. связи - число общих электронных пар, реализующих связь между
Чем выше кратность связи, тем она прочнее (кратности > 3 не бывает)
Кратность обусловлена характером перекрывания АО
Молекула F2 O2 N2
Кратность связи 1 2 3
Е св, кДж/моль 159 494 945
Слайд 7Гибридизация АО
Это математический прием отыскания новых волновых функций, удовлетворяющих условию равнопрочности
Слайд 8Основные положения гибридизации
Гибридизуются только орбитали центрального атома
Гибридизуются АО с близкой
Число гибридных орбиталей равно суммарному числу исходных орбиталей
Слайд 9Гибридные орбитали более вытянуты в пространстве и обеспечивают более полное перекрывание
Гибридные орбитали участвуют только в образовании σ-связей
Теория гибридизации объясняет направленность ковалентной связи и геометрическое строение молекул и кристаллов
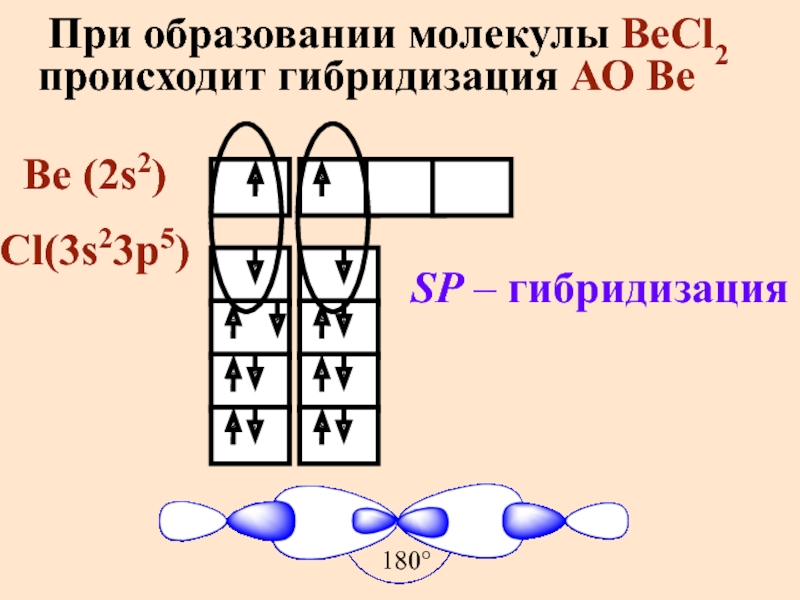
Слайд 10 При образовании молекулы BeCl2 происходит гибридизация АО Be
Be (2s2)
Cl(3s23p5)
SP – гибридизация
180°
Слайд 14В гибридизации могут участвовать:
Одноэлектронные орбитали
Орбитали со спаренными электронами
Орбитали без электронов
Геометрия молекул
Слайд 15Орбитали, участвующие в образовании хим. связи наз-ся связывающими
Орбитали, не участвующие в
Слайд 17Метод ОЭПВО (метод Гиллеспи)
(отталкивание электронных пар валентной оболочки)
Объясняет геометрическое строение молекул
Слайд 18Основные положения метода МО
В образовании хим.св. могут участвовать как пара, так
Состояние электронов в молекулах соответствует принципам min энергии, Паули и Гунда
Слайд 19 АО должны быть близкими по энергии
Из n АО образуется n
МОразр → σs*
ns(АО) + ns(АО)
МОсвяз → σs
σpx*
npx(АО) + npx(АО)
σpx
πy* πz*
npypz(АО) + npypz(АО)
πy πz
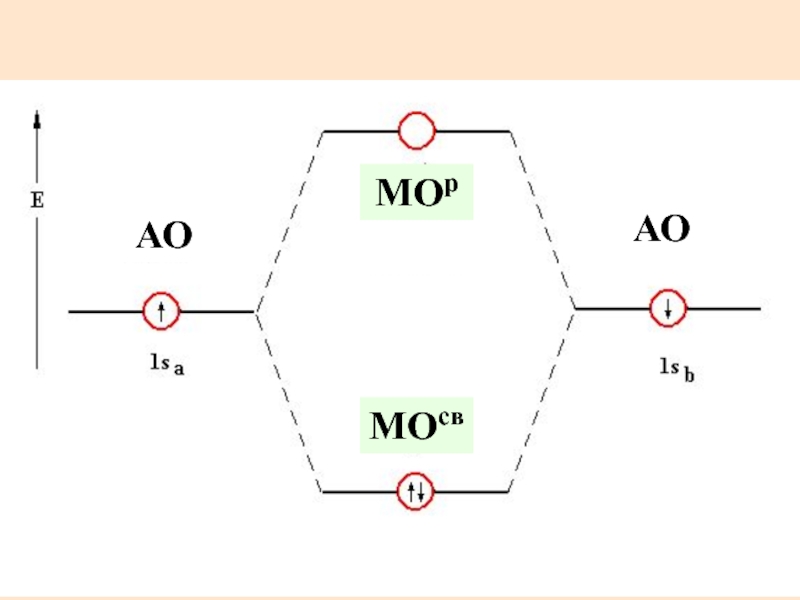
Слайд 20Связывающие и разрыхляющие МО
Для нахождения волновых функций МО используют метод ЛКАО
Из
МОсв – min энергия
МОр – max энергия
Слайд 22Энергетическая диаграмма позволяет определить:
Магнитные свойства вещества
Порядок (кратность) связи в молекуле
Порядок связи
Увеличивается или уменьшается порядок связи при отрыве или присоединении электрона
Σeсвяз - Σeразр
2
Слайд 23Изоэлектронные частицы
N2, CO, NO+
имеют одинаковый набор МО, их одинаковую энергетическую
Слайд 26Электронная формула молекулы
O2
(KK)σs2σs*2σpx2 πy2πz2πy*1πz*1
Обозначение (KK) относится к внутренним
N2
(KK)σs2σs*2σpx2πy2πz2
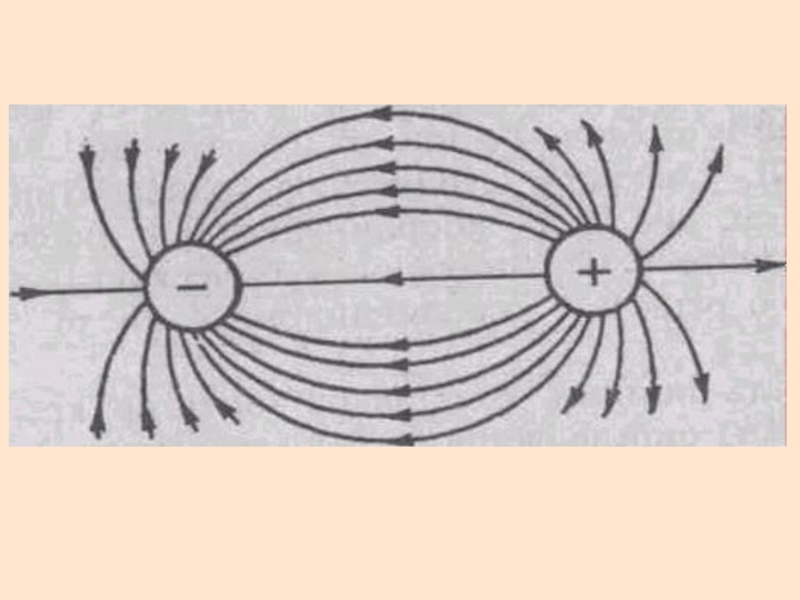
Слайд 27Ионная связь
Это предельный случай полярной ковалентной связи, когда степень ионности
или ΔЭО > 1,9
Пример: ЭОMg=1,2; ЭОО=3,5
ΔЭО = 2,3
Слайд 28Ионная связь
Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов
Ионные
Слайд 29В соединениях с большой долей ионности связи возникают не молекулы, а
Слайд 32Ненаправленность и ненасыщаемость
В ионном соединении каждый ион притягивает к себе независимо
Взаимное отталкивание противоионов ограничивает их число в окружении каждого иона
Слайд 35Ионные соединения при обычных условиях – твердые и прочные, но хрупкие
При плавлении и растворении в воде они распадаются на ионы (электролитическая диссоциация) и проводят электрический ток, т.е. являются электролитами
Слайд 36Поляризация
Это влияние друг на друга ионов, которое приводит к деформации электронных
Причина - действие электрического поля, создаваемого соседними противоположно заряженными ионами
В результате электронная оболочка смещается в сторону соседнего иона и деформируется
Слайд 37Поляризуемость - деформация электронного облака в электрическом поле
Поляризующая способность - деформирующее
Слайд 38Поляризуемость иона
возрастает с ув-м размеров иона
Li+ – Na+ – K+
F-– Cl-– Br-– I-
радиус увеличивается
поляризуемость возрастает
rкат < rат < rан
поэтому поляризуемость анионов выше поляризуемости катионов
Слайд 39Поляризующая способность ионов
зависит от заряда, размера и типа иона
Чем > заряд
При одном и том же заряде напряженность электрического поля вблизи иона тем >, чем < его размеры
Слайд 40Катионы d-элементов обладают (при одном и том же заряде и близком
Анионы характеризуются поляризуемостью, а катионы поляризующей способностью
Слайд 42Пример
AgCl хуже растворим в воде, чем NaCl и KСl
Причина
более
Слайд 43Пример: Оксо-кислоты менее устойчивы при нагревании, чем их соли
Причина - сильное
Слайд 44Металлическая связь
образуется в металлах и их сплавах Осуществляется между ионами, атомами
Причина: невысокие Еиониз. металлов обусловливают легкость отрыва валентных электронов от атомов и перемещение по всему объему кристалла
Результат: высокая тепло- и электропроводность
Слайд 45Природа металлической связи основана на обобществлении валентных электронов, т.к. валентных электронов
Слайд 46Теория электронного газа
Все валентные электроны свободны и принадлежат всей кристаллической решетке.
+
+
+
+
+
+
+
+
+
+
+
Слайд 47Метод МО – Зонная теория
ΔЕ – ширина запрещенной зоны
АО
ΔЕ
Зона
проводимости
Валентная зона
Запрещенная зона
Слайд 48ΔЕ = 0 для металлов
ΔЕ ≥ 4,0 эВ для диэлектриков
ΔЕ от
Металлическая связь ненасыщенна и ненаправлена
Слайд 49Межмолекулярные взаимодействия
называют силами Ван дер Ваальса
Обеспечивает переход из одного агрегатного
Три типа межмолекулярных взаимодействий, обусловленных электростатическим притяжением молекул
Слайд 50Ориентационные силы действуют между близкорасположенными полярными молекулами, противоположно заряженные полюса которых
Слайд 51Индукционные силы возникают между полярной и неполярной молекулами благодаря поляризуемости неполярных
Электроны и ядра неполярной молекулы смещаются в противоположных направлениях под действием электрического поля полярной молекулы
Слайд 52Дисперсионное взаимодействие (наиболее универсальное)
Возникает в неполярных молекулах, т.е. возникают мгновенные диполи
Слайд 54Водородная связь бывает внутримолекулярная (чаще в орг. молекулах) и межмолекулярная (HF,
Возникает мостиковая связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом (N, O, или F) другой молекулы