– проф. Васюк С. А.
2016
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии презентация
Содержание
- 1. Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии
- 2. План 1. Комплексные соединения их структура и
- 3. Номенклатура [Ag(NH3)2]Cl – хлорид диамминсеребра;
- 4. Классификация По знаку заряда: а) катионные
- 5. Классификация По характеру связи между составными частями
- 6. Классификация По числу центральных атомов: а) моноядерные;
- 7. Константа образования M(S)n + L ⮀
- 8. Константа образования или устойчивости β: M
- 9. Ag+ + NH3 ⮀ [AgNH3]+ [AgNH3]+
- 10. [Ag(NH3)2]Cl ⮀ [Ag(NH3)2]+ + Cl-
- 11. Константа нестойкости Кнест.
- 12. [Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+
- 13. [Ag(NH3)2]+ + I- → AgI↓+ 2NH3
- 14. Переведение комплексообразователя в другой, более прочный, комплексный
- 15. [
- 16. Разрушение комплекса путем восстановления
- 17. а) осуществляется ли реакция:
- 19. Ag2CrO4↓+ 4NH3 ⮀ 2[Ag(NH3)2]+ + CrO42-
Слайд 2План
1. Комплексные соединения их структура и классификация.
2. Константа образования и константа
нестойкости КС. Взаимосвязь между ними и их применение в анализе.
3. Влияние различных факторов на комплексообразование.
4. Понятие о ВКС
5.Применение реакций комплексообразования в аналитической химии.
3. Влияние различных факторов на комплексообразование.
4. Понятие о ВКС
5.Применение реакций комплексообразования в аналитической химии.
Слайд 3
Номенклатура
[Ag(NH3)2]Cl – хлорид диамминсеребра;
K[Ag(CN)2] – дицианоаргентат калия;
[Fe(SCN)3] – тритиоцианат железо.
Слайд 4Классификация
По знаку заряда:
а) катионные [Cu(NH3)4]2+;
б) анионные [Fe(CN)6]4-;
в) нейтральные[Fe(SCN)3]0
По принадлежности
к определенному классу соединений:
а) комплексные кислоты H[AuCl4];
б) комплексные основания [Ag(NH3)2]ОН;
в) комплексные соли K2[HgI4].
а) комплексные кислоты H[AuCl4];
б) комплексные основания [Ag(NH3)2]ОН;
в) комплексные соли K2[HgI4].
Слайд 5Классификация
По характеру связи между составными частями комплекса:
а) внутрисферные имеют непосредственную (как
пра-вило, координационную) связь центрального атома с лигандами. В свою очередь подразделяются на:
- однороднолигандные (содержат лиганды одного типа);
- смешанолигандные (содержат лиганды различной природы);
- ди- или полидентатнолигандные, образующие хелаты.
б) внешнесферные содержат дополнительные ионы или молекулы, не связанные непосредственно с центральным атомом.
- однороднолигандные (содержат лиганды одного типа);
- смешанолигандные (содержат лиганды различной природы);
- ди- или полидентатнолигандные, образующие хелаты.
б) внешнесферные содержат дополнительные ионы или молекулы, не связанные непосредственно с центральным атомом.
Слайд 6 Классификация
По числу центральных атомов:
а) моноядерные;
б) полиядерные.
По скорости образования комплексов:
а) лабильные;
б)
инертные.
По природе лигандов:
а) аквакомплексы [Co(H2O)6]SO4;
б) аммиакаты [Cu(NH3)4]SO4;
в) ацидокомплексы K4[Fe(C2O4)3];
г) гидроксидокомплексы K3[Al(OH)6] и др.
По природе лигандов:
а) аквакомплексы [Co(H2O)6]SO4;
б) аммиакаты [Cu(NH3)4]SO4;
в) ацидокомплексы K4[Fe(C2O4)3];
г) гидроксидокомплексы K3[Al(OH)6] и др.
Слайд 7Константа образования
M(S)n + L ⮀ M(S)(n-1)L + S
M(S)(n-1)L + L
⮀ M(S)(n-2)L2 + S
………………………………….
M(S)L(n-1) + L ⮀ MLn + S
………………………………….
M(S)L(n-1) + L ⮀ MLn + S
Слайд 8Константа образования или устойчивости β:
M + L ↔ [ML]
[ML]
+ L ↔ [ML2]
M + nL ↔ [MLn]
β = β1·β2…βn.
M + nL ↔ [MLn]
β = β1·β2…βn.
Слайд 10[Ag(NH3)2]Cl ⮀ [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ ⮀ [AgNH3]+ + NH3
[AgNH3]+ ⮀ Ag+
+ NH3
[Ag(NH3)2]+ ⮀ Ag+ + 2 NH3
[Ag(NH3)2]+ ⮀ Ag+ + 2 NH3
Слайд 14Переведение комплексообразователя в другой, более прочный, комплексный ион
[HgI4]2- + 4CN- ↔
[Hg(CN)4]2- + 4I-
Кнест.[HgI4]2- = 1,48∙10-30 Кнест.[Hg(CN)4]2- = 3,0∙10-42
Кнест.[HgI4]2- = 1,48∙10-30 Кнест.[Hg(CN)4]2- = 3,0∙10-42
Слайд 16
Разрушение комплекса путем восстановления или окисления комплексообразователя
2[SbCl6]3- + 3Fe → 2Sb↓
+ 3Fe2+ + 12Cl-
Е0 [SbCl6]3- / Sb↓, 6Cl- = +0,2 В; Е0 Fe2+ /Fe = -0,473 В
Е0 [SbCl6]3- / Sb↓, 6Cl- = +0,2 В; Е0 Fe2+ /Fe = -0,473 В
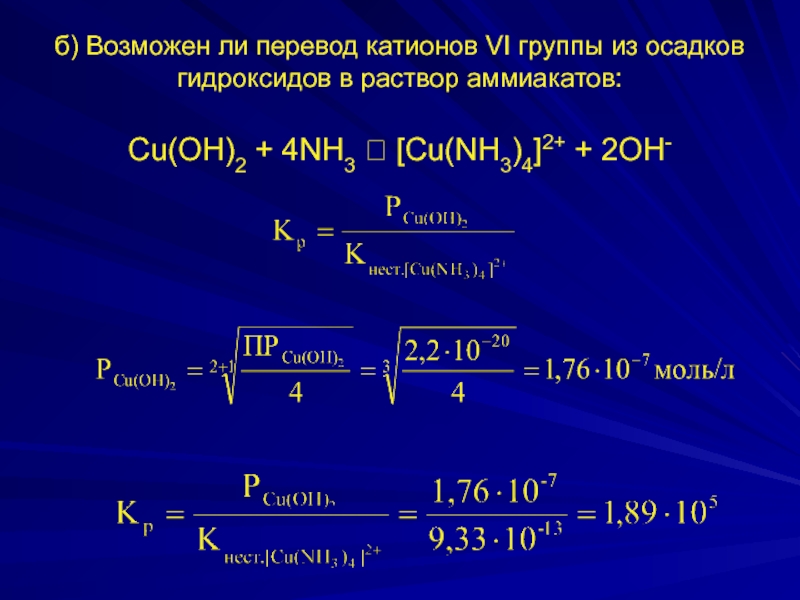
Слайд 18 б) Возможен ли перевод катионов VI группы из осадков гидроксидов в
раствор аммиакатов:
Cu(OH)2 + 4NH3 ⮀ [Cu(NH3)4]2+ + 2OH-


![Номенклатура[Ag(NH3)2]Cl – хлорид диамминсеребра;K[Ag(CN)2] – дицианоаргентат калия;[Fe(SCN)3] – тритиоцианат железо.](/img/tmb/4/327308/74cd26e1c1965f97fb2abef4a736ad6c-800x.jpg)
![Классификация По знаку заряда:а) катионные [Cu(NH3)4]2+;б) анионные [Fe(CN)6]4-;в) нейтральные[Fe(SCN)3]0 По принадлежности к определенному классу соединений:а)](/img/tmb/4/327308/5612bdd5ecf20d542888289f88a70508-800x.jpg)



![Константа образования или устойчивости β: M + L ↔ [ML] [ML] + L ↔ [ML2]](/img/tmb/4/327308/526ed4aa71a40c3a57e35a20388e5995-800x.jpg)
![Ag+ + NH3 ⮀ [AgNH3]+ [AgNH3]+ + NH3 ⮀ [Ag(NH3)2]+](/img/tmb/4/327308/cd6919b1661fd83cb8fa464dfc740604-800x.jpg)
![[Ag(NH3)2]Cl ⮀ [Ag(NH3)2]+ + Cl-[Ag(NH3)2]+ ⮀ [AgNH3]+ + NH3[AgNH3]+ ⮀ Ag+ + NH3[Ag(NH3)2]+ ⮀ Ag+](/img/tmb/4/327308/eb752b3aae261875590349cd401b817e-800x.jpg)

![[Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+](/img/tmb/4/327308/a26a68233ed0e4d09437aa5bb676cf93-800x.jpg)
![[Ag(NH3)2]+ + I- → AgI↓+ 2NH3](/img/tmb/4/327308/6ed5a52f84fd3ded86cacc9733749778-800x.jpg)
![Переведение комплексообразователя в другой, более прочный, комплексный ион[HgI4]2- + 4CN- ↔ [Hg(CN)4]2- + 4I-Кнест.[HgI4]2- =](/img/tmb/4/327308/6a891842dfff0dde3f2690d4c6e829ed-800x.jpg)
![[[М(NH3)n]2+ + nH+ → M2+ + nNH4+ где M = Cu2+, Cd2+, Co2+, Ni2+](/img/tmb/4/327308/a1bab15452aafe7f84c9c52c0d5ab73c-800x.jpg)
![Разрушение комплекса путем восстановления или окисления комплексообразователя2[SbCl6]3- + 3Fe → 2Sb↓ + 3Fe2+ + 12Cl-Е0](/img/tmb/4/327308/2cdb52ed7b006ae87be61b34f9e69d2e-800x.jpg)
![а) осуществляется ли реакция: AgСl + 2NH3 ⮀ [Ag(NH3)2]+](/img/tmb/4/327308/48a161bda6837d51a25abd6d91b5077d-800x.jpg)
![Ag2CrO4↓+ 4NH3 ⮀ 2[Ag(NH3)2]+ + CrO42-](/img/tmb/4/327308/a7f3d92d22745e3e1bc3e2da48f00bf9-800x.jpg)





