- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии презентация
Содержание
- 1. Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
- 2. План 1. Протолитическая теория кислот и оснований.
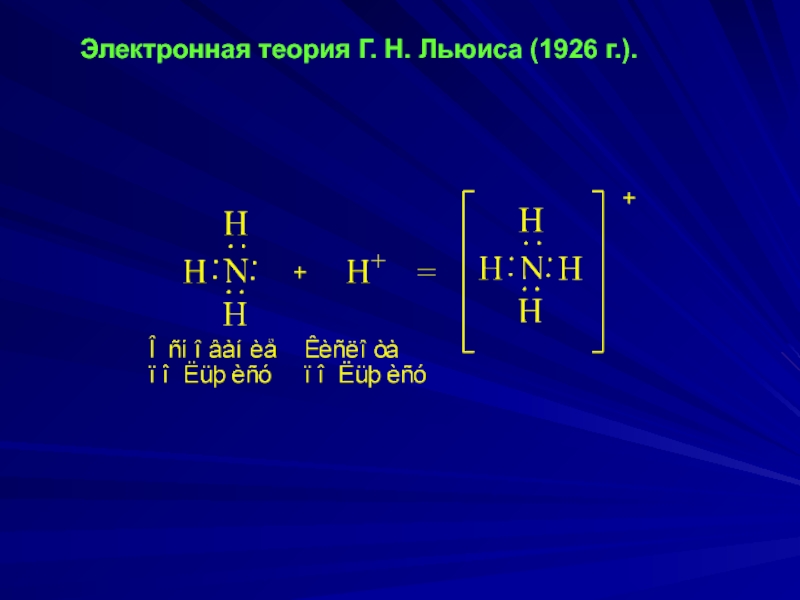
- 3. Электронная теория Г. Н. Льюиса (1926 г.).
- 4. Протолитическая теория кислот и оснований (ПТКО) Бренстеда-Лоури
- 5. НА + В ⮀ НВ+
- 6. Кислоты: молекулярные (нейтральные) НА: HCl, HNO3,
- 7. Основания: молекулярные (нейтральные) В: NH3, CH3-NH2,
- 8. Амфолиты: анионные кислоты, они же анионные
- 9. Амфолиты: нейтральные молекулы В: [Zn(OH)2(H2O)2], [Al(OH)3(H2O)3], [Cr(OH)3(H2O)3].
- 10. Амфолиты: катионные основания, они же катионные
- 11. Протолитические равновесия в воде H2O + H2O
- 12. Протолитические равновесия в воде КС∙[Н2О] = КН2О
- 13. Протолитические равновесия в воде рКw = -
- 14. Шкала рН
- 15. [H3O+] = 10-рН
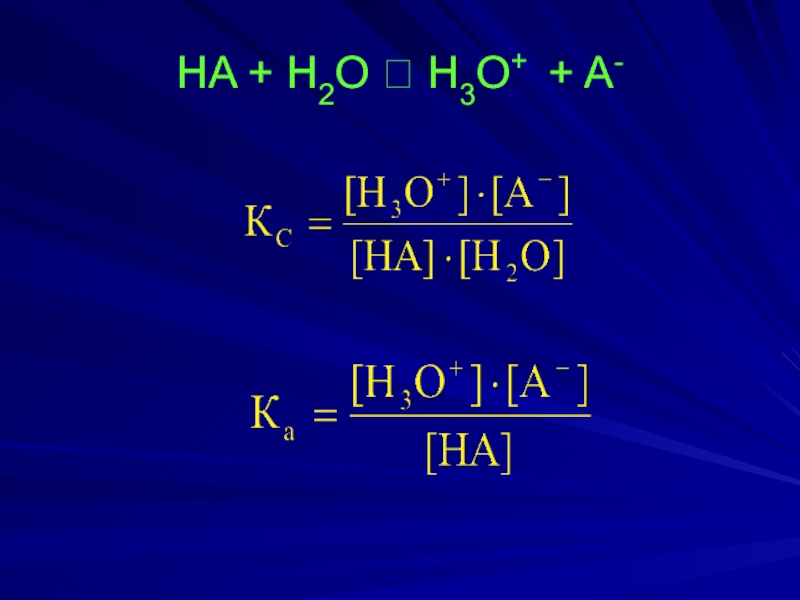
- 16. HA + H2О ⮀ H3O+
- 17. B + H2O
- 18. закон разбавления (законом
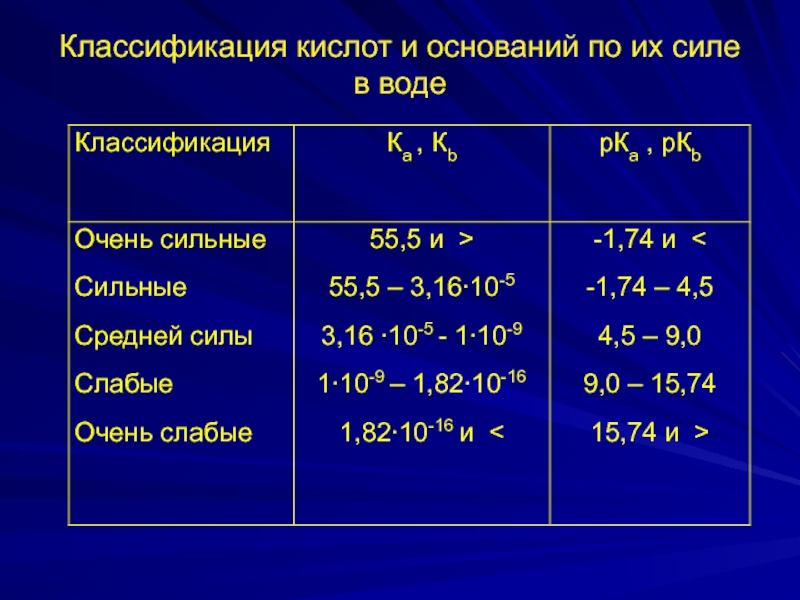
- 20. Классификация кислот и оснований по их силе в воде
- 21. Автопротолиз CH3СООН + CH3СООН ⮀ CH3COO-
- 22. Поскольку [НSolv] = const, то
- 23. Степень сольволиза
- 24. Кислотные: CH3COOH + CH3COONa
- 25. HA + ОH- ⇄
- 26. Буферная емкость
- 28. Кислотные свойства: Основные свойства:
- 29. Bi(OH)3 + H2O ⮀ H2BiO3- + H3O+
- 30. Для реакции Pb(OH)2 + H2O ⮀
Слайд 1 ПРИМЕНЕНИЕ ЗДМ К КИСЛОТНО-ОСНОВНЫМ РАВНОВЕСИЯМ И ИХ РОЛЬ В АНАЛИТИЧЕСКОЙ ХИМИИ лектор
– проф. Васюк С. А.
2016
Слайд 2План
1. Протолитическая теория кислот и оснований. Типы протолитов.
2. Протолитические равновесия в
воде, шкала рН.
3. Сила кислот и оснований, константы кислотности и основности.
4. Вычисления рН и рОН в водных растворах.
5. Протолитическое равновесие в неводных растворителях. Константа автопротолиза.
6. Гидролиз.
7. Протолитическое равновесие в буферных растворах.
8. Протолитическое равновесие в растворах амфолитов.
9. Роль кислотно-основных равновесий в аналитической химии.
3. Сила кислот и оснований, константы кислотности и основности.
4. Вычисления рН и рОН в водных растворах.
5. Протолитическое равновесие в неводных растворителях. Константа автопротолиза.
6. Гидролиз.
7. Протолитическое равновесие в буферных растворах.
8. Протолитическое равновесие в растворах амфолитов.
9. Роль кислотно-основных равновесий в аналитической химии.
Слайд 4Протолитическая теория кислот и оснований (ПТКО) Бренстеда-Лоури
НА ⮀ Н+ + А-
а1 b1
В + Н+ ⮀ НВ+
b2 а2
В + Н+ ⮀ НВ+
b2 а2
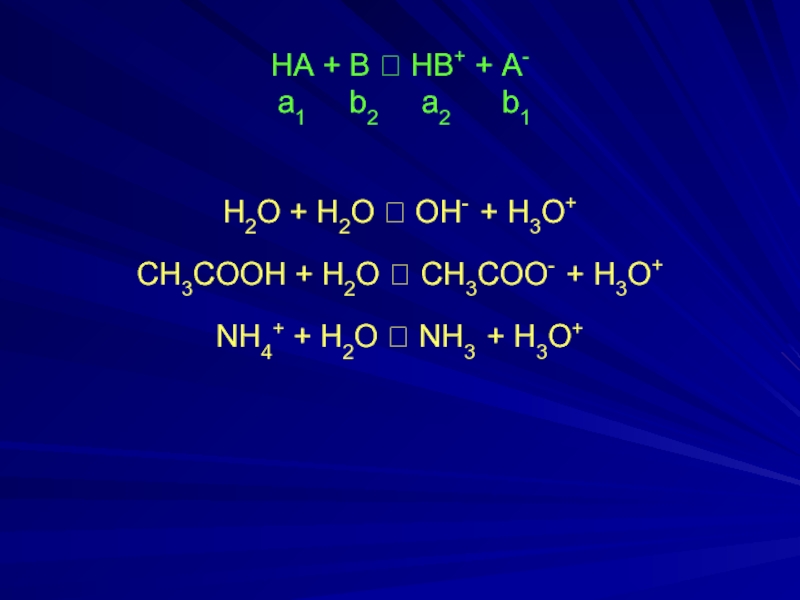
Слайд 5 НА + В ⮀ НВ+ + А- а1
b2 а2 b1
H2O + H2O ⮀ OH- + H3O+
CH3COOH + H2O ⮀ CH3COO- + H3O+
NH4+ + H2O ⮀ NH3 + H3O+
Слайд 6Кислоты:
молекулярные (нейтральные) НА: HCl, HNO3, H2SO4, HCN, CH3COOH.
катионные ВН+:
H3O+, NH4+, [Al(H2O)6]3+.
анионные НА-: HSO3-, H2PO4-, HCO3-, HC2O4-, HC4H4O6-.
анионные НА-: HSO3-, H2PO4-, HCO3-, HC2O4-, HC4H4O6-.
Слайд 7Основания:
молекулярные (нейтральные) В: NH3, CH3-NH2, C6H5N, NaOH, H2N-NH2.
катионные В+:
H2N-NH3+, [Zn(OH)(H2O)3]+.
анионные А-: Сl-, OH-, CN-, CH3СOO-, CO32-, SO42-.
анионные А-: Сl-, OH-, CN-, CH3СOO-, CO32-, SO42-.
Слайд 8Амфолиты:
анионные кислоты, они же анионные основания НА-: HSO3-, H2PO4-, HCO3-,
HC2O4-, HC4H4O6-.
Слайд 10Амфолиты:
катионные основания, они же катионные кислоты В+: H2N-NH3+, [Zn(OH)(H2O)3]+, [Al(OH)2(H2O)4]+,
[Cr(OH)2(H2O)4]+.
Слайд 11Протолитические равновесия в воде
H2O + H2O ⮀ OH- + H3O+
H2О ⮀
H+ + OH-
В разбавленных растворах концентрация воды как растворителя постоянна и равна 1000,0/18,0 = 55,56 моль/л.
(при 25°С, табличные данные)
В разбавленных растворах концентрация воды как растворителя постоянна и равна 1000,0/18,0 = 55,56 моль/л.
(при 25°С, табличные данные)
Слайд 12Протолитические равновесия в воде
КС∙[Н2О] = КН2О = Кw = 1,86∙10-16 ∙55,56
=10-14
КН2О = Кw =[H3O+] ∙ [OH-] =10-14
или упрощенно Kw = [H+] ∙ [OH-]
КН2О = Кw =[H3O+] ∙ [OH-] =10-14
или упрощенно Kw = [H+] ∙ [OH-]
Слайд 13Протолитические равновесия в воде
рКw = - lg Kw = -lg 10-14
= 14
[H3O+] = [OH-] = 10-7
рН = - lg [H3O+] = - lg 10-7 = 7
рОН = - lg [ОH-] = - lg 10-7 = 7
pKw = pH + pOH = 14
рKw = рН + рОН
[H3O+] = [OH-] = 10-7
рН = - lg [H3O+] = - lg 10-7 = 7
рОН = - lg [ОH-] = - lg 10-7 = 7
pKw = pH + pOH = 14
рKw = рН + рОН
Слайд 15
[H3O+] = 10-рН [OH-] = 10-рОН
При 100°С (Кw
= 55∙10-14) чистая вода имеет рН = 6,12.
При 15°С (Кw = 0,46∙10-14) – рН = 7,17.
При 15°С (Кw = 0,46∙10-14) – рН = 7,17.
Слайд 21Автопротолиз
CH3СООН + CH3СООН ⮀ CH3COO- + CH3COOH2+
NH3 + NH3 ⮀ NH2- + NH4+
CH3ОН + CH3ОН ⮀ CH3O- + CH3OH2+
HSolv + HSolv ⮀ H2Solv+ + Solv-
Слайд 22
Поскольку [НSolv] = const, то
КС∙[НSolv] = const = Ks
Ks = [H2Solv+]∙[Solv-]
рКs
= рH2Solv + рSolv
Слайд 24
Кислотные:
CH3COOH + CH3COONa (pH = 3,8 – 6,3)
HCl
+ H2N-CH2-COOH (pH =1,1 – 3,5)
KH2PO4 + Na2HPO4 (pH = 4,8 – 8,0)
Основные:
Na2B4O7 + HCl (pH = 7,71 – 9,23)
Na2B4O7 + H2N-CH2-COOH (pH = 9,23 – 11,02)
NaOH + H2N-CH2-COOH (pH = 8,53 – 12,90)
NH4OH + NH4Cl (pH до 10,24)
Универсальные:
буферный раствор H3BO3 + H3PO4 + CH3COOH + NaOH
(pH = 1,8 –11,98)
Буферные растворы индивидуальных веществ:
а) нас. водный раствор гидротартрата калия КНС4Н4О6
(рН = 3,567 при 25°С);
б) 0,05 М водный раствор гидрофталата калия КНС8Н4О4
(рН = 4,008 при 25°С);
в) 0,05 М водный раствор тетрабората натрия Na2B4O7·10Н2О
(рН = 9,18 при 25°С).
KH2PO4 + Na2HPO4 (pH = 4,8 – 8,0)
Основные:
Na2B4O7 + HCl (pH = 7,71 – 9,23)
Na2B4O7 + H2N-CH2-COOH (pH = 9,23 – 11,02)
NaOH + H2N-CH2-COOH (pH = 8,53 – 12,90)
NH4OH + NH4Cl (pH до 10,24)
Универсальные:
буферный раствор H3BO3 + H3PO4 + CH3COOH + NaOH
(pH = 1,8 –11,98)
Буферные растворы индивидуальных веществ:
а) нас. водный раствор гидротартрата калия КНС4Н4О6
(рН = 3,567 при 25°С);
б) 0,05 М водный раствор гидрофталата калия КНС8Н4О4
(рН = 4,008 при 25°С);
в) 0,05 М водный раствор тетрабората натрия Na2B4O7·10Н2О
(рН = 9,18 при 25°С).
Слайд 25
HA + ОH- ⇄ A- + H2O
A- + H3O+ ⇄ HA + H2О
СН3СООН + ОH- ⇄ СН3СОО- + H2O СН3СОО- + H3O+ ⇄ СН3СООН + H2О
NH4+ + ОH- ⇄ NH3 + H2O NH3 + H3O+ ⇄ NH4+ + H2О
СН3СООН + ОH- ⇄ СН3СОО- + H2O СН3СОО- + H3O+ ⇄ СН3СООН + H2О
NH4+ + ОH- ⇄ NH3 + H2O NH3 + H3O+ ⇄ NH4+ + H2О



![Кислоты: молекулярные (нейтральные) НА: HCl, HNO3, H2SO4, HCN, CH3COOH. катионные ВН+: H3O+, NH4+, [Al(H2O)6]3+. анионные](/img/tmb/4/369306/feaaa2290b74cb02a428af97dfb1931d-800x.jpg)
![Основания: молекулярные (нейтральные) В: NH3, CH3-NH2, C6H5N, NaOH, H2N-NH2. катионные В+: H2N-NH3+, [Zn(OH)(H2O)3]+. анионные А-:](/img/tmb/4/369306/ac567a292b8bdecaad8053b1259d0ee3-800x.jpg)

![Амфолиты: нейтральные молекулы В: [Zn(OH)2(H2O)2], [Al(OH)3(H2O)3], [Cr(OH)3(H2O)3].](/img/tmb/4/369306/aad347b5900d7830931cef75b170a9db-800x.jpg)
![Амфолиты: катионные основания, они же катионные кислоты В+: H2N-NH3+, [Zn(OH)(H2O)3]+, [Al(OH)2(H2O)4]+, [Cr(OH)2(H2O)4]+.](/img/tmb/4/369306/fa7ccdef316075f1a980d055a13e18de-800x.jpg)

![Протолитические равновесия в водеКС∙[Н2О] = КН2О = Кw = 1,86∙10-16 ∙55,56 =10-14 КН2О = Кw](/img/tmb/4/369306/87a3c36b0487a2900588b909d975d818-800x.jpg)
![Протолитические равновесия в водерКw = - lg Kw = -lg 10-14 = 14[H3O+] = [OH-]](/img/tmb/4/369306/63514fa2f74f494e1e6789f1faf3a020-800x.jpg)

![[H3O+] = 10-рН [OH-] = 10-рОН При 100°С (Кw = 55∙10-14) чистая вода](/img/tmb/4/369306/33c5285e591f8412c2b396b3ea556e56-800x.jpg)




![Поскольку [НSolv] = const, тоКС∙[НSolv] = const = KsKs = [H2Solv+]∙[Solv-]рКs = рH2Solv + рSolv](/img/tmb/4/369306/9f250498a0156be98409fe9a540d44ac-800x.jpg)






![Bi(OH)3 + H2O ⮀ H2BiO3- + H3O+В сильно щелочной среде [H3O+] = 10-14 моль/л](/img/tmb/4/369306/2112d42426712447d043d91a4234b0f8-800x.jpg)
![Для реакции Pb(OH)2 + H2O ⮀ HPbO2- + H3O+В сильно щелочной среде [H3O+] = 10-14](/img/tmb/4/369306/41864d166c1fe928716e151cc2be21dd-800x.jpg)